基于进展期胃癌患者探索胸椎截面的骨骼肌指数在肌少症诊断和预后中的应用
2023-11-30蒋智轩鲁杨滨黄坚强邵建灿高泽侃支怀庆沈擎正沈贤
蒋智轩,鲁杨滨,黄坚强,邵建灿,高泽侃,支怀庆,沈擎正,沈贤
1.温州医科大学附属第二医院育英儿童医院 胃肠外科,浙江 温州 325027;2.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015
肌肉减少症(肌少症)是一种进行性、全身性的疾病,表现为与年龄相关的肌肉质量减少、肌肉力量下降和/或体能低下[1-2]。多项研究表明,肌少症影响肿瘤患者手术预后,包括增加术后并发症发生率、病死率,延长住院时间,降低生存率等[3-6]。 肌少症的诊断涵盖全身骨骼肌肌肉量的减少以及机体活动能力的退化,其中对于肌肉量的测定,可使用生物电阻抗分析、双能X线吸收法等。而在临床上,常使用CT进行肿瘤分期评估和各种疾病的诊断,同样CT也可用于肌少症的诊断[7]。CT通过设定不同阈值(肌肉组织:-29~+150 Hu,脂肪组织:-190~-30 Hu)可针对性地显示身体成分,被认为是目前简易且有效的诊断方法[8]。第三腰椎(L3)的骨骼肌面积已被证明与身体肌肉分布密切相关[9], 是目前CT诊断肌少症常用的节段选择之一。胸部CT扫描不涵盖L3区域,对于仅需要单独接受胸部CT检查的患者来说,如何在不额外增加CT扫描的基础上诊断肌少症是值得探讨的问题。因此,本研究的目的在于分析第12胸椎(T12)水平测量的骨骼肌指数(skeletal muscle mass index, SMI)诊断肌少症的可行性。
1 对象和方法
1.1 研究对象 选取2014年7月至2019年3月在温州医科大学附属第一医院接受胃癌根治术的1 145例胃癌患者。纳入标准:①胃癌根治术前2个月内完成胸部和腹部CT的检查;②未发生围手术期死亡。排除标准:①术前接受新辅助治疗;②早期胃癌;③不能耐受或拒绝接受肌肉力量和体能测验;④CT图像质量差或伪影;⑤未完成3年随访(非死亡患者)。最终纳入1 096例胃癌患者,其中男806例,女290例。所有胃癌患者均接受开放性或腹腔镜胃癌根治术,淋巴结清扫范围D2以上,根据外科医师的经验和术中患者情况选择吻合方式[10-11]。 术后根据肿瘤分期及患者意愿,按照日本胃癌治疗指南进行化疗方案的选择[12]。所有患者第1年每3个月随访1次,第2~3年每6个月随访1次,此后每年随访1次,至少随访3年以上,直至死亡。收集的临床资料包括性别、年龄、身高、体质量、身体质量指数(body mass index, BMI)、术后吻合口瘘、术后胃瘫、术后住院时间、总生存时间(overall survival, OS)。本研究获温州医科大学附属第一医院伦理委员会的批准(编号:KY2023-R006)。
1.2 方法
1.2.1 CT图像骨骼肌数据的获取:所有胃癌患者在手术前完成胸部CT和腹部CT检查。胸部CT图像选择T12锥体下缘且肋突清晰可见水平的截面;腹部CT图像选择L3椎体下缘且横突完全可见水平的截面[13]。如图1所示,根据皮下脂肪组织CT值(-190~ -30 Hu)骨骼肌组织CT值(-29~+150 Hu)划分不同组织[8]。L3水平的肌肉包括腰大肌、竖脊肌、腰方肌、腹横肌、内外斜肌和腹直肌。T12水平的肌肉包括竖脊肌、背阔肌、外斜肌和内斜肌、腹直肌以及外肋间肌和内肋间肌。由两位经验丰富的技术员运用专门的CT图像处理系统(ITK-SNAP)分别处理获得T12和L3水平的图像数据如骨骼肌面积(skeletal muscle area, SMA),皮下脂肪面积(subcutaneous fat area, SFA),骨骼肌密度(skeletal muscle density, SMD)和SMI,其中SMI=SMA/身高的平 方(cm2/m2)。结果取两位技术员测量结果的平均值。
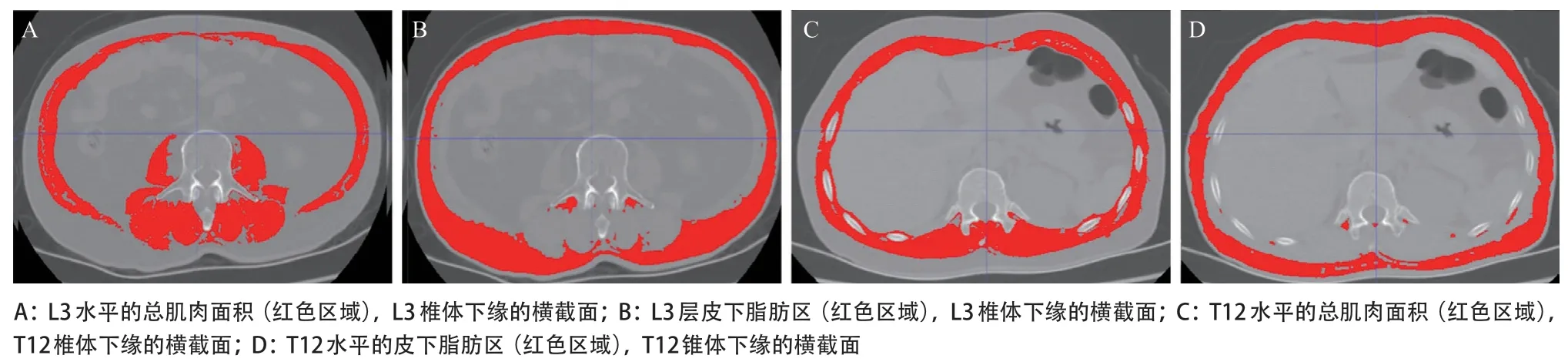
图1 L3和T12水平的肌肉和脂肪区域勾画示意图
1.2.2 肌肉力量和体能测验数据的获取:所有胃癌患者于入院后第1天测量握力,并记录3次重复测试的最大值,每次间隔15 min。测量体位选择站立位伸肘180°,用主手缓慢挤压电子手测力仪(EH101,广东中山凯美瑞电子有限公司)以测试术前握力,记录最大数值[2]。体能测验选择6米步速试验,胃癌患者于入院当天测量6米步速试验,并记录3次重复试验的最短时间,每次间隔休息15 min,选择手动秒表记录[2]。握力和6米步速试验均由专业的观察员进行。
1.2.3 截断值的选取和CT定义下肌少症的选择:根据本课题组既往研究[14],将L3下缘平面的骨骼肌指数(SMI-L3)≤40.8 cm2/m2的男性或≤34.9 cm2/m2的女性被定义为低SMI;握力<26 kg的男性或握力<18 kg的女性被定义为低握力;步速<0.8 m/s的受试者无论男女均被定义为低步速。CT定义下的肌少症诊断标准为在低SMI的前提下合并低握力或低步速。
1.3 统计学处理方法 采用SPSS25进行统计分析。正态性检验选择Shapiro-Wilk,正态分布计量资料用表示,2组间比较采用独立样本t检验,非正态分布数据用M(P25,P75)表示,2组间比较采用秩和检验。计数资料用频数和百分数表示,2组间比较采用χ2检验。通过ROC曲线来计算T12下缘平面的骨骼肌指数(SMI-T12)的截断值,并计算截断值对应的灵敏度、特异度和曲线下面积。通过Pearson或Spearman相关性分析探讨T12水平和L3水平CT图像参数之间的相关性。采用多元线性回归分析比较T12水平下诊断的肌少症[肌少症-T12(+)]和L3水平下诊断的肌少症[肌少症-L3(+)]与术后住院时间的差异。采用单因素Logistic回归分析分别评估肌少症-T12(+)和肌少症-L3(+)与术后并发症之间的差异性。采用Kaplan-Meier(K-M)生存分析和COX回归分析来分析肌少症-T12(+)和肌少症-L3(+)的对术后生存的影响。P<0.05为差异有统计学意义。
2 结果
2.1 SMI-T12截断值的获取 根据L3水平的截断值[14],154例(14.1%)胃癌患者被诊断为肌少症。基于此结果,绘制SMI-T12与肌少症的ROC曲线得出SMI-T12的截断值,男性为29.2 cm2/m2,女性为25.3 cm2/m2。男性截断值所对应的灵敏度、特异度和曲线下面积分别为79.3%、77.0%和0.858;女性截断值所对应的灵敏度、特异度和曲线下面积分别为71.0%、61.8%和0.737。
T12 水平下诊断的肌少症胃癌患者有167 例(15.2%),其中男106例(13.2%),女61例(24%)。T12水平SMI相较于L3水平SMI,对肌少症的检出率差异无统计学意义(P=0.188)。
2.2 患者的基线资料分析 入选的1 096 例胃癌患者中男290例(26.5%),女806例(73.5%)。女性胃癌患者的年龄、身高、体质量均高于男性(P<0.001)。男性SMA-T12、SMA-L3、SMI-T12、SMI-L3、SMD-T12和SMD-L3均显著低于女性(P<0.001),而男性低握力、低步速、SFA-T12、SFA-L3、低SMIT12、低SMI-L3、肌少症-T12(+)和肌少症-L3(+)显著高于女性(P<0.001),见表1。由于身体成分参数在性别中存在差异性,因此本研究根据性别分层进行。
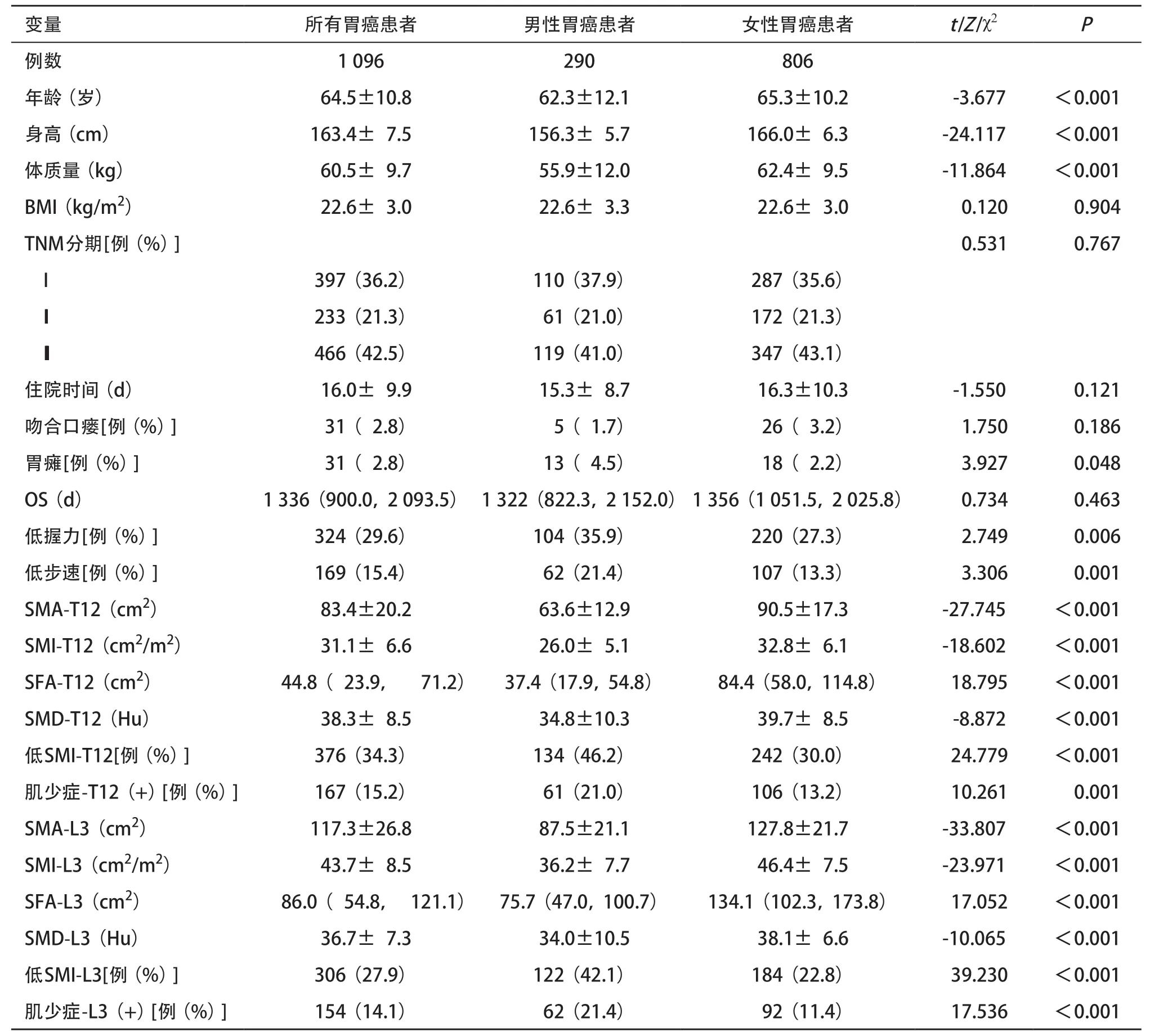
表1 患者基本特征比较
2.3 CT图像数据的相关性分析 相关性分析结果表明,在男性患者中SMI(r=0.800,P<0.001)、SFA(r=0.882,P<0.001)和SMD(r=0.597,P< 0.001)在T12与L3 层面之间具有相关性;同样在女性患者中,SMI(r=0.739,P<0.001)、SFA(r= 0.884,P<0.001)和SMD(r=0.868,P<0.001)在T12与L3层面之间也具有相关性。见图2。
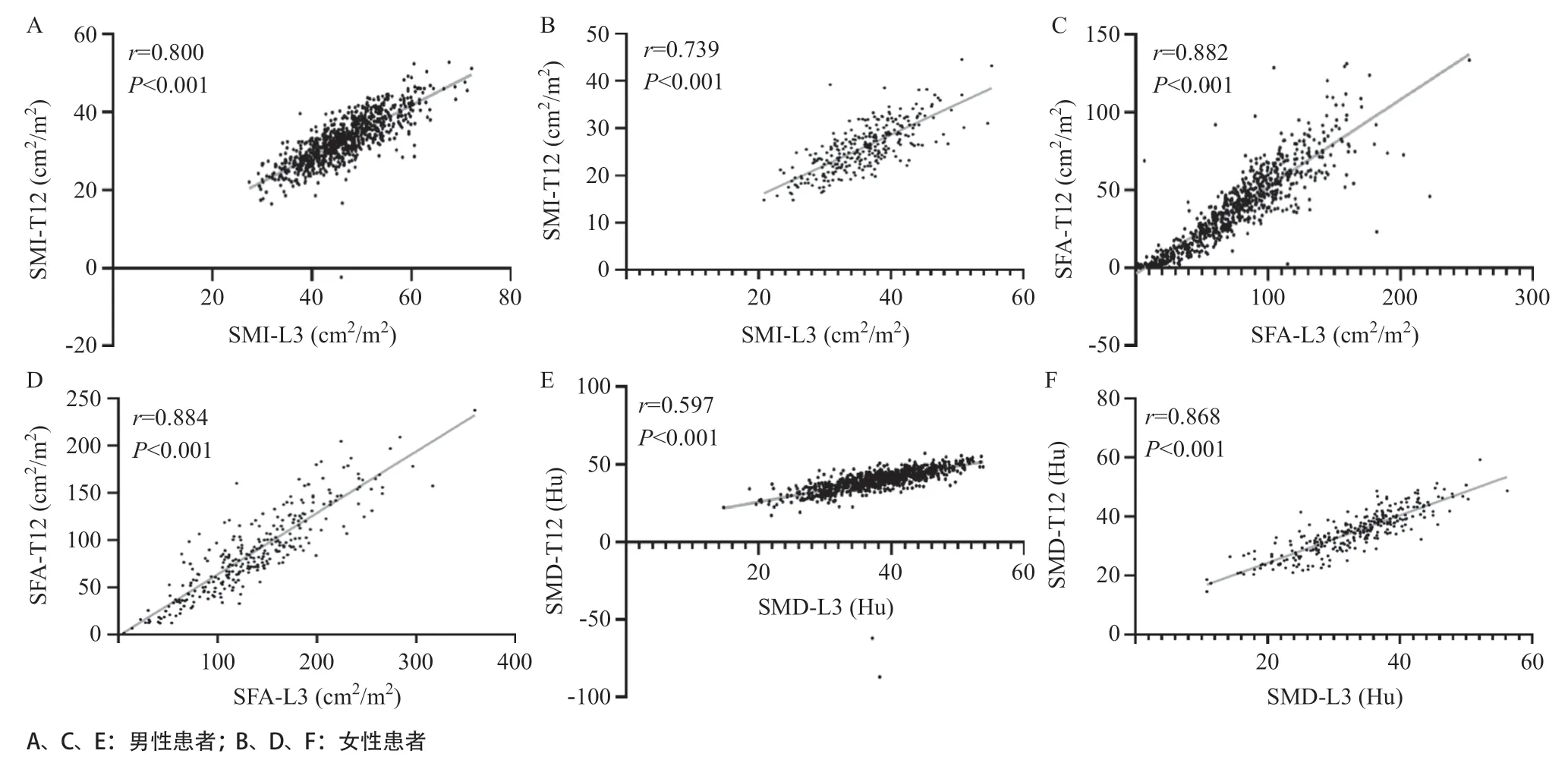
图2 不同性别胃癌患者SMI、SFA、SMD在T12与L3层面之间相关性分析的散点图
2.4 术后并发症和生存预后分析 以术后住院时间为结局变量进行多元线性回归分析,剔除性别、BMI等非显著因素,结果显示,相较于阴性人群,肌少症-T12(+)(P=0.002)和肌少症-L3(+)(P=0.020)均会导致患者术后住院时间延长。以术后是否发生吻合口瘘或者胃瘫为因变量的单因素Logistic回归分析结果表明,肌少症-T12(+)(P=0.530、0.878)及肌少症-L3(+)(P=0.713、0.916)与术后吻合口瘘或胃瘫发生均无显著相关性。
在3年随访期间,共有391例(35.7%)患者死亡。K-M生存分析结果显示,低SMI-T12(P<0.001)、低SMI-L3(P<0.015)、低步速(P<0.001)、低握力(P<0.001)、肌少症-T12(+)(P<0.001)、肌少症-L3(+)(P=0.002)患者术后生存率更低,见图3。对OS进行单因素和多因素COX回归分析,设置女性、TNM I、肌少症-T12(-)和肌少症-L3(-)为参照组,再对性别,年龄,TNM分期等混杂因素进行控制后,结果显示,肌少症-T12(+)(HR=1.502, 95%CI=1.159~1.948,P=0.002)和肌少症-L3(+)(HR=1.328,95%CI=1.008~1.750,P=0.044)均是影响术后长期生存的危险因素,见表2。
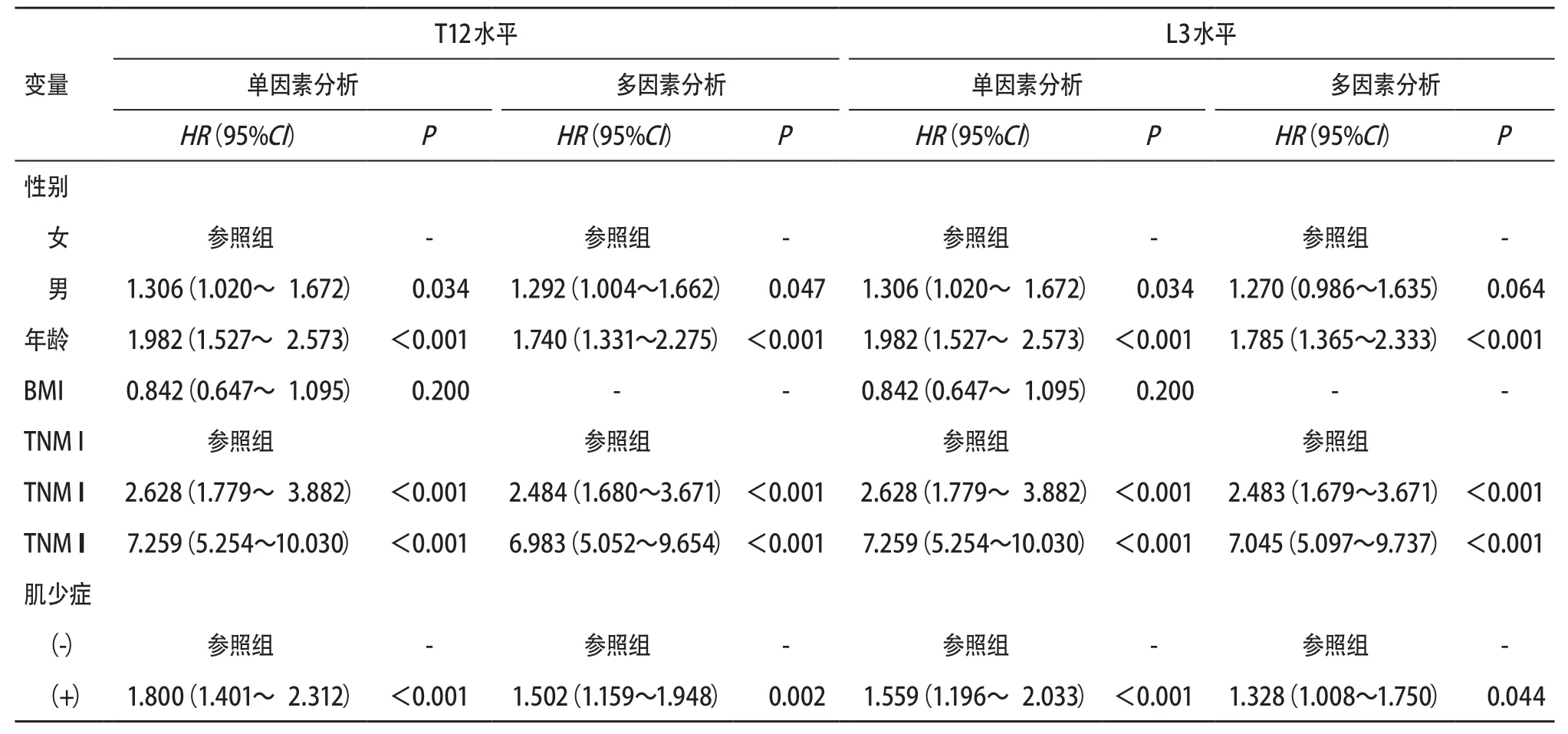
表2 T12水平和L3水平的单因素和多因素COX回归分析结果
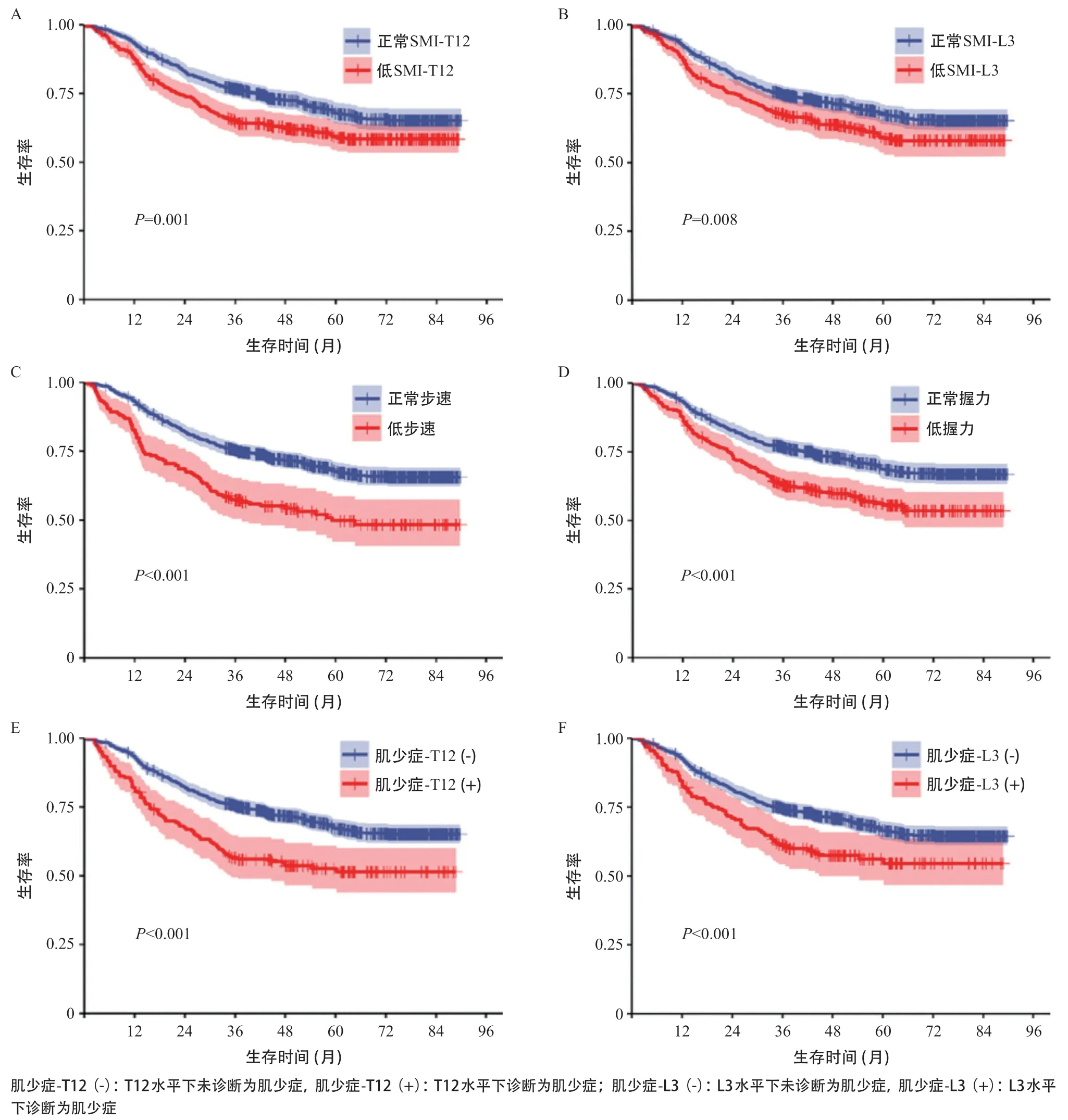
图3 不同水平SMI、步速、握力、肌少症分组下的生存曲线
3 讨论
本研究表明,在进展期胃癌患者中,T12和L3水平(SMI、SFA和SMD)之间的CT图像参数是相关的,提示SMI-T12的截断值可用于诊断单独接受胸部CT扫描的肌少症患者,并用于预测肌少症与生存预后之间的关系。SMI-T12≤40.8 cm2/m2的男性或≤34.9 cm2/m2的女性被定义为低SMI;握力<26 kg 的男性或握力<18 kg的女性被定义为低握力;步速<0.8 m/s的受试者无论男女均被定义为低步速。肌少症-T12(+)定义为低SMI的前提下合并低握力和(或)低步速。
多种影像学工具已应用于测量身体成分,CT由于其普遍性和易重复性,用于肿瘤和各种疾病的分期和随访,这便于前瞻性和回顾性分析肌少症[7],CT可通过不同阈值来区分肌肉和脂肪组织[8]。因此,CT是目前研究中最常用于诊断肌少症的影像工具[8],通过CT无需行其他昂贵或有创性检查即可诊断肌少症。在基于CT的肌少症评估中,L3由于其与身体成分密切相关,被认为是最常用的节段,由其诊断的肌少症已被研究证明与肿瘤患者或手术患者生存预后有关[9]。
由于胃癌患者术前需要接受胸腹部CT的检查,因此在本研究中同时评估多个水平的肌少症无需进一步的辐射暴露和辐射费用。TROSCHEL等[15]研究发现,在接受肺切除术的肺癌患者中,以第10胸椎为横断面诊断的肌少症与较短术后生存时间相关[15]。 相比较于T10而言,T12包含了腹部肌肉,是最接近于L3水平的胸部节段。本研究显示SMI-T12和SMIL3具有相关性(男性:r=0.800,P<0.001;女性:r=0.739,P<0.001)。
此前有研究提出低SMI-T12与经导管主动脉瓣置换术患者的住院时间延长有关,并且SMI-T12与SMI-L3之间存在相关性[13],这与本研究结果一致。然而,在他们的研究中,低SMI与预后无关,这与我们的结论相反,推测造成差异的原因是他们对肌少症的定义是单一低SMI,假阳性率较高。在另一项国内的前瞻性研究中,YANG等[16]证实SMI-T12、低握力和低PS与晚期非小细胞肺癌患者的预后相关,并且推荐将这三个因素结合起来,作为肌少症的诊断条件。这与我们的结论相似,即肌少症是生存预后的危险因素。然而,PS得分不在亚洲肌少症工作组(the Asian Working Group for Sarcopenia,AWGS)2019推荐的诊断因素中。同时,TAN等[17]对健康体检人群进行了研究,结果显示胸部CT测量的SMI和其他肌力指标具有诊断肌少症的价值,但研究对象多为中年人,不符合肌少症的流行病学特征。同样,在他们的研究中,缺乏与L3层面的横向比较。MATSUYAMA等[18]对口腔鳞状细胞癌的研究进一步证实了胸部CT诊断肌少症的可行性。既往研究探讨了SMI-T12在肺癌、口腔鳞状细胞癌、经导管主动脉瓣置换术等非腹部区域的疾病中作为肌少症诊断因素的临床价值。然而,胸部CT在腹部疾病中诊断肌少症的可行性方面缺乏相关研究。本研究补充了该方面,在胃癌群体中证实了SMI-T12用于肌少症诊断的可行性。肌少症与外科手术后并发症增加有关,一项大型meta分析结果显示,肌少症会增加总体并发症风险,但是未增加术后胃瘫和吻合口瘘的风险[19],在本研究中显示相同的结果。在患者诊疗过程及日常体检中,通常会行胸部CT检查,可考虑通过T12截面对某些群体,如老年群体进行骨骼肌质量筛查,并及时干预。
本研究也有一些局限性。首先,本研究是回顾性研究,只纳入了一家医院的患者,得出的截断值尚不足以代表胃癌患者群体,需要在多中心进行验证。本研究没有详尽收集胃癌患者术后化疗方案的相关资料,未充分考虑化疗对术后生存的影响,这可能导致分析过程存在偏倚。
综上所述,胸部CT下的SMI可用于肌少症诊断,其诊断的肌少症对于胃癌患者术后生存具有预测价值。
