甲基转移酶样因子3在结肠癌中高表达并促进结肠癌细胞恶性表型
2023-11-30项益岚胡渊博黄婷婷陈谢滔陈琛斌卢明东
项益岚,胡渊博,黄婷婷,陈谢滔,陈琛斌,卢明东
1.温州医科大学附属第一医院 放射科,浙江 温州 325015;2.温州医科大学附属第二医院育英儿童医院 胃肠外科,浙江 温州 325027;3.温州医科大学 微生物学与免疫学教研室 分子病毒与免疫研究所,浙江 温州 325035
结肠癌是全球第三大常见的恶性肿瘤,也是肿瘤相关死亡的第二大原因[1]。流行病学统计显示2020年我国结肠癌新发病例达56万[2]。手术切除是目前结肠癌治疗的最主要手段,随着治疗方式及技术不断改进,早期结肠癌患者的生存率有所提高。但大多数结肠癌患者在被确诊时已是中晚期并已发生局部转移,无论是术后化疗,或者免疫疗法的效果并不理想,其五年生存率不足15%[3-5]。因此,挖掘结肠癌发生发展的生物标志物,并进一步探索结肠癌恶性进展的分子机制,对于结肠癌防治具有重要意义。
N6-腺苷酸甲基化(N6 adenylate methylation,m6A)修饰作为最常见的RNA表观遗传学修饰之一,近年来被发现参与多种人类疾病的进展[6-7]。而甲基转移酶样因子3(methyltransferase-like 3,METTL3),作为最主要的m6A甲基转移酶,参与食管癌、胃癌、宫颈癌等多种肿瘤的进展[8-11]。一方面,METTL3通过调控m6A甲基化修饰参与肿瘤细胞的增殖、凋亡、迁移、侵袭以及耐药等生物学过程[12]。另一方面,METTL3还能以非m6A依赖途径结合真核细胞启动因子(eukaryotic initiation factor 4A, eIF4A)调控mRNA翻译效率,促进肿瘤的恶性进展[13]。然而,关于METTL3在结肠癌的表达情况及其对结肠癌细胞恶性表型的调控作用鲜有报道。本研究通过公共数据库和温州医科大学附属第一医院结肠癌临床样本检测METTL3在结肠癌中的表达水平,并在细胞水平评估METTL3对结肠癌细胞生物学表型的影响,旨在为临床结肠癌的防控提供新的指导。
1 材料和方法
1.1 材料
1.1.1 细胞及组织标本:人结肠癌细胞DLD-1 和HCT-116均购自中国科学院细胞库,分别使用含10%胎牛血清(fetal bovine serum, FBS)的DMEM培养基和RPMI-1640培养基培养,并置于37 ℃、含5% CO2的细胞培养箱中。
1.1.2 试剂:胎牛血清、DEME培养基、RPMI-1640培养基均购自美国Gibco公司。METTL3兔多克隆抗体购自美国Proteintech公司,GAPDH兔多克隆抗体购自杭州贤至生物有限公司。Western blot相关试剂盒购自上海碧云天生物技术有限公司,ECL化学发光试剂盒购自美国Thermo Fisher Scientific公司。CCK-8试剂购自上海翌圣生物科技股份有限公司;Transwell小室购自广州洁特生物有限公司;基质胶购自美国BD生物科技有限公司。靶向METTL3的小干扰RNA由广州锐博生物技术有限公司设计合成,序列为:si-NC:5’-GGCTCTAGAAAAGCCTATGC-3’;si-METTL3-001:5’-CAAGTATGTTCACTATGAA-3’;si-METTL3-002:5’-GCAAGTATGTTCACTATGA-3’。
1.2 方法
1.2.1 标本收集:收集2014—2018年在温州医科大学附属第一医院接受结肠腺癌根治术的癌组织和癌旁正常组织(距离癌灶至少5 cm范围的组织)。纳入标准:患者年龄>18周岁,接受结肠腺癌根治性手术治疗,术后病理学检查确诊为结肠癌,同意参加此项研究者;排除标准:患者接受新辅助化疗,拒绝接受根治性手术治疗,或合并其他恶性肿瘤或严重的器质性疾病。最终,共纳入481例结肠腺癌组织和59例癌旁组织。本研究经温州医科大学附属第一医院伦理委员会批准(2021R092)。
1.2.2 生物信息学分析:使用cBioPortal数据库(https://www.cbioportal.org/)分析METTL3在泛癌中的突变情况、三维结构、单核苷酸多态性(single nucleotide polymorphism, SNPs)以及拷贝数变异(copy number variation, CNVs)情况。下载TGCA数据库中结肠腺癌的mRNA表达数据和临床病理特征。使用GEOquery包从GEO数据库下载GSE17536、GSE17537、GSE29621、GSE39582中结肠癌患者基因芯片表达数据及相应患者对应的临床病理特征和预后信息。分析METTL3基因在结肠癌组织和癌旁正常组织中的表达差异,及其与患者总生存率(overall survival, OS)和无病生存期(diseasefree survival, DFS)的关系。
1.2.3 免疫组化:所有手术切除的结肠腺癌组织石蜡包埋,切片,脱蜡,水化,抗原修复,封闭,使用METTL3抗体室温孵育2 h后滴加DAKO免疫组化专用二抗,37 ℃孵育1 h。经DAB显色和苏木素复染,盐酸乙醇分化,浸入磷酸盐缓冲液中反蓝,脱水,封片。显微镜下观察并拍摄目的蛋白表达情况,使用Image-Pro Plus图像软件进行阳性细胞半定量分析。
1.2.4 Western blot实验:细胞转染siRNA后48 h,使用RIPA细胞裂解液裂解细胞,提取细胞蛋白。通过SDS-PAGE凝胶电泳,将蛋白转印至PVDF膜上,用5%脱脂牛奶封闭40 min,再用相应的一抗4 ℃孵育过夜,二抗室温孵育1 h,最后使用显影液于曝光机下显色。
1.2.5 CCK-8 细胞增殖实验:将结肠癌细胞系以 4 000个/孔的密度接种于96孔板中,12 h后进行转染处理。待转染1、2、3 d后,加入CCK-8试剂孵育 3 h,并使用酶标仪检测450 nm波长处的吸光度。在减去空白组数值调零后,比较各组增殖情况。
1.2.6 Transwell细胞迁移及侵袭实验:将细胞按一定密度接种于六孔板内,待细胞贴壁后转染处理,转染24 h后将细胞消化后用无血清培养基重悬,按1×105/孔加入到Transwell上室,下室加入含10% FBS的完全培养基;其中,侵袭实验需要在实验开始前将基质胶稀释后铺于Transwell上室内。在细胞培养箱中孵育24~48 h后取出,4%多聚甲醛固定,结晶紫染色,洗净后拭去上室内残余未穿过的细胞,于显微镜下观察并拍摄成功穿过的细胞并计数。
1.3 统计学处理方法 使用Graphpad Prism 8.0和R4.0.2进行数据分析。计量资料以表示,两组比较采用独立样本t检验,多组比较采用单因素方差分析。计数资料以例和百分数表示,2组间比较采用χ2检验,2组间等级资料的比较采用秩和检验。使用pROC包绘制受试者工作特征(receiver operating characteristic, ROC)曲线以评估METTL3基因的表达对于区分结肠腺癌和癌旁组织的诊断准确性。使用survminer包确定结肠腺癌组织中METTL3表达的最佳截断值,进而将患者分成高表达组和低表达组;采用Kaplan-Meier生存曲线分析2组患者之间的生存差异,采用Log-rank检验评估2组患者生存时间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 M E T T L 3 在结肠癌组织中的表达特征 cBioPortal数据库分析结果提示,METTL3在肿瘤组织中存在一定的SNPs或CNVs变异,整体在6%以内(见图1A、图1B)。TCGA数据库33种不同肿瘤的表达谱分析结果显示,METTL3在绝大多数癌组织中表达显著上调(见图1C)。在TCGA数据库结肠癌组织中,METTL3表达显著上调(P<0.001,见图2A),且其表达显著高于配对的癌旁正常组织(P<0.001,见图2B);同时,其表达状态能有效区分结肠癌和正常组织(AUC=0.921,见图2C)。为了进一步验证这一现象,我们通过免疫组化法检测了396例结肠癌组织和48例癌旁正常组织(剔除染色后脱片面积>50%的组织)中METTL3的表达情况(见图2D)。与上述结果一致,METTL3在结肠癌组织中表达上调(P<0.001,见图2E;P=0.040,见图2F)。
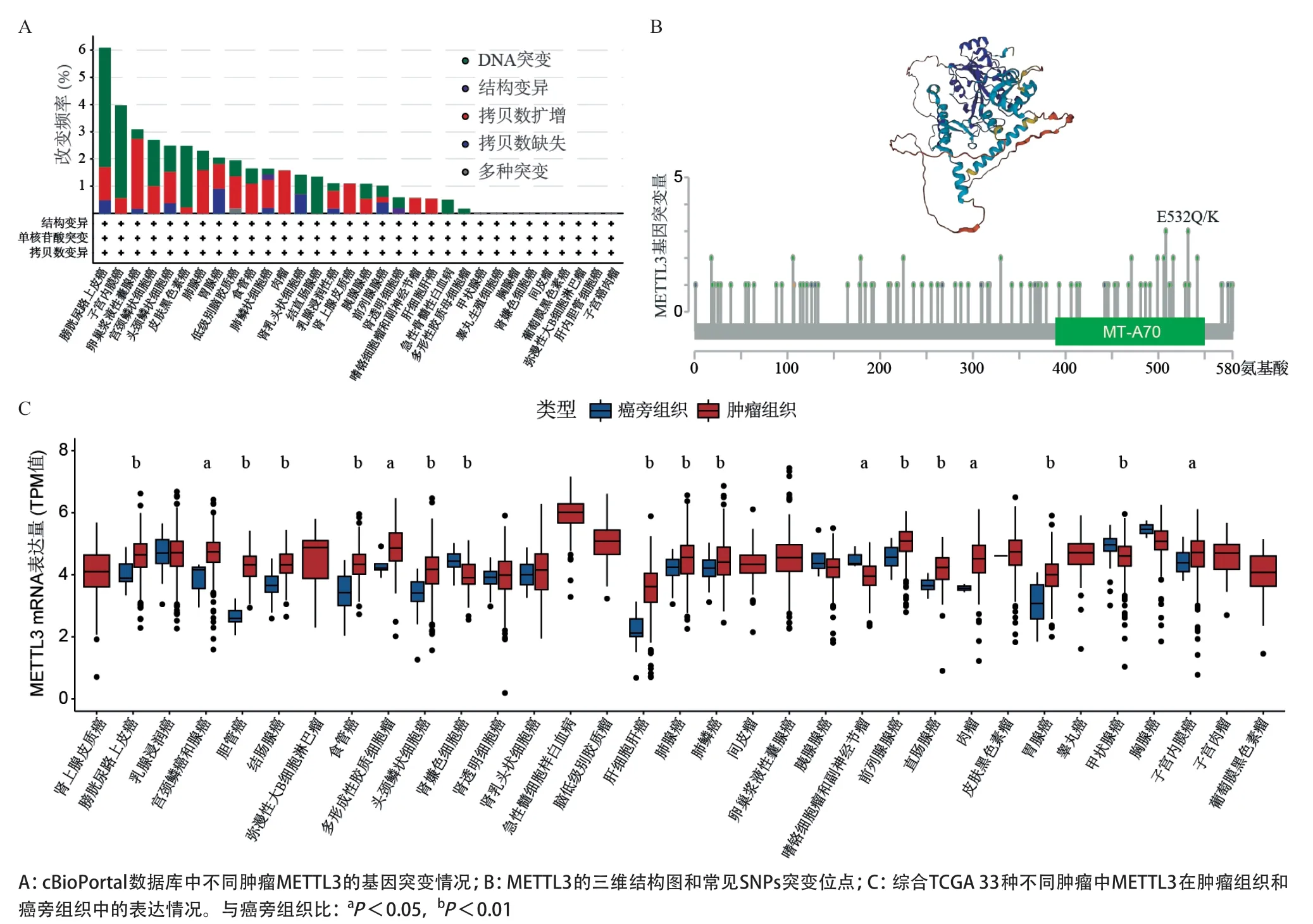
图1 METTL3基因在不同肿瘤中的表达特征

图2 METTL3在结肠癌组织中mRNA和蛋白表达显著升高
2.2 METTL3 高表达提示结肠癌患者的不良临床结局 我们进一步综合分析了TCGA-COAD数据库和GEO数据库(GSE17563、GSE17537、GSE29621、GSE39582)中共计1 278例结肠癌患者的表达谱数据及其临床信息,其中表达数据经去除批次效应后合并。基于METTL3的表达水平将结肠癌患者分为高表达组和低表达组;2组患者的生存状态差异有统计学意义(P=0.019),而性别和TNM分期差异无统计学意义(P>0.05),见表1。Kaplan-Meier生存分析进一步显示了METTL3高表达提示结肠癌患者较差的OS(Log-rankP=0.028)和DFS(Log-rankP= 0.035),见图3。同时,单因素和多因素Cox回归分析结果显示,结肠癌TNM分期的II期(HR=1.913,P=0.022),III期(HR=2.903,P<0.001),IV期(HR= 11.206,P<0.001),以及METTL3的高表达(HR= 1.335,P=0.030)是患者不良临床结局的独立危险因素(见表2)。
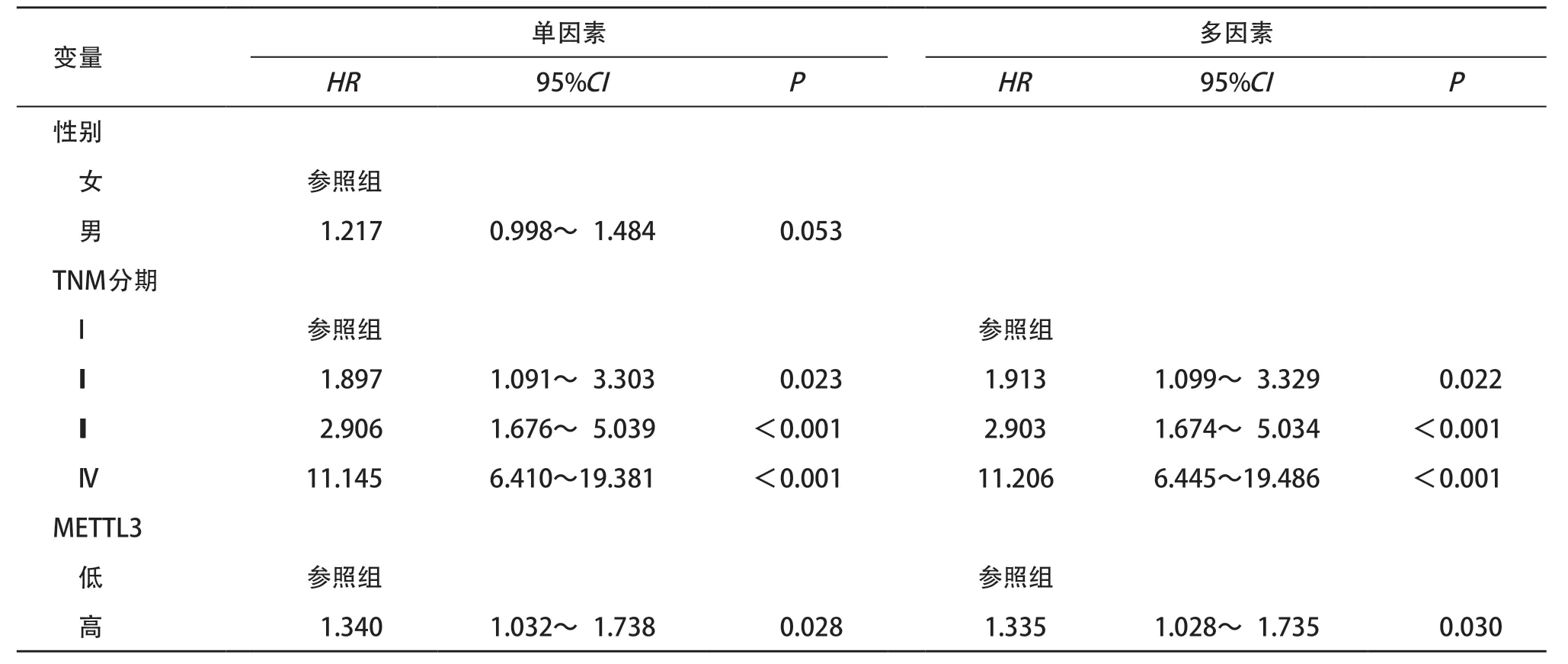
表2 公共数据库1 278例结肠癌患者生存预后的单因素和多因素Cox回归分析
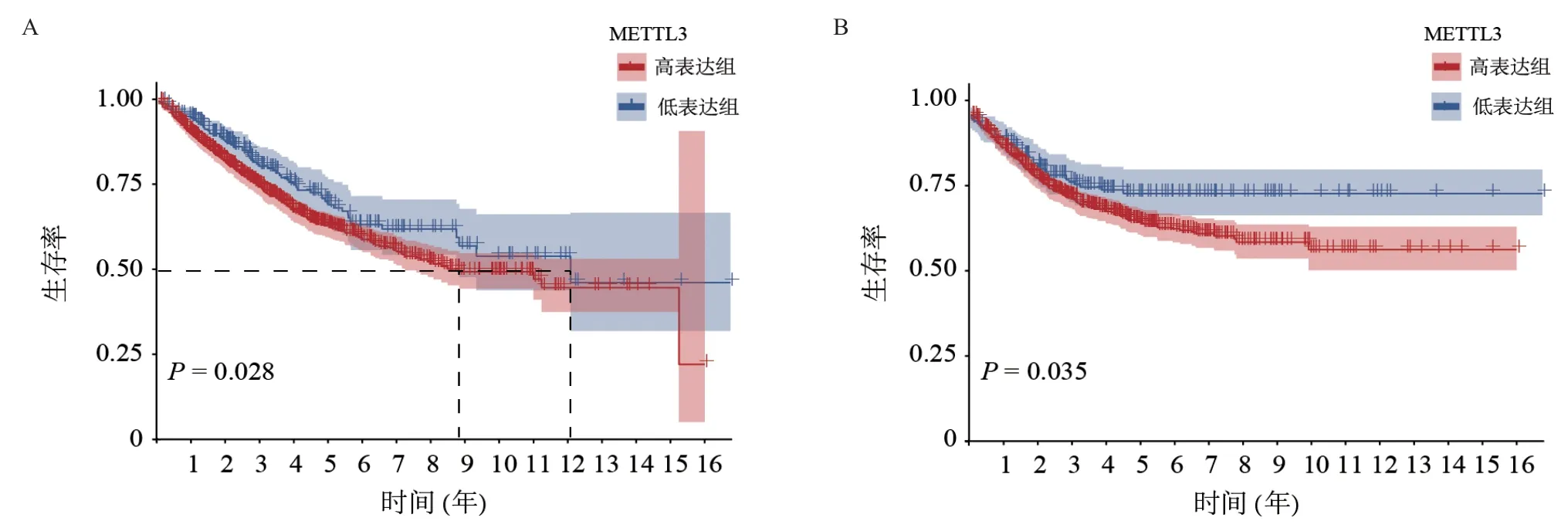
图3 Kaplan-Meier曲线展示TCGA数据库合并GEO数据库中结肠癌患者总生存期(A)和无病生存期(B)与METTL3表达的相关性
2.5 敲低METTL3表达显著抑制结肠癌细胞增殖能力 Western blot结果显示,si-METTL3-1 和si-METTL3-2可显著敲低结肠癌细胞内METTL3的表达水平。CCK-8细胞增殖实验结果显示,METTL3敲低后的HCT-116细胞增殖能力显著低于si-NC组(P<0.001)。同样的,此现象在DLD-1 细胞中也得到验证(P<0.001)。见图4。以上结果证实了METTL3的表达水平对于结肠癌细胞增殖能力具有重要作用,METTL3能促进结肠癌细胞的增殖能力。

图4 CCK8实验评估下调METTL3的表达对结肠癌细胞增殖能力的影响
2.6 敲低METTL3表达显著抑制结肠癌细胞迁移与侵袭能力 Transwell细胞迁移和侵袭实验结果表明,在METTL3敲低后,HCT-116和DLD-1细胞迁移与侵袭能力显著低于si-NC组(P<0.05),见图5。
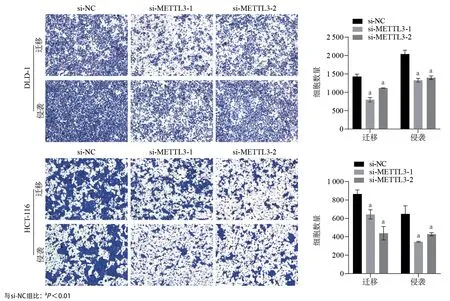
图5 Transwell实验评估敲低METTL3对结肠癌细胞DLD-1和HCT-116迁移和侵袭能力的影响
3 讨论
结肠癌是全球癌症相关死亡的主要原因之一,目前尚缺少有效预测结肠癌患者生存的分子标志物及治疗靶点。因此,亟需寻找影响结肠癌恶性进展及患者预后的关键调控基因,对于结肠癌的防治具有重要意义。m6A修饰普遍存在于真核生物mRNA中,其最早于40年前首次报道,但其在人类疾病,尤其是恶性肿瘤中的生物学功能直到最近才成为研究的焦点[14-15]。METTL3作为m6A修饰主要的甲基转移酶,介导了诸多m6A修饰的生物学功能。本研究旨在明确METTL3在结肠癌中的表达情况及临床意义,并初步探索METTL3对结肠癌发生发展中的生物学功能。
通过大样本量公共数据库生物信息学分析和本中心临床组织免疫组织化学法验证,本研究证实了METTL3在结肠癌组织中表达显著上调。与本研究结果相似,LI等[16]通过qRT-PCR和Western blot技术检测发现结肠癌组织标本中METTL3的mRNA和蛋白水平要高于癌旁正常组织。此外,本研究分析发现METTL3高表达与结肠癌患者较差的OS和DFS密切相关;单因素和多因素Cox回归分析进一步证实METTL3可以作为预测结肠癌患者预后的独立危险因素。这些结果提示了METTL3可能在结肠癌的发生发展在发挥了重要作用。然而,METTL3对结肠癌细胞生物学功能的影响尚不清楚。
本研究中我们通过siRNA靶向敲低结肠癌细胞中METTL3的表达水平,发现结肠癌细胞系DLD-1和HCT-116的增殖能力得到显著抑制。上述结果与HAN等[17]研究结果相似,其研究发现METTL3以m6A依赖的途径调控pri-miR21/222成熟,并促进细胞增殖。WANG等[12]也同样证实了过表达METTL3能够促进胃癌细胞增殖,而敲低METTL3表达能够抑制胃癌细胞增殖。
此外,Transwell实验结果证实了敲低METTL3的表达能够显著抑制结肠癌细胞的迁移和侵袭实验。YUE等[18]发现METTL3通过调节胃癌细胞上皮-间质转换并促进胃癌转移。同时,HE等[19]研究结果进一步发现敲低METTL3的表达后能显著抑制甲状腺乳头状癌细胞的转移能力。以上结果充分证实了METTL3作为重要的致癌基因,参与了结肠癌的恶性进展及恶性细胞表型,但具体机制有待进一步的研究。
本研究的局限在于,缺乏动物水平实验证METTL3对结肠癌细胞生物学表型的影响,同时没有进一步挖掘METTL3促进结肠癌细胞增殖和转移等恶性表型的深层分子机制。此外,本研究还需进一步收集结肠癌临床组织样本对应的临床信息,并从本中心水平探究METTL3表达与结肠癌患者临床病理特征和预后的相关性。
总而言之,本研究通过大样本量结肠癌公共数据库及临床组织标本证实METTL3在结肠癌组织中表达上调,并可以作为独立危险因素预测结肠癌患者的不良预后。此外,细胞功能学实验进一步证实METTL3能够促进结肠癌细胞的增殖、迁移和侵袭能力。本研究初步揭示了METTL3在结肠癌发生发展中的作用,为结肠癌的治疗和靶点挖掘提供一定的理论支持。
