Polo样激酶4抑制剂Centrinone通过调控PI3K/AKT通路影响胃癌细胞增殖和凋亡
2023-11-30张良杨嘉麒张特明黄颖鹏游涛倪仲琳
张良,杨嘉麒,张特明,黄颖鹏,游涛,倪仲琳
温州医科大学附属第二医院育英儿童医院 普外科,浙江 温州 325027
胃癌是高发病率和高死亡率的恶性肿瘤疾病,严重危害人类健康。靶向治疗可以显著延长患者生存期,是晚期胃癌患者不可缺少的治疗手段。但是,目前胃癌缺少有效的治疗靶点,只有靶向HER2药物成功应用于胃癌的一线治疗[1]。其他如表皮生长因子(epidermal growth factor receptor, EGFR)、 间质表皮转化因子(mesenchymal-epithelial transition factor, MET)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等治疗靶点在胃癌的应用正处于临床试验或大部分没有达到预期结果[2]。寻找更高效的治疗靶点是提高胃癌患者生存的关键[3]。Polo样激酶(polo-like kinase, PLK)家族是一类丝苏氨酸蛋白激酶,被认为与细胞周期调节有关。其中,PLK4结构特殊,被发现与细胞中心粒复制有关,在众多肿瘤中呈现高表达,且与预后有一定相关性[4]。 已经发现PLK4的高表达可以促进结肠癌细胞增殖和迁移等恶性表型[5-6],另外,PLK4靶向治疗已经被美国食品药品监督管理局批准应用于难治性或复发的急性骨髓性白血病。但是,PLK4在胃癌方面的研究甚少。有研究基于TCGA胃癌数据库中mRNA的差异表达计算干细胞指数,提出PLK4与胃癌的细胞干性相关,高的细胞干性指数预后更好[7-9]。通过免疫组化检测PLK4蛋白质表达同样提示胃癌中PLK4相对高表达,但高表达的预后更差[10]。这些报道仅仅停留在相关性分析上,缺乏PLK4抑制剂对胃癌细胞功能学上的深入研究。PLK4到底可否作为胃癌的治疗靶点及其对胃癌细胞功能的影响和机制尚不明确,因此,本研究旨在探讨PLK4抑制剂Centrinone(LCR-263)在体外对胃癌细胞的生长、迁移及凋亡的影响,评估其作为胃癌靶向治疗药物的潜在价值。
1 材料和方法
1.1 主要试剂 PLK4 抑制剂Centrinone购于美国MedChemexpress生物科技公司,半胱天冬酶-3 (Caspase-3)、半胱天冬酶-3 裂解体(Cleaved-Caspase-3)、聚腺苷二磷酸-核糖聚合酶(poly ADPribose polymerase, PARP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)等抗体购于美国Proteintech Group生物技术公司,PI3K及其磷酸化抗体购于美国Abcam公司,AKT及其磷酸化抗体购于澳大利亚Affinity Biosciences公司,AnnexinV-FITC/PI细胞凋亡双染试剂盒购于美国BD公司,细胞培养基、胎牛血清等购于美国Gibico公司,所用细胞培养皿等耗材购于美国Corning生物科技有限公司。
1.2 细胞培养 胃癌细胞株AGS、BGC、SGC购于中国科学院上海细胞库。培养条件为10%胎牛血清的1640培养基,在37 ℃、5% CO2浓度的培养箱中培 养。
1.3 细胞生长实验 待细胞长满至80%~90%时,弃掉培养基,用PBS清洗2 遍后,用胰酶消化胃癌细胞,消化后铺板,96孔板,每孔5 000个细胞,分别加入PLK4抑制剂Centrinone(0、0.1、1、2、5、10、20、50 μmol/L),药物溶解在无血清的1640培养基孵育24 h,根据CCK8试剂盒说明书加入试剂,孵育3 h后,在450 nm波长处检测吸光度,并计算细胞相对生长情况。
1.4 Transwell细胞迁移实验 待细胞长满至80%~90%时,弃掉培养基,用PBS清洗2遍后,用胰酶消化胃癌细胞,细胞计数后按照每小室20万个细胞接种,小室上加入100 μL含Centrinone(0、1、2、5 μmol/L)的无血清培养基,小室下加入20% FBS的1640培养基600 μL,Transwell系统放入37 ℃细胞培养箱培养6 h和12 h后取出,计数方法如下,将Transwell小室取出,用PBS轻柔清洗,将小室放在室温4%多聚甲醛内固定30 min,之后再取出使用PBS洗两遍,用棉花签刮去小室内的细胞,动作轻柔,避免小室的膜变形影响观察。使用0.1%的结晶紫染料进行染色,结晶紫覆盖下层细胞,染色20 min。再用PBS清洗,室温晾干以后在显微镜下观察并拍照,每个小室取5个视野进行拍摄,利用ImageJ软件进行细胞计数,最后做统计分析。
1.5 流式细胞术检测 细胞消化后铺到6 孔板内,每孔20 万细胞量,细胞在培养箱内继续培养过夜,待细胞贴壁后更换无血清培养基,并分别加入Centrinone(0、1、2、5 μmol/L),孵育24 h后收集细胞样本,包括上清和贴壁的全部细胞,根据AnnexinV-FITC/PI试剂盒说明书进行样本处理后通过流式细胞计数仪检测。重复3次实验,将结果汇总进行统计分析。
1.6 Western blot法检测 细胞总蛋白使用RIPA裂解液提取,并使用BCA方法进行浓度定量。使用SDS-PAGE法进行蛋白电泳,先80 V电泳30 min,再转120 V电泳1 h,转膜使用PVDF膜,条件为恒流200 mA,90 min。然后使用5%脱脂牛奶的TBST进行封闭2 h,之后进行洗膜,然后进行一抗在4 ℃冰箱孵育过夜。次日经过TBST洗膜之后,进行二抗孵育,室温2 h。然后再次洗膜之后,使用ECL发光液进行蛋白显影。对蛋白条带使用ImageJ进行半定量分析。
1.7 生物信息学分析 PLK4 基因在TCGA数据库中的表达量分析使用GEPIA工具(http://gepia. cancer-pku.cn/),通过GEPIA工具分析PLK4的mRNA在胃癌及癌旁组织中的差异表达。基因芯片的分析参考KMPLOT工具(http://kmplot.com/analysis),通过KMPLOT工具分析PLK4在胃癌组织中的蛋白表达量与患者生存预后的相关性。PLK4 蛋白质在组织中的表达参考人类蛋白质组学数据库(https://www.proteinatlas.org),观察PLK4蛋白在胃癌组织中的分布及定位情况。选取的组化编号为PLK4数据集ID1042,抗体编号HPA043198。
1.8 统计学处理方法 采用SPSS19.0进行统计分析,计量资料以表示,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 PLK4在胃癌高表达且与预后存在相关性 在TCGA数据库中对胃癌STAD数据集进行分析,PLK4在胃癌组织中的RNA表达量显著高于癌旁正常组织(P<0.05),结合GEO的数据库分析发现PLK4的表达量与胃癌患者的生存预后存在显著相关性(P=0.001),高表达量提示预后不良,见图1A、图1B。免疫组化结果表明,PLK4 蛋白主要定位于胃癌细胞质以及细胞膜,少量细胞在细胞核内也有染色,见图1C。根据Human Protein Atlas数据库的结果显示,HPA043198检测的组织标本有10对,其中有3个胃癌样本没有检测出PLK4表达,而其余7对为低中度表达,没有胃癌组织检测出强阳性。
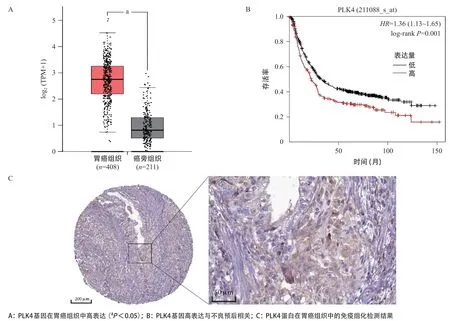
图1 PLK4在胃癌中的表达及预后分析
2.2 Centrinone对胃癌细胞具有显著的生长抑制效应 通过CCK8实验发现,Centrinone对胃癌AGS、SGC和BGC均具有较强的生长抑制作用,当药物浓度达到4 μmol/L浓度时,三种细胞相对存活率都已经在50%以下。其中,AGS对药物的敏感性最高,IC50为1.386 μmol/L,见图2。
2.3 PLK4抑制剂Centrinone抑制胃癌细胞的迁移 Transwell实验结果显示,同样的条件下,药物处理组AGS细胞穿过小室膜的细胞数量显著少于未用药物组,且随着药物浓度的增加(1、2、5 μmol/L),AGS细胞迁移数量逐渐减少,差异有统计学意义(P<0.05),见图3。
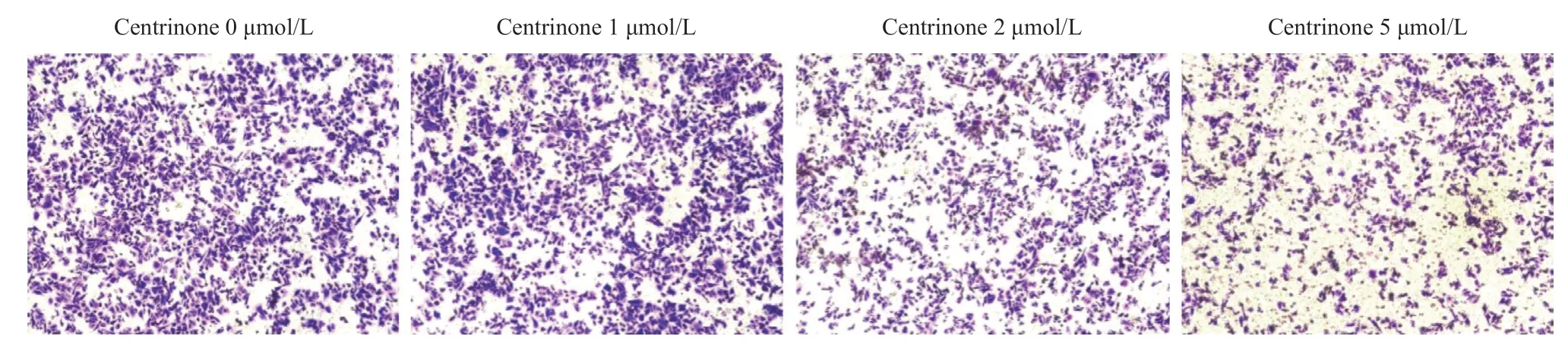
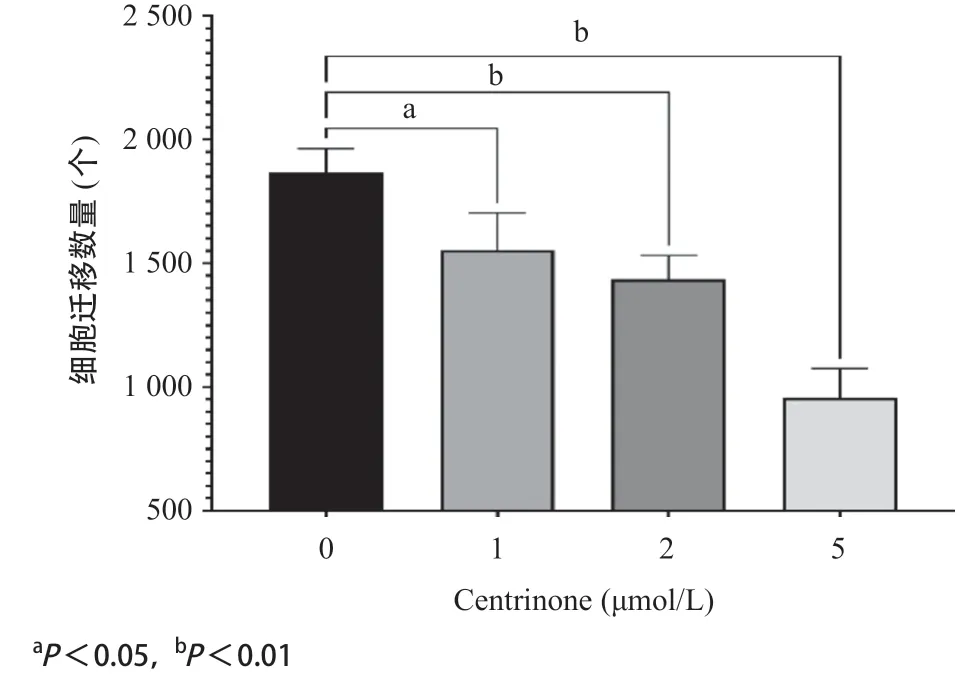
图3 PLK抑制剂Centrinone对胃癌细胞的迁移抑制实验结果
2.4 PLK4 抑制剂Centrinone促进胃癌细胞凋亡 流式细胞术实验结果表明,随着药物浓度的增加(1、2、5 μmol/L),细胞凋亡的比例逐渐增多,差异有统计学意义(P<0.01),见图4。
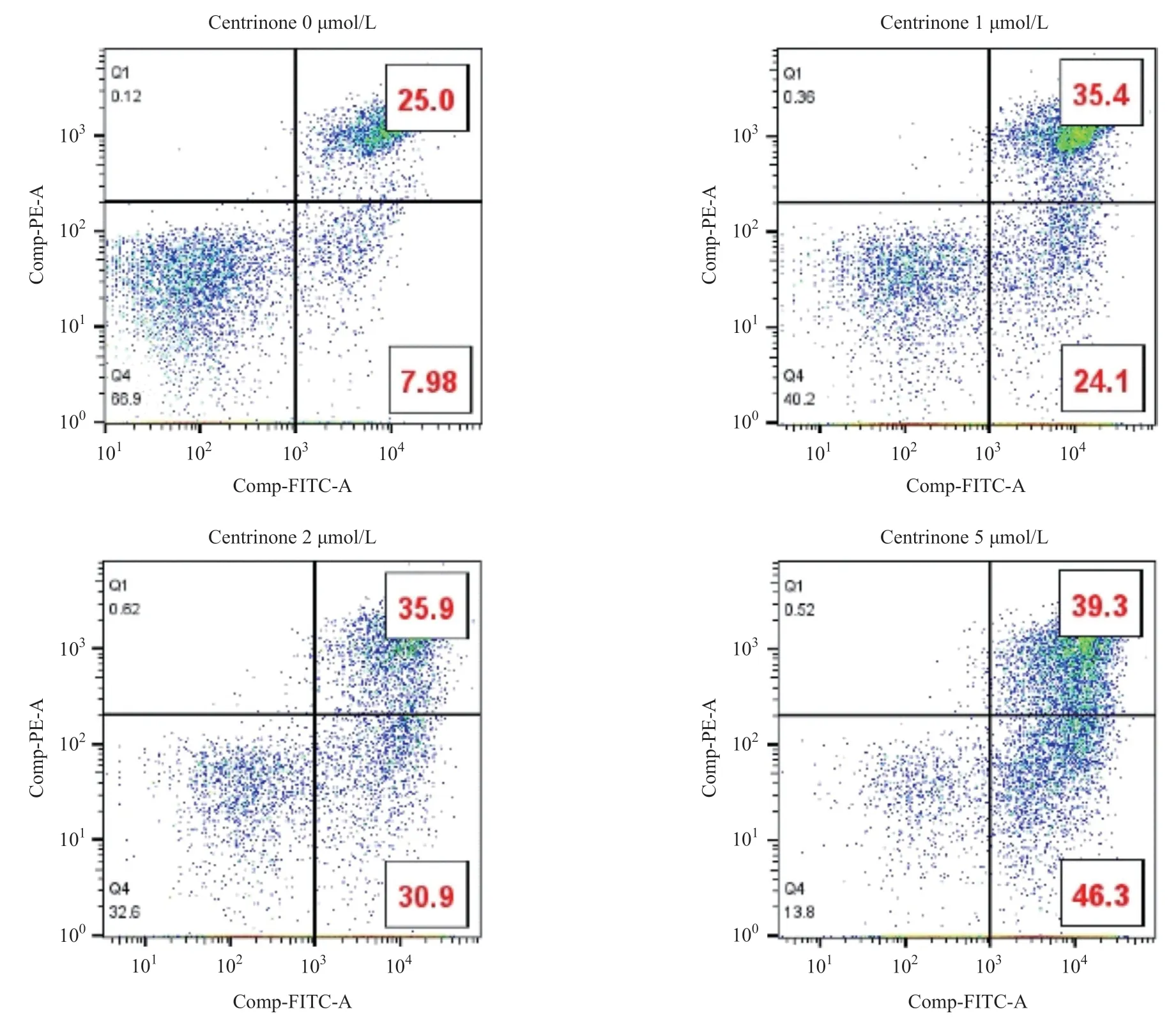
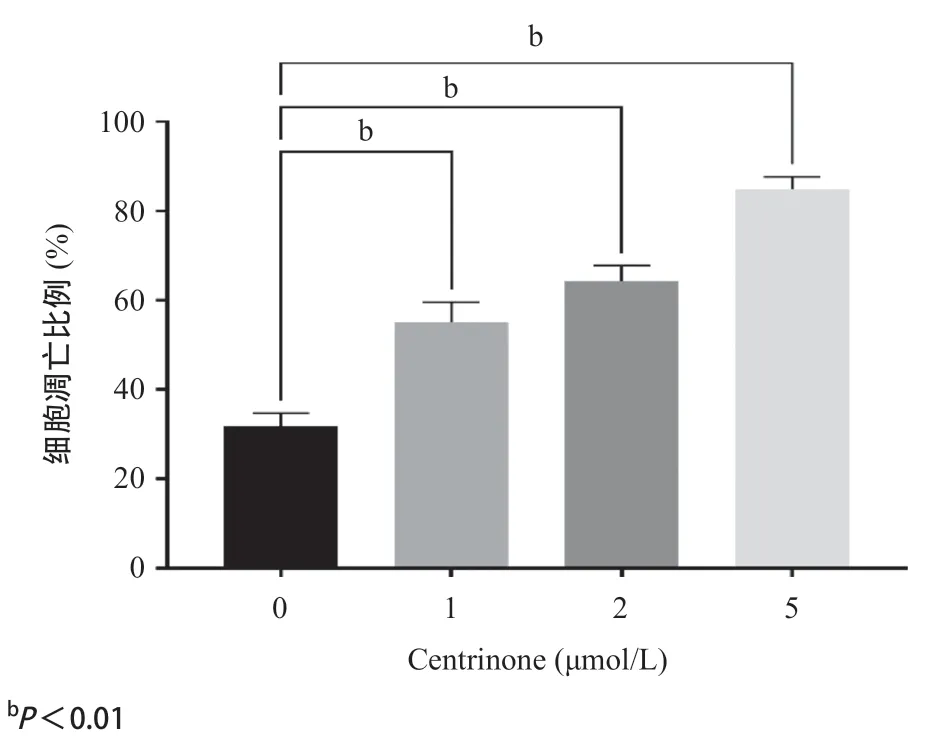
图4 PLK抑制剂Centrinone对胃癌细胞的流式细胞术实验结果
2.5 凋亡相关蛋白PARP、Caspase-3及其裂解体的变化 Western blot检测结果表明,当药物浓度为1、2、5 μmol/L时,与无药物相比,随着药物浓度的增加,AGS细胞的PARP裂解体蛋白表达量逐渐显著增加,差异有统计学意义(P<0.01)。当药物浓度为1 μmol/L时,Caspase-3裂解体的蛋白表达量未增加(P>0.05),而当药物浓度达到2 μmol/L、 5 μmol/L时,Caspase-3裂解体的蛋白表达量显著升高,差异有统计学意义(P<0.01)。见图5。
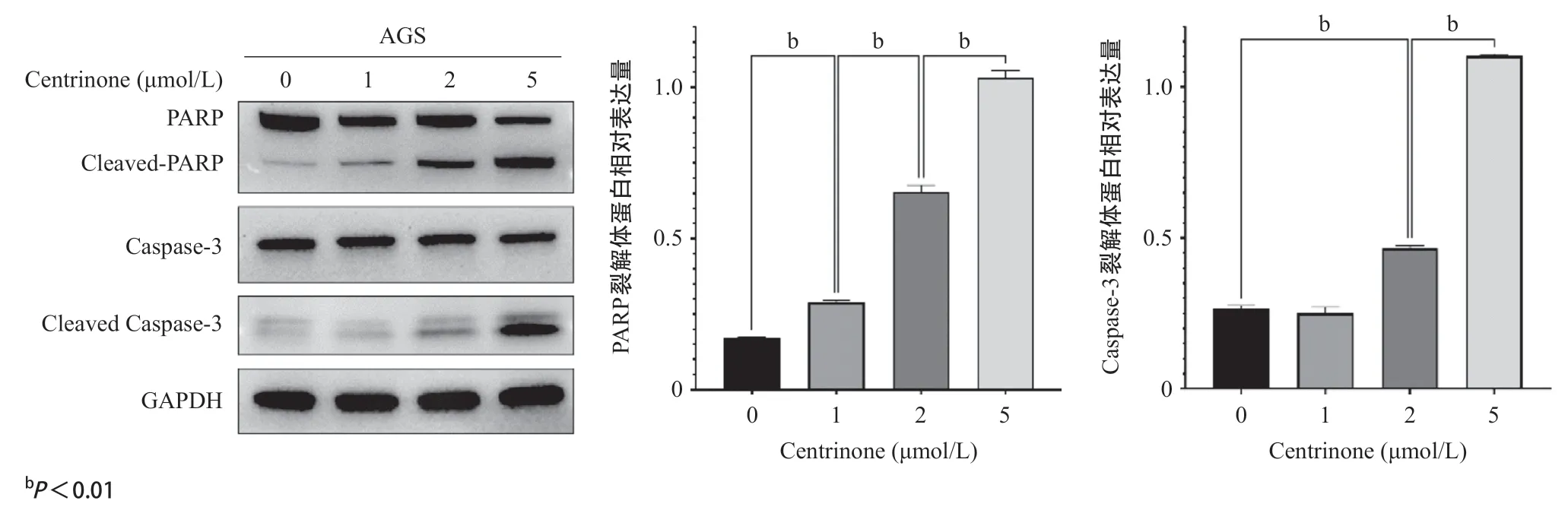
图5 PLK抑制剂Centrinone对胃癌细胞凋亡相关蛋白PARP、Caspase-3及其裂解体的影响
2.6 Centrinone不影响BAX蛋白表达但抑制BCL2蛋白表达 当药物浓度为1、2、5 μmol/L时,与无药物相比,随着药物浓度的增加,AGS细胞的BCL2蛋白表达量逐渐显著减少,差异有统计学意义(P<0.01),但BAX蛋白没有显著变化,差异无统计学意义(P>0.05),见图6。
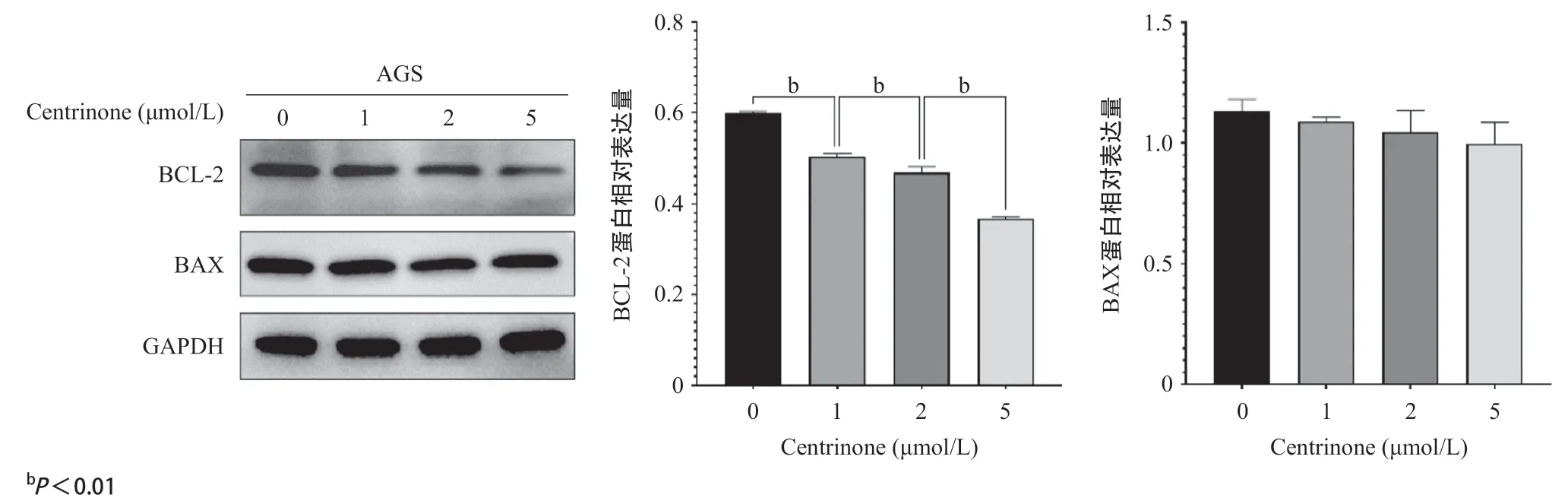
图6 PLK抑制剂Centrinone对胃癌细胞BCL2及BAX蛋白的影响
2.7 Centrinone通过抑制PI3K/AKT通路调控胃癌细胞凋亡 当药物浓度为1、2、5 μmol/L时,与无药物相比,随着药物浓度的增加,AGS细胞内PI3K的磷酸化以及AKT的磷酸化被抑制得越明显,差异有统计学意义(P<0.01),见图7。Centrinone可能是通过抑制PI3K/AKT信号通路调控胃癌细胞凋亡。
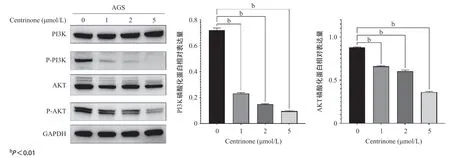
图7 PLK抑制剂Centrinone对胃癌细胞PI3K/AKT信号通路的影响
3 讨论
靶向治疗为晚期胃癌患者的生存改善提供可能,但缺乏有效的治疗靶点是胃癌靶向治疗失败的主要原因之一[3,11-12]。PLK蛋白激酶家族与细胞的分裂活动有关,在肿瘤组织中异常高表达,这也使其成为癌症靶向治疗的潜在靶点[13]。PLK4的靶向抑制剂表现出较强的抗肿瘤活性[14-15]。PLK4的抑制可以出现细胞周期的阻断以及细胞凋亡[16],出现特征性的PARP裂解以及Caspase 3蛋白裂解[17]。本研究通过TCGA数据库分析及不同浓度的PLK4抑制剂处理不同胃癌细胞系阐述Centrinone在胃癌的潜在治疗价值。通过CCK8实验说明Centrinone显著抑制胃癌细胞增殖,Transwell实验说明药物抑制胃癌细胞迁移,流式凋亡细胞检测结果说明药物对胃癌的促凋亡作用。细胞凋亡是细胞精密调控的程序性死亡,包括了外源性和内源性的凋亡通路[18]。许多抗癌药物通过诱导肿瘤细胞凋亡发挥抗癌效应。本研究发现PLK4抑制剂Centrinone也是通过抑制胃癌细胞生长,显著诱导胃癌细胞凋亡发挥抗肿瘤活性。
本研究还通过Western blot方法检测PLK4抑制剂Centrinone通过调控BCL-2以及PI3K/AKT信号通路蛋白发挥抗肿瘤作用。BCL-2蛋白家族是凋亡调控的重要成员,其中BCL-2蛋白具有抗凋亡的活性,而BAX蛋白具有促凋亡的活性,两者共同调控线粒体应激及相关下游通路的激活[19]。BCL-2蛋白的降解被认为是PLK抑制剂(靶向PLK1/2/3)诱导凋亡的机制之一[20],但关于PLK4的靶向抑制剂对BCL-2蛋白的影响尚未见报道。本研究发现Centrinone作用后,BCL-2蛋白的表达量显著下降,但是BAX蛋白表达不显著,说明Centrinone可能通过抑制BCL-2的表达诱导胃癌细胞凋亡。
PI3K/AKT信号通路是重要的致癌通路,广泛参与了细胞的迁移、增殖和耐药性[21]。PI3K/AKT信号通路的激活增加了肿瘤的恶性表型[22],而抑制则减弱肿瘤细胞增殖,引发肿瘤细胞凋亡。胃癌的发生是一个多因素多步骤的过程,包括环境因素、生活方式以及遗传因素等,这其中PI3K/AKT信号通路可以调节胃癌的增殖与存活,是非常重要的信号通路之一[23]。有一篇文献报道从1 693个小分子化合物中筛选出能促进人类多能干细胞衍生的心肌细胞成熟的药物,发现有多种PLK抑制剂能够抑制AKT信号通路的激活[24]。也有研究发现PLK4抑制剂能抑制PI3K/AKT信号通路引发多发性骨髓瘤细胞及前列腺癌细胞凋亡[25-26],发挥抗肿瘤作用。但是,PLK4在胃癌中的效应及调控机制未见报道。本研究结果提示PLK4抑制剂可能也是通过调控PI3K/AKT信号通路来抑制胃癌细胞增殖和诱导胃癌细胞凋亡。然而PI3K/AKT信号通路的下游分子是非常广泛的,包括了鼠双微体2(murine double minute 2, MDM2),叉头框蛋白O1(forkhead box O1, FoxO1),叉头框蛋白O3a(forkhead box O3a, FoxO3a),核因子κB(nuclear factor kappa-B, NF-κB),糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β),以及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)[23]。下游蛋白的确认有助于更深入了解PLK4抑制剂在治疗胃癌过中发挥的作用,还需要更多研究去确认。
综上所述,PLK4激酶抑制剂Centrinone可以显著抑制胃癌细胞增殖、迁移,并诱导凋亡,可能通过抑制BCL-2表达及对PI3K/AKT信号通路调控发挥作用。
