毛竹不同类型愈伤组织比较分析
2023-11-29黄碧芸卓仁英乔桂荣
黄碧芸,卓仁英,乔桂荣*
(1.中国林业科学研究院亚热带林业研究所,浙江 杭州 311400;2.南京林业大学林草学院,江苏 南京 210037)
毛竹(Phyllostachysedulis)生长快、分布广、成材早、产量高,在建材、食品、观赏、环保等方面广泛的应用价值使其具有不可替代的生态、经济地位[1]。第9次全国森林资源调查结果显示,我国现有毛竹林467.8万hm2,占我国竹林总面积的72.69%。随着2013年毛竹基因组测序的完成[2],毛竹快速生长、茎秆发育等特性相关基因的研究备受关注[3-4]。但由于缺乏完善的组织培养及遗传转化体系,毛竹基因功能主要通过在水稻(Oryzasativa)、拟南芥(Arabidopsisthaliala)等模式植物中进行异源转化验证。目前,竹子组织培养研究多集中于丛生竹种,如麻竹(Dendrocalamuslatiflorus)、版纳甜龙竹(Dendrocalamushamiltonii)等[6-7]。有关竹子遗传转化研究报道甚少,Qiao等[8]和Ye等[9]在麻竹中建立了遗传转化体系。经过多年努力,中国林业科学研究院亚热带林业研究所成功建立了以毛竹未成熟胚为外植体的离体再生及遗传转化体系,并实现了基因编辑技术在毛竹上的应用[10],为毛竹分子生物学研究及育种提供了技术支持。
在植物组织培养过程中,愈伤组织表现为多种不同的状态,通过观察愈伤的颜色、质地、形状大小可将其进行分类。组织培养过程中挑选适宜状态的愈伤组织,有利于愈伤组织增殖及提高植株再生率。有学者对山杏(Armeniacasibirica)[11]、荻(Miscanthussacchariflorus)[12]、墨西哥玉米草(Zeamexicana)[13]、芍药(Paeonialactiflora)[14]等植物组织培养过程中产生的不同类型愈伤组织进行了研究,结果显示不同类型愈伤组织在细胞组成、增殖能力、分化能力上存在较大差异。本研究通过石蜡切片、流式细胞仪、实时荧光定量PCR(qRT-PCR)对3种不同类型的毛竹愈伤组织进行差异分析,经过组织细胞学观察对各类愈伤组织结构差异、细胞类型进行比较;利用流式细胞仪分析细胞周期时相分布比例,比较不同类型愈伤组织细胞群体的增殖活性,以期选出适合于毛竹离体再生的愈伤组织材料,并对毛竹不同类型愈伤组织中胚性维持及生长调节相关基因的表达量进行分析,筛选可用于后续提高再生效率的候选基因。
1 材料与方法
1.1 供试材料
毛竹种子于2020年7—8月采自广西壮族自治区天然开花毛竹林(110°46′12″E,25°12′36″N),种子采后于4 ℃条件下保存。人工挑选状态一致、籽粒饱满的毛竹未成熟种子,去除种子外壳;将外壳霉变污染严重和成熟的褐色种子剔除,避免造成污染及影响后续愈伤诱导率,保留黄绿色鲜嫩种子用于诱导愈伤组织。
1.2 实验方法
1.2.1 毛竹愈伤组织诱导、增殖及分化培养
将种子置于自来水下冲洗2 h,转移至超净台内用75%(体积分数)乙醇溶液浸泡1 min后以2.5%(质量分数)的 NaClO(含有0.1%Tween-20)浸泡灭菌15~20 min,无菌水冲洗3~5次,于无菌滤纸上将未成熟胚分离,胚根向下接种于诱导愈伤培养基(MS+30 g/L蔗糖 + 8 g/L琼脂+4 mg/L 2,4-D, pH 5.8)。诱导2周左右毛竹未成熟胚盾片部位膨大,开始愈伤化;培养后将盾片部位产生的愈伤组织与外植体分离,转移至含有0.5 mg/L 2,4-D的愈伤继代培养基(MS+30 g/L蔗糖+8 g/L琼脂+0.5 mg/L 2,4-D, pH5.8)继续培养,每隔30 d更换1次培养基。不定芽诱导培养基为MS+0.5 mg/L NAA+2.0 mg/L BA+3.0 mg/L ZT+30 g/L蔗糖+8 g/L琼脂, pH 5.8。愈伤组织诱导、继代培养条件为25 ℃黑暗培养,不定芽诱导为16 h光照/8 h黑暗培养。当继代培养至3个月时,根据毛竹愈伤组织颜色、质地、形态特征将其分为3种类型(白色半透明型、白色致密型和黄色致密型)。挑选各状态愈伤组织,部分材料在徕卡MF165体视显微镜下观察并拍照记录后进行流式细胞仪检测,其余材料分别用酒精醋酸福尔与林固定液(FAA)固定和液氮冷冻处理,作为石蜡切片和qRT-PCR试验材料。
1.2.2 愈伤组织石蜡切片
愈伤组织石蜡切片方法参考文献[15],选取各类型毛竹愈伤组织,将材料用酒精醋酸福尔马林固定液(FAA)固定液(甲醛、乙酸、甘油、乙醇、水的体积比为 2∶1∶2∶10∶5)浸没,抽真空15 min,重复2次,室温固定24 h后逐级脱水,再经过浸蜡包埋处理,用石蜡切片机(赛默飞 Thermo Fisher HM325)将材料切成10 μm厚的连续蜡片,在载玻片上展片后烤片烘干,脱蜡过程中用番红-固绿染色,中性树脂封片后在徕卡DM4000B显微镜下观察、拍照记录。
1.2.3 愈伤组织流式细胞分析
取少量毛竹愈伤组织置于干净的培养皿中,加入1.5 mL预冷的MgSO4细胞解离液[50 mmol /L KCl、10 mmol /L MgSO4·7H2O、5 mmol /L 羟乙基哌嗪乙硫磺酸(HEPES)、6.48 mmol/L DTT、0.25% Triton X-100],用锋利的单面刀片将愈伤组织快速切碎,冰上放置5 min,经40 μm的滤膜过滤解离液至1.5 mL EP管中,4 ℃、1 000 r/min离心5 min收集沉淀,用500 μL预冷解离液重悬沉淀,加入RNaseA (终质量浓度为 30 μg /mL)、碘化丙啶(PI)染料(终质量浓度为 100 μg/mL)于样品中,4 ℃避光染色15 min后上样于BD Accuri C6流式细胞仪,检测单个细胞核DNA含量。流式细胞仪检测过程选择低速上样,选用488 nm激发器、FL2滤光片(610/20)检测PI-DNA荧光信号。每类愈伤收集10 000个细胞,重复3次。利用Modfit LT软件对检测结果进行分析,统计细胞周期中各时期即DNA合成前期(G1期)、DNA合成期(S期)和DNA合成后期(G2期) 的百分比。
1.2.4 愈伤组织WUS、GRF基因表达分析
取液氮速冻后保存于-80 ℃ 冰箱的各状态毛竹愈伤组织,转移至去酶处理并液氮预冷的研钵中磨成粉末后用 Norgan Biotek 公司的 Total RNA Purification Kit 试剂盒,参照试剂盒说明书步骤提取3种类型毛竹愈伤组织总 RNA,每种类型愈伤取3个生物学重复。用分光光度仪检测RNA 浓度,1%(质量分数)琼脂糖凝胶电泳检测 RNA 提取质量。
提取的毛竹愈伤总 RNA,以0.5 μg总RNA为模板, 用PrimeScript RT Master Mix (cat. No. RR036A, TaKaRa) 反转录试剂盒合成 cDNA 第1链(具体反应体系参照试剂盒说明书),反转录得到cDNA,稀释 10 倍后可用作 qRT-PCR 反应模板。
以拟南芥WUS、GRF蛋白序列为参照序列比对毛竹二代基因组数据,得到对应家族成员基因ID,分别设计qRT-PCR引物如表1所示。以上述cDNA为模板,PeTIP41作为内参基因[16],用 TB GreenTMPremix ExTaqTM试剂盒(购自 TaKaRa 宝生物工程有限公司)和实时荧光定量 PCR 仪 Applied Biosystems 7300 进行 qRT-PCR 反应,检测胚性维持及生长调节相关的WUSCHEL(WUS)基因和growth-regulating factor(GRF)基因在不同类型毛竹愈伤组织的表达量。
反应体系如下:cDNA模板 2 μL,上、下游引物(10 μmol/L)各0.4 μL,2×TB GreenTMPremix ExTaqTM10 μL,ROX Reference Dye (50×) 0.4 μL,ddH2O 6.8 μL,总计20 μL。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火31 s,共40个循环。熔解曲线:95 ℃,15 s;60 ℃,60 s;95 ℃,15 s。结果采用 2-ΔΔCT的方法计算每个基因在不同类型愈伤组织中的相对表达量。

表1 qRT-PCR引物
1.3 数据处理
应用SPSS19.0进行数据分析,多组样本均值比较采用单因素方差分析,P< 0.05为差异有统计学意义。
2 结果与分析
2.1 毛竹愈伤组织类型及组织细胞学观察
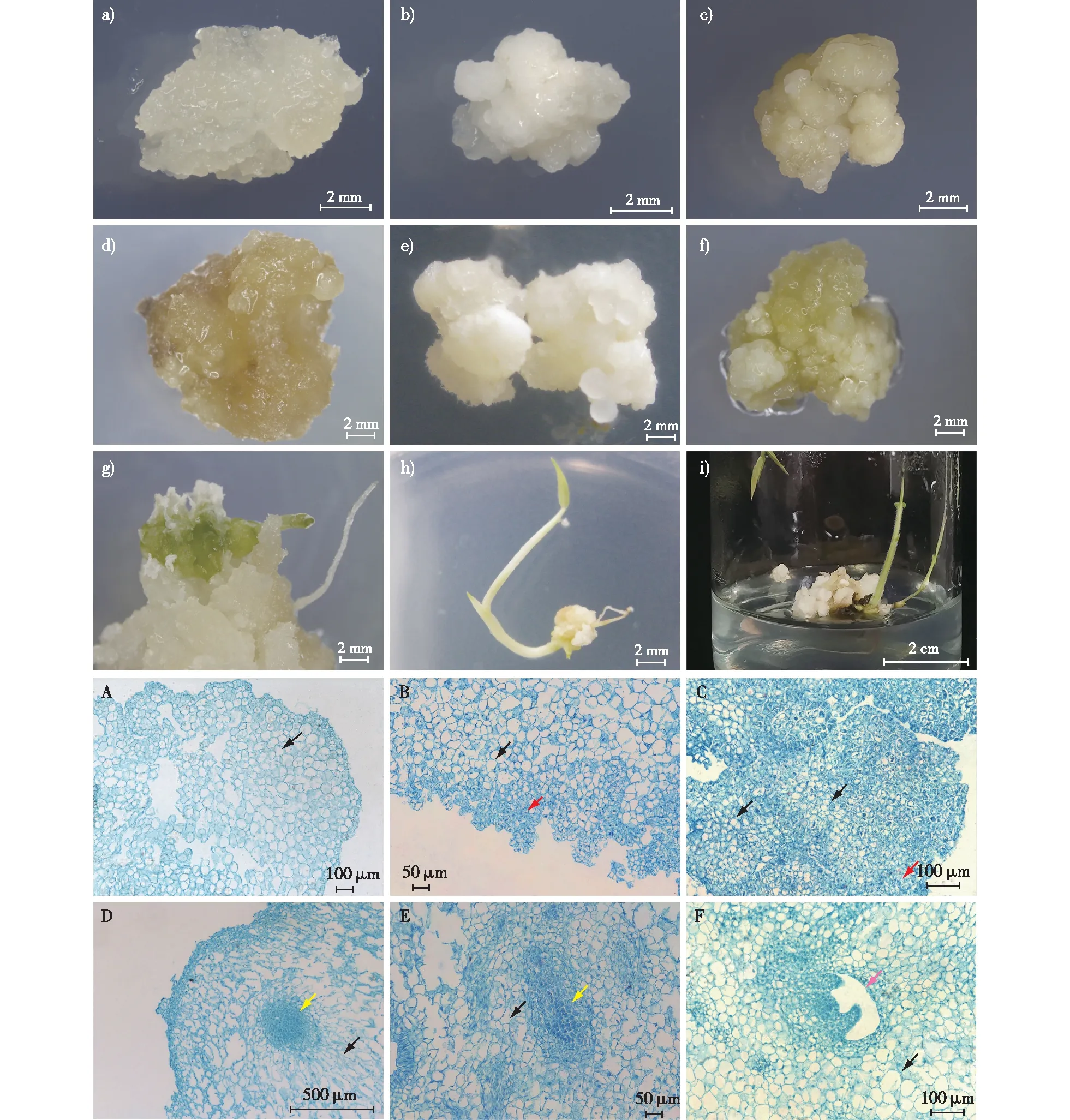
a、A. 第Ⅰ类愈伤组织the type Ⅰ callus; b、B. 第Ⅱ类愈伤组织the type Ⅱ callus; c、C.第Ⅲ类愈伤组织the type Ⅲ callus; d. 第Ⅰ类愈伤组织继代后褐化the type Ⅰ callus browning during subculture; e. 第Ⅱ类愈伤组织继代后增殖the type Ⅱ callus proliferated after subculture; f. 第Ⅲ类愈伤组织继代后表面产生白色颗粒愈伤the type Ⅲ callus produced white granular callus on the surface after subculture; g、h.愈伤组织继代过程中分化出芽和根shoot and root differentiation from callus during subculture; i. 组培瓶中第Ⅱ类愈伤分化再生植株的同时增殖产生新的愈伤in tissue culture flask, the type Ⅱ callus differentiated into plants and proliferated to produce new callus;D、E. 愈伤组织内部胚性细胞团embryonic cell clumps inside callus; F. 愈伤组织内部子叶胚cotyledon embryo inside callus。 黑色箭头→指向非胚性细胞black arrow represents the non-embryonic cells;红色箭头指向胚性细胞red arrow represents the embryonic cells; 黄色箭头指向分生组织细胞团yellow arrow represents the meristematic cell mass; 粉色箭头指向子叶胚 pink arrow represents the cotyledon embryo。图1 不同类型毛竹愈伤组织及组织细胞学观察Fig. 1 Different types of callus and their cytological observation of moso bamboo
继代过程中毛竹愈伤组织根据颜色、质地、形态特征可分为3种类型。第Ⅰ类愈伤组织整体呈白色半透明状,质地松散易碎、含水率高(图1a)。愈伤组织表面及内部细胞大小差异明显,表面由单层类表皮细胞组成,细胞体积小,排列规则。内部细胞呈椭圆形,排列松散,细胞体积大,细胞壁薄,未观察到细胞核及细胞内容物,整体空泡化(图1A)。随着继代时间增加,此类愈伤组织不断增大,继代多次后愈伤组织增殖能力逐渐降低,最终褐化死亡(图1d),不具有分化产生植株的能力。
第Ⅱ类愈伤组织外观呈乳白色,整体组织致密,表面有不规则突起(图1b)。组织细胞学观察发现,愈伤组织表层有3~5层胚性细胞紧密排列,突起部分是由胚性细胞分裂形成的多个分生组织细胞团。这类胚性细胞体积小,有大而明显的细胞核,液泡较少或无液泡,细胞内含物多,染色深。除了愈伤组织表层,愈伤组织内部也存在分生组织细胞团(图1D、1E),外部由大体积非胚性细胞包裹,两者分界明显(图1B)。分生组织细胞团内细胞不断分裂后产生极性,出现由圆形的小体积细胞组成的顶端以及体积较大的长方形细胞组成的基部,形成原胚。顶端细胞继续分裂分化后形成子叶胚,分裂分化旺盛的细胞集中于顶端,周围细胞逐渐解体消失,形成空腔(图1F)。继代时发现,此类愈伤组织增殖能力强,随着继代次数的增加未出现减弱的现象,愈伤组织增殖后本体不断变大,表面会产生球状愈伤组织颗粒(图1e),触碰易分离,掉落的小颗粒愈伤组织具有与此类愈伤组织相同性状。此类愈伤继代过程中能够自主分化成产生根和芽(图1g、1h),在组培瓶中生成再生植株的同时,愈伤能够保持增殖活力,产生新的愈伤块(图1i)。经分化诱导,其不定芽分化率可达34%左右。
第Ⅲ类愈伤组织表面呈淡黄色或乳黄色,质地紧实,愈伤组织表面呈圆球形突起,相互之间连接紧密(图1c)。愈伤组织表面有胚性细胞分布,但愈伤组织内部存在大量小体积的非胚性细胞,细胞排列十分紧密且细胞壁厚(图1C)。此类愈伤组织具有增殖能力,但增殖速度慢于第Ⅱ类愈伤组织,几乎不能分化产生再生植株。多次继代后黄色愈伤组织块变大但仍较致密紧实,愈伤组织表面产生白色小颗粒愈伤(图1f),该小颗粒愈伤组织可轻松与母体脱离,继代逐渐发展成第Ⅱ类愈伤组织。
2.2 不同类型愈伤流式细胞仪检测结果
不同细胞分裂周期的细胞核内DNA含量不同,PI染料能够结合DNA,流式细胞仪检测到的荧光强度直接反应细胞核内DNA含量[17],并通过Modfit LT软件分析计能够显示各细胞时期的细胞数量比(图2)。如图2b为毛竹第Ⅱ类愈伤组织流式分析结果图,从图中可以直观地看到各细胞时期的分布比例。图2b中第1个峰代表的是G1期,所占比例为80.74%;第2个峰代表的是G2期,所占比例为9.88%;两个峰之间的阴影部分代表的是S期,所占比例为9.37%。其他结果以相同方法处理,得出不同类型毛竹愈伤组织G1期、S期、G2期细胞百分比平均值分别如图2d所示。

不同小写字母表示差异显著(P<0.05)。下同。Different lowercase letters indicate significant differences (P<0.05)。The same below.图2 基于Modifit LT 分析的不同类型毛竹愈伤组织流式细胞仪检测结果Fig. 2 Flow cytometry test results of different types of callus moso bamboo based on the Modifit LT analysis plot
3类愈伤组织各时期细胞分布比例趋势基本一致,但第Ⅱ类愈伤组织G2期细胞比例显著高于其他两组愈伤组织,达到8.95%,S期细胞比例占也是高于其他两种类型,达到8.78%,与石蜡切片结果中第Ⅱ类愈伤组织内具有多个分生组织细胞团的结果相对应,推断出该类愈伤组织处于分裂期的细胞数量较多,具有较强的增殖能力;第Ⅰ类愈伤组织绝大多数细胞处于G1期,占细胞总数的92.59%,S期和G2期细胞所占比例显著小于第Ⅱ类和第Ⅱ类,与切片结果显示愈伤组织内细胞为不具有分裂能力的非胚性细胞相对应;第Ⅲ类愈伤组织S期和G2期细胞所占比例相近,分别为细胞总数的6.49%和6.39%。G2期时相比例显著小于第Ⅱ类愈伤,但S期时相比例与第Ⅱ类不存在显著差异,说明第Ⅲ类愈伤组织也具有一定增殖能力但稍弱于第Ⅱ类。
2.3 不同类型愈伤组织基因表达分析
通过qRT-PCR技术对PeWUS基因和PeGRF基因家族成员在3种不同类型毛竹愈伤组织中的表达量进行分析,检测到5个PeWUS基因在3种不同类型愈伤组织中显著差异表达,其中ID为PH02Gene44184.t1和PH02Gene15929.t1在第Ⅱ类和第Ⅲ类胚性较强的愈伤组织中的表达量均显著高于第Ⅰ类非胚性愈伤组织(图3a);14个PeGRF基因在3种不同类型愈伤组织中差异表达,其中ID为PH02Gene01484.t1、PH02Gene03343.t1和PH02Gene03768.t1的PeGRF在第Ⅱ类愈伤组织中的表达量均显著高于其他两种类型 (图3b)。
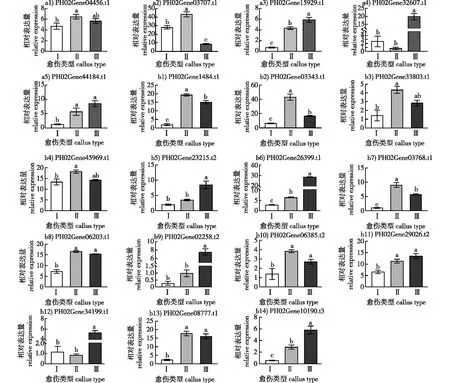
图3 不同类型毛竹愈伤组织WUS和GRF基因相对表达量Fig. 3 Relative expression of WUS and GRF genes in different types of callus moso bamboo
3 讨 论
通过对3种类型毛竹愈伤组织进行体视镜观察及石蜡切片观察发现,不同类型的愈伤组织除表观差异外,细胞学特征也存在明显差异,这与对高粱(Sorghumbicolor)[18]、苜蓿(Medicagosativa)[19]、香樟(Cinnamormumcamphora)[20]、麻栎(Quercusacutissima)[21]等植物愈伤组织的细胞学观察结果一致。研究显示,植物愈伤组织通常可分为胚性愈伤及非胚性愈伤两大类,且不同类型的愈伤组织表观存在差异,通常胚性愈伤组织质地紧密、扎实,表面具有突起,继代过程中能够产生新的愈伤组织,且易分化产生芽和根;而非胚性愈伤组织多表现为结构松软、组织含水量高,且易在培养过程中褐化死亡。
本研究结果显示,所观察的3种毛竹愈伤组织中,白色半透明型的毛竹愈伤组织含水量高、质地疏松、表面光滑,内部细胞排列松散,细胞体积大且内含物少,呈空泡状,属于非胚性愈伤;白色致密型和黄色致密型愈伤组织为胚性愈伤组织,内部结构紧密,表面具有小颗粒状突起。小体积、具有明显细胞核且细胞质浓的胚性细胞紧密排列形成胚性细胞团,分布于这两类愈伤组织的表面及内部。该结果与马来甜龙竹(Dendrocalamusasper)[22]、版纳甜龙竹[23]、慈竹(Neosinocalamusaffinis)[24]、香竹(Chimonocalamusdelicatus)[25]愈伤组织培养研究过程中胚性愈伤质地紧密、愈伤组织表面具有不规则突起的表型一致。但在慈竹和香竹愈伤组织培养过程中胚性愈伤组织呈现绿色和紫色,与本研究中白色或黄色胚性愈伤组织不同,可能是由于竹种间的不同及培养基中添加物质不同造成的。闵义等[26]认为组织培养继代时非胚性愈伤组织易占据生长优势,应对非胚性愈伤组织尽早进行筛选和剔除,有利于形成胚性愈伤。因此,对毛竹愈伤组织类型进行区分,并有目的地将白色和黄色致密型愈伤组织挑选培养有利于获得均质的胚性愈伤组织。
细胞周期是指细胞从一侧分裂完成开始到下一次分裂结束所经历的全过程,可分为间期和极短的分裂期,间期又包括DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。采用流式细胞仪通过检测与DNA相结合的PI染料快速分析细胞内DNA含量,从而得出所检测组织内各时相细胞所占比例[27]。因此,流式细胞仪常被用于检测组织培养再生植株的体细胞无性系倍性变异[28],以及愈伤组织增殖能力判别[29-30]。有关柑橘(Citruscalli)[30]愈伤组织再生能力研究中,通过检测不同基因型柑橘愈伤组织的S期时相比例大小,比较愈伤组织增殖能力。本研究利用流式细胞仪测定了3种毛竹愈伤组织的细胞周期时相分布比例,结果显示白色致密型愈伤组织S期和G2期时相比例均高于其他两种类型检测结果,且各类型愈伤G2期数据差异显著,表明白色致密型愈伤组织内细胞分裂能力最强,这与此类型愈伤在继代时能够快速、大量增殖的表现相符合。
WUS转录因子属于WOX基因家族,在胚胎发生及分生组织干细胞维持中起关键作用[31-33],研究表明WUS能够在拟南芥中使体细胞转变为胚性细胞,并维持细胞分裂能力,促使形成体胚[34]。肖艳青[35]发现,拟南芥表达GhWUS基因能够诱导根尖形成胚状体结构,并且体胚发生相关基因表达量上升。Hoerster等[36]在玉米中转化表达WUS2基因促使玉米(Zeamays)体细胞胚胎的形成和再生,提高了转化效率。匡华琴等[37]在马银花(Rhododendronovatum)愈伤组织继代至第5代快速增殖状态时检测到WUS基因表达量达到最高值。这些结果说明WUS基因参与植物细胞增殖及体胚形成过程。本研究中检测到5个PeWUS基因在3种不同类型愈伤组织中显著差异表达,其中ID为PH02Gene44184.t1和PH02Gene15929.t1的PeWUS在第Ⅱ类和第Ⅲ类胚性较强愈伤组织中的表达量均高于第Ⅰ类非胚性愈伤组织,推测这两个基因可能对于毛竹胚性细胞的维持起关键作用。
GRF基因是植物特有的,在植物生长发育过程中发挥生长调节作用[38-40]。大多数GRF可以促使细胞增殖,在幼嫩组织中比在成熟组织中更高表达。Wang等[4]在毛竹节间分生组织区检测到与细胞增殖相关的11个GRF基因表达水平均高于成熟区。王锦楠[41]将银腺杨(Populusalba×P.glandulosa)PagGRF12a和PagGRF12b基因过表达后发现,过表达植株的叶片面积变大、细胞数目增多、细胞体积变小,同时细胞增殖标志基因表达量显著增加。拟南芥AtGRF4、AtGRF1基因功能类似,同样参与细胞增殖[42];Kong等[43]发现AtGRF5及其同源基因能促进双子叶植物和单子叶植物的再生,包括油菜(Brassicanapus)、大豆(Glycinemax)、甜菜(Betavulgaris)、向日葵(Helianthusannuus)和玉米。由小麦(Triticumaestivum) 组成的融合蛋白能够显著提高小麦、黑小麦和水稻的再生效率和再生速度,且GRF4-GIF1在不存在外源性细胞分裂素的情况下诱导了小麦的高效再生,有助于选择无选择标记的转基因植物[44]。Feng等[45]利用西瓜(Citrulluslanatus)内源嵌合基因ClGRF4-GIF1将西瓜的遗传转化效率较以前提高了近9倍。本试验qRT-PCR检测结果显示,14个PeGRF基因在3种类型愈伤组织中表达差异显著,其中ID为PH02Gene01484.t1、PH02Gene03343.t1和PH02Gene03768.t1的基因在第Ⅱ类愈伤组织中的表达量均高于其他两种类型。该类型愈伤组织不仅细胞分裂旺盛、增殖能力最强,而且具有形成体胚的潜力,在继代过程中可自主分化产生根和芽,形成再生植株。在该类愈伤组织中高表达的3个PeGRF可作为候选基因以进一步提高毛竹再生效率,本实验室正在开展遗传转化相关验证试验。
本研究中3种不同类型毛竹愈伤组织的石蜡切片组织细胞学观察、流式细胞术分析细胞时相分布比例和植物生长相关基因表达量检测结果显示,表面白色、组织致密类型的毛竹愈伤具有更强的细胞增殖与再生能力,推测其更适合作为毛竹组织培养及遗传转化的材料。目前在竹子转化过程中仍存在愈伤组织恢复较慢、转化周期较长、再生和转化效率低等问题,将来可尝试利用WUS、GRF等基因来提高再生和转化效率。
