三叉神经痛琼脂压迫模型优化及相关解剖结构学研究*
2023-11-27石采灵杨汉丰
邓 浩 罗 星 石采灵 曾 晨 杨汉丰
(川北医学院附属医院放射科,南充 637000)
三叉神经痛 (trigeminal neuralgia, TN)是临床最常见的脑神经疾病,TN 的终生患病率为0.16%~0.3%,年发病率为4~29/10 万人[1]。2018 年,《国际头痛障碍分类》第3 版 (ICHD-3)[2]将其分为经典TN、继发性TN 和特发性TN。继发性TN 的病因包括脱髓鞘疾病(即多发性硬化症)、桥小脑角占位、外伤、卒中等[3]。约15%的桥小脑角占位病人出现TN 症状,肿瘤压迫三叉神经会引起局部神经脱髓鞘,导致神经的电位活动异常而形成异常的神经冲动[4]。
为了进一步研究TN 的发病机制及治疗手段,已建立多种符合TN 发病机制的动物模型,但仅有少数模型比较符合TN 发病机制[5]。Ahn 等[6]首先报道了利用琼脂对三叉神经节进行压迫的模型,证实三叉神经节受压后大鼠会出现机械性痛觉异常和痛觉过敏;Wu 等[7]对该模型进行完善,证实琼脂压迫建立TN 大鼠模型相对稳定,可用于TN 的病理生理学研究。该模型能较好地模拟桥小脑角处良性肿瘤对三叉神经的压迫症状,符合继发性TN 的发病机制。然而该实验的过程仍存在部分瑕疵,首先,采用的实验动物未进行术前筛选来控制大鼠的个体差异;其次,在注射琼脂后,未采取合适方法对琼脂压迫的情况进行评估。
本研究通过术前疼痛阈值测定,筛选出一批痛阈值较为稳定的大鼠;在造模术后进行大鼠头颅磁共振扫描,对琼脂的位置及压迫程度进行评估,对琼脂压迫模型的实验过程进行完善。在术后对大鼠头颅进行基于体素形态学分析(voxel based management, VBM),评价该模型的灰质体积变化。通过对模型的疼痛阈值变化、头颅VBM 变化、眶下段神经(infraorbital nerve, ION)及三叉神经颅内段(intracranial segment, ICS)神经超微结构变化的研究,评价该模型的可靠性。
方 法
1.实验对象
本研究所用实验动物为雄性SD 大鼠,由川北医学院动物实验中心提供,其使用规程已通过川北医学院动物实验中心审查,获得川北医学院科技部批准(NSMC 伦理动物审[2022] 043 号),并根据国际疼痛学会《关于在有意识的动物中调查实验性疼痛的伦理指南》进行实验。实验纳入32 只雄性SD 大鼠,体重范围在240~280 g,常规饲料喂养,自由饮水,温度为22℃~25℃,12 h 交替照明。主要仪器及试剂见表1。

表1 主要仪器及试剂Table 1 Main instruments and reagents
2.研究方法
(1)实验动物筛选:选择清洁级雄性SD 大鼠,术前7 天,通过vonFrey 测痛纤维丝(1.4 g、2.0 g、4.0 g、6.0 g、8.0 g、10.0 g、15.0 g)刺激大鼠双侧颜面部触须垫,使纤维丝弯曲(持续刺激5 s,前后2 次不同刺激间隔30 s);从有反应细丝开始,使用Dixon[8]所描述的up-and-down 法,测定大鼠痛阈。阳性结果判断标准:①大鼠迅速抓咬刺激物;②大鼠迅速摇头并搔抓刺激区域;③大鼠迅速后退靠近笼壁,躲避刺激物,或将头面部藏于身体下,避免进一步刺激;当出现上述1 项或1 项以上反应时,即认为刺激实验阳性。选择痛阈结果稳定在8~15 g 的大鼠共32 只。实验开始前1 周,用棉棒适应性刺激大鼠ION 支配的颜面部触须垫,双侧交替进行,每日连续刺激5 次,每2 次刺激间隔时间不小于30 s。
(2)模型建立与分组:32 只SD 大鼠采用随机数字表法均分为琼脂实验组16 只和0.9%氯化钠注射液对照组16 只。实验组大鼠在称量体重后,1%戊巴比妥钠 (0.4 ml/100 g)通过腹腔注射麻醉,麻醉显效后,将大鼠头部固定于动物脑立体定位仪上,微量注射器固定于引导杆上。于大鼠头皮中线切开皮肤剥离骨膜暴露前囟点,将微量注射器针头定位于前囟点,针头3D 定位于左侧三叉神经根处(前囟后7.5 mm、中线左3.2 mm),定位后利用骨钻去除骨质,有落空感后停止去骨,针头刺入9 mm,随后注入5 µl 5%琼脂溶液,注射器固定5 min 后缓慢取出,缝合切口(见图1)。对照组手术同前,3D 定位后经微量注射器给予5 µl 0.9%氯化钠注射液。手术过程中遵循无菌操作观念,术前与术后无需使用抗生素[9]。

图1 立体定位仪下建立三叉神经根琼脂压迫模型Fig.1 Establishment of an agar compression model of the trigeminal nerve root using a stereotaxic apparatus
(3)模型验证:术后3 天对实验组大鼠进行头颅MR 扫描,评估琼脂的位置、大小,排除未看到琼脂及琼脂未对三叉神经造成明显压迫的大鼠,并重新造模补充数据。
(4)痛阈测定:两组大鼠中各随机选取12 只分别于术前7 天、5 天、3 天、1 天及术后1 天、3 天、5 天、7 天、10 天、14 天、21 天、28 天、35 天、42 天、49 天采用up-and-down 法行机械刺激反应阈值测试。记录大鼠出现阳性反应时的疼痛阈值。
(5)灰质体积VBM 分析:将两组大鼠于造模术后4 周、8 周、12 周时,利用联影3.0T 磁共振对大鼠进行头颅MRI 扫描,扫描参数:TR/TE 为1300/227 ms,FOV 60 mm×60 mm,矩阵384×384,翻转角110°,层厚0.55 mm,层数44,采集时间18.5 min。
将大鼠头部数据导入到PC 机,数据处理和分析使用下列软件包:矩阵实验室MATLAB2013软件包,基于统计学参数图SPM12 软件的VBM8(http://dbm.neuro.uni-l jena.de/vbm)对采集的三维数据进行预处理。主要步骤包括:①图像转化;②获取大脑mask;③空间标准化;④灰白质分割;⑤平滑。计算两组全脑灰质(gray matter, GM)、白质和脑脊液体积并取平均值,最后计算每组疼痛相关区域的平均GM 体积。
(6)超微结构分析:两组大鼠于造模术后8 周、12 周随机各选取2 只,麻醉显效后,大鼠取仰卧位固定于操作台,剪开胸腔暴露心脏,将26G 留置针经心尖插入,剪开右心耳,用0.9%氯化钠注射液200 ml 快速灌注置换血液,待肝脏明显由红变白且右心耳流出液变清后,用3%多聚甲醛-4%戊二醛混合固定液(4℃) 50 ml 低速灌注,灌注时间约30 min。灌注过程中大鼠出现四肢抽搐,表明灌注良好。灌注结束后,迅速取3~4 mm 眶下孔段与颅内段三叉神经,置于混合固定液中,在4℃的冰箱中保存24 h。
标本依次进行固定-脱水-渗透-包埋-超薄切片-染色-电镜观察,获得所需要的神经超微结构透射电镜图像。所有超微结构图像由专业病理技师采集,图像经电子显微镜放大6000 倍。根据髓鞘损伤程度将有髓轴突超微结构分为0 级、1 级、2 级、3 级、4级(见表2)[10]。由2 名研究者依据髓鞘损伤分级标准将TEM 图像中的髓鞘进行分级统计,并记录实验结果,对存在异议的髓鞘由2人讨论后共同评估决定。

表2 髓鞘损伤分级Table 2 Classification of myelin sheath injury
3.统计学分析
使用SPSS 23.0 对数据进行统计分析。对符合正态分布的数据,采用单因素方差(ANOVA)分析进行比较,事后两两比较采用LSD 法;对于非正态分布的数据使采用非参数检验进行统计分析,使用Kruskal-Wallis test 对多个独立样本进行比较,Mann-Whitney U test 对组间差异进行分析,Bonferroni检验对报告的P值进行多重比较校正。P< 0.05 为差异具有统计学意义。
VBM 图像结果通过双样本t检验进行比较,结果由P< 0.005 未校正产生,多重比较校正采用了Cluster-level 设置为P< 0.05 的FDR 进行校正。使用xjview 读取各脑区体积存在的体素差异,在体素高于100 的集合被认为差异具有统计学意义。
结 果
1.模型的评估
实验组造模时间约每只40 min,实验组大鼠造模共计21 只,符合造模要求的16 只(见图2A,2B),造模成功率为76.1%。部分失败的实验组内未看到琼脂,部分琼脂不在三叉神经脑池段(见图2C, 2D),虽然对三叉神经也存在一定压迫作用,但是不能除外其他因素,故纳入排除标准。

图2 通过头颅MRI 对琼脂压迫模型进行验证(A, B)分别为琼脂压迫模型的轴位和矢状位图像,可以清晰的看到琼脂位于三叉神经入脑桥区,与对侧三叉神经对比,可以看到三叉神经根部受到明显压迫;(C, D)分别为造模失败的轴位和矢状位图像,图示琼脂注入脑桥内,虽然也对三叉神经形成一定的压迫,但可能对脑桥组织造成影响,故排除。Fig.2 Verification of the agar compression model using cranial MRI(A, B) Show the axial and sagittal positions of the agar compression model, respectively.It can be clearly seen that the agar is located in the pontine area of the trigeminal nerve.Compared with the contralateral trigeminal nerve, it can be seen that the trigeminal nerve root is significantly compressed; (C, D) Show the axial and sagittal images of failed modeling.Although agar injection into the pons may cause some compression to the trigeminal nerve, it may have an impact on the pons tissue, so it is excluded.
2.痛阈分析
实验组与对照组术前1~7 天痛阈较为稳定无显著性差异。术后两组痛阈均出现下降,实验组痛阈到术后7 天痛阈达到最低值,术侧痛阈(2.08±0.45) g,这种较低痛阈值持续到术后21 天,随后出现缓慢的回升,于术后42 天基本恢复正常;术后42 天实验组痛阈为(10.81±1.33) g。结果显示实验组术侧痛阈于术后3 天至术后35 天与对照组差异有显著统计学意义(P< 0.001)。对照组术侧痛阈于术后3 天达到最低值为(7.84±1.34) g,到术后14 天恢复到基线水平(见图3)。

图3 实验组模型痛阈值变化**P < 0.01,***P < 0.001,与对照组相比Fig.3 Changes in pain threshold of experimental group model**P < 0.01, ***P < 0.001, compared with group control.
3.VBM 分析结果
实验组大鼠术后4 周大脑灰质体积未出现明显变化。8 周时左侧旁下托、左侧齿状回、左侧胼胝体压部、右侧顶叶联合皮质、下丘脑、右侧基底前脑区域、右侧纹状体及双侧初级躯体感觉皮质灰质体积显著变小(见图4A)。12 周时这些变化范围明显扩大,甚至蔓延到双侧脑区(见表3);另外新观察到导水管周围灰质、左侧内嗅皮质、双侧扣带回及双侧海马的灰质体积显著变小(见图4B)。全脑分析没有显示灰质体积增加的脑区。

图4 实验组术后8 周及12 周脑区结构变化(A, B)分别为实验组术后8、12 周脑区灰质变化。图上有颜色的位置为具有显著差异的脑区,颜色的值对应colorbar 上的值,蓝色表示此处脑区的指标值为实验组小于对照组,红色为实验组大于对照组。Fig.4 Structural changes in brain regions at 8 and 12 weeks after surgery in experimental group(A, B) Show the changes of gray matter in the brain area of the experimental group at 8 and 12 weeks after surgery.The positions with colors on the graph are brain regions with significant differences, and the color values correspond to the values on the colorbar.Blue indicates that the index values of the brain regions here are smaller in the experimental group than in the control group, and red indicates that the experimental group is larger than in the control group.
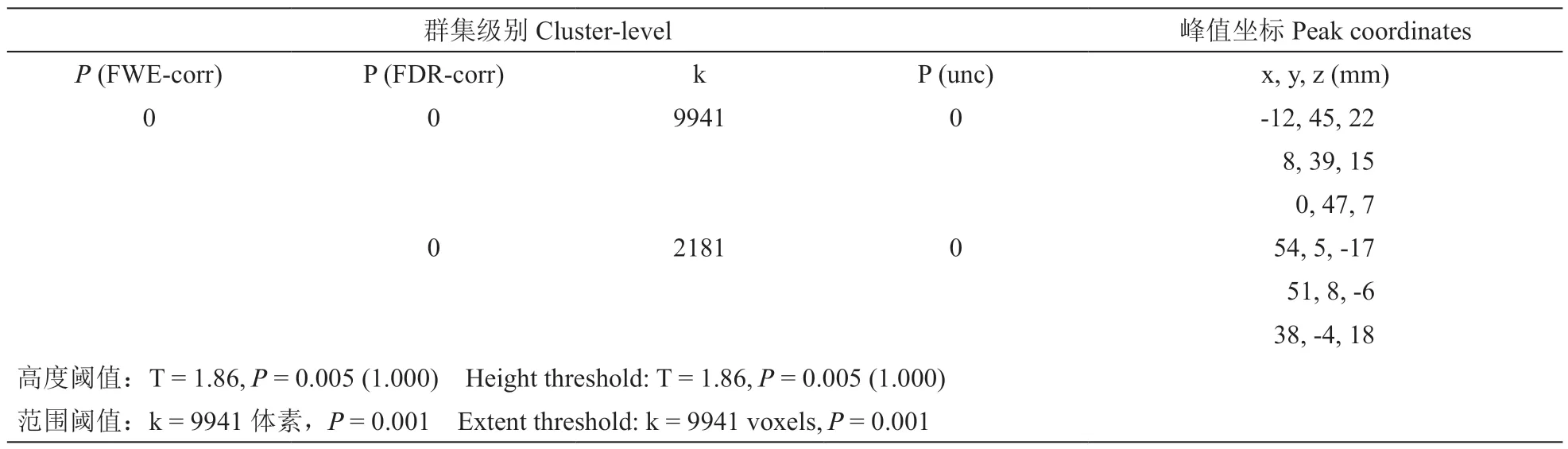
表3 实验组术后12 周头颅VBM 分析聚类水平下的FDR 校正后结果Table 3 Head VBM analysis results of the experimental group 12 weeks after surgery
4.透射电镜结果分析
电子显微镜下,对照组髓鞘致密完整,微管、微丝排列规则,线粒体结构清晰,超微结构较完好,仅出现部分轻度损伤;实验组于术后8 周和12 周ICS 和ION 的电镜结果均观察到明显脱髓鞘改变,在轻度损伤的有髓轴突中,髓鞘轻度分层,有髓轴突胞质结构正常。在严重损伤的有髓轴突中,髓鞘有严重的分层和解体,轴突细胞质内线粒体肿胀,嵴消失,微管和微丝结构紊乱,部分轴突变暗,内含髓鞘卵圆形小体(见图5)。按照超微结构损伤分级标准,将各个髓鞘划分为不同等级(见表4)。术后8 周和12 周实验组神经节段与对照组对应神经段存在显著性差异(P< 0.05);实验组术后8 周和术后12 周的ION 和ICS 分别存在差异。

图5 有髓轴突细胞质的透射电子显微镜照片(图像放大倍数× 6000,标尺= 5 µm)(A)对照组术后8 周ICS 段TEM 图。可看到基本正常的髓鞘(绿色箭头)超微结构及正常的线粒体、微管和微丝,部分层面可看到髓鞘轻度肿胀(红色箭头);(B)实验组术后8 周ICS 段TEM 图片;(C)实验组术后12 周ICS段TEM 图片。可看到髓鞘出现分离中断(蓝色箭头)、蜂窝状改变(橙色箭头),部分髓鞘可见髓球体形成(白色箭头);部分轴突可见线粒体肿胀及白色包涵体形成、膨胀的空泡及扭曲的嵴膜和大面积微管和微丝碎裂,紊乱,轴突膜不完整。Fig.5 Transmission electron micrograph of medullated axonal cytoplasm(Image magnification:× 6000, Scale bar = 5 µm)(A) Shows the TEM image of ICS segment in the agar control group 8 weeks after surgery.Basically normal ultrastructure of the myelin sheath (green arrow) and normal mitochondria, microtubules, and microfilaments can be seen, and slight swelling of the myelin sheath can be seen on some layers (red arrow); (B) Is a TEM image of the ICS segment in the agar experimental group 8 weeks after surgery; (C) Is a TEM image of the ICS segment in the agar experimental group 12 weeks after surgery.Separation and interruption of the myelin sheath can be seen (blue arrow), honeycomb like changes(yellow arrow), and formation of medullary spheres can be seen in some myelin sheaths (white arrow); In some axons,mitochondrial swelling and the formation of white inclusion bodies, swollen vacuoles, twisted cristae, and large areas ofmicrotubules and microfilaments can be seen, with disorder and incomplete axonal membranes.

表4 实验组髓鞘损伤分级Table 4 Grade of myelin sheath injury in experimental group
讨 论
本研究建立了三叉神经根部琼脂压迫模型,通过对模型的疼痛阈值变化、头颅VBM 变化、ION及ICS 段神经超微结构变化的研究,表明琼脂压迫三叉神经根模型为可靠的TN 动物模型。
琼脂是一种线性多糖,具有高黏度、低水溶性和低生物利用率等特点,在温度低于40℃便会凝固[11]。基于这些特点,琼脂可作为压迫材料来制备三叉神经根压迫模型,用以较好地模拟占位性病变压迫三叉神经根的发病机制。
1.模型痛阈值变化
实验结果表明,三叉神经根入脑桥段的压迫能造成大鼠颜面部机械性异常疼痛,并较稳定地持续一段时间。对照组术后痛阈值出现轻度下降,于术后3 天达到最低值,随后出现缓慢恢复,并于术后14 天基本恢复正常,这可能是由穿刺损伤所致。
实验组与相应对照组术后短期内均出现痛阈值下降的现象,故既往仅通过测量痛阈值来判断造模结果的实验方法[6]存在一定的瑕疵。本研究于造模术后3 天通过大鼠头部磁共振扫描,确保琼脂成功注射到三叉神经根部并对三叉神经根产生压迫,早期证实模型是否成功,便于进一步实验研究。
实验过程中,实验组大鼠均表现出痛阈值降低的现象,并未出现阴性结果。在对TN 病人的研究中发现,部分存在血管神经冲突现象的健康受试者并没有出现TN 症状。Lamani 等[12]根据血管对神经压迫的严重程度,将其分为3 级:I 级:血管与神经接触,而没有任何可见的神经移位或扭曲;II级:血管导致神经移位和/或扭曲,而神经上没有压痕;III 级表示血管在神经上造成明显的压痕。Ruiz-Juretschke 等[13]发现在无症状个体中,桥小脑角(cerebellopontine angle, CPA)处与三叉神经的轻度压迫、远端或以静脉为主的血管接触的比率较高。实验组模型在进行模型验证时,通过MRI 头颅扫描,剔除了未对三叉神经造成明显压迫的大鼠,故我们推测,临床上伴血管神经冲突现象的健康受试者神经受压迫等级仅为I 级的可能性较大,导致受压处神经未出现模型脱髓鞘改变和电位冲突。
部分学者支持“动脉接触”假说,即三叉神经上的脉冲式机械压力会带来神经纤维的脱髓鞘、异位神经冲动和邻近纤维的异常非突触性传导,最终可能导致皮肤刺激引起的阵发性疼痛[14]。然而,通过MRI 扫描和术中发现证实9.2%~38%的TN 由“静脉冲突”所导致[15]。Lutz 等[16]利用DTI 技术发现TN 的微结构改变与血管的类型无关。本研究使用琼脂对三叉神经产生压迫,模拟桥小脑角处良性肿瘤对三叉神经压迫反应,可引发大鼠疼痛阈值的改变。因此,我们推测血管搏动可能不是TN 发病的必要因素。
2.超微结构结果分析
实验组术后8 周和12 周均能观察到明显脱髓鞘损伤,由于病因未去除,且随时间延长(8~12周),神经脱髓鞘损伤呈加重趋势。实验组术后8周和12 周ION 段和ICS 段TN 均出现显著的髓鞘损伤,说明ICS 段损伤可经神经扩散或通过神经周围传导从而累及三叉神经ION 段。这与Marinković等[17]的实验结果一致。
Lutz 等[16]利用弥散张量成像(diffusion tensor imaging, DTI)技术发现TN 的微结构改变与症状持续时间无关,与本研究结果不一致。本研究大鼠超微结构分析标本采集时间为8 周和12 周,相较于大多数临床TN 病人,病程持续时间较短,由此推测在短期内三叉神经脱髓鞘的程度与疼痛持续时间具有相关性,对长期疼痛的持续时间和脱髓鞘程度的关系还有待进一步研究。
3.VBM 结果分析
在TN 病人的大脑VBM 分析中,可观察到初级躯体感觉皮质、眶前叶皮质、次级躯体感觉皮质、丘脑、脑岛、前扣带回 (anterior cingulate cortex, ACC)、小脑和背外侧前额叶皮质的灰质体积变小[18,19];Zhang 等[20]通过TN 病人和健康受试者对比,发现TN 病人双侧杏仁核、中脑导水管周围灰质和右侧脑岛的GM 体积变小。琼脂压迫模型的实验结果与TN 病人的VBM 分析结果较为符合,证明该模型可在一定程度上可靠地模拟TN 的发生。
将外周伤害性刺激转化为痛觉需要多层次的整合。首先,疼痛信号沿着脊髓丘脑束传导到丘脑后部的多个核团,然后投射到顶叶内侧岛(包括体感皮质S1)、扣带回和岛叶后部[21]。岛叶后部是与疼痛关系最密切的区域之一,刺激岛叶皮质可以直接产生疼痛[22]。岛叶吻腹侧无颗粒区参与情绪调节,传出联系包括杏仁核的基底复合体区、伏核、下丘脑外侧区、中缝背核、导水管周围灰质 (periaqueduct gray matter, PAG) 等区域[23]。丘脑室旁核-岛叶-杏仁核-PAG 通路激活下行疼痛调控通路。扣带回是边缘系统重要组成部分之一,扣带回的前部又称为情感部分,主要负责情绪的产生,自主反应及认知等方面,一项动物研究发现,ACC 及其对伏隔核的投射选择性地参与了疼痛和镇痛的社会转移[24]。疼痛刺激会引起扣带回GM 体积减低,健康志愿者反复疼痛刺激11 天后,扣带回前部GM 体积明显降低[25]。初级感觉皮质(S1 区)位于中央后回,是躯体感觉系统的一部分,它还可以减少伤害感受。
痛觉的形成还需要第二层次的伤害性感觉整合。参与二次整合的脑区包括前脑岛、前额叶、顶后叶、纹状体、海马体、海马旁回、小脑和颞顶交界区。这些脑区不是脊丘脑束的直接投射区域,因此,直接刺激这些区域不会引起疼痛,选择性损毁这些区域也无明显的镇痛作用。
TN 病人大脑结构变化与病情程度及持续时间相关[26],本研究证实了这一观点。此外,本研究发现,实验组大鼠的灰质体积变小涉及感觉辨别的皮质(S1、V1)、情感-动机维度的边缘区域(海马区及海马旁皮质、下丘脑、纹状体)和情绪-认知调节的皮质(岛叶皮质、基底前脑),这与既往的研究结果相似[27]。影像学结果表明,编码疼痛情绪、动机、记忆和持续性疼痛的脑区涉及皮质-边缘系统[28]。
术后8 周实验组出现PAG 体积变小,且12 周时受累范围增大。持续性疼痛状态在一定程度上反映了下行抑制系统的功能障碍[29]。延髓头端腹内侧部(rostral ventromedial medulla, RVM)包括中缝大核及其周围网状区,是痛觉下行调制的主要输出节点。研究表明,PAG-RVM 环路激活,可以增强痛觉下行抑制和减轻痛觉过敏[30]。因此,PAG 灰质体积减小,反应了这一区域功能在一定程度上受损,进一步证实了该区域的解剖损伤可能是TN发病的基础。
为避免雌性激素影响实验结果,本研究仅纳入了雄性大鼠,这难免会造成性别偏倚,且临床TN病人以女性居多,模型与临床TN 存在一定差异。既往曾晨[31]针对大鼠DTI 研究发现由于大鼠中枢神经系统体积较小,DTI 图像质量较差,部分层面形变严重,因此3.0T MRI 的DTI 序列不适宜用于对大鼠中枢神经系统进行研究;未来可通过更高场强的MR 进一步探索大鼠脑功能等变化。
综上所述,三叉神经根部琼脂压迫模型从发病机制上符合占位性病变所致TN 的发病机制,经痛阈值测定、神经超微结构分析及灰质体积VBM 分析,证实其作为占位性病变所致继发性TN 动物模型的可靠性。
利益冲突声明:作者声明本文无利益冲突。
