AMPK通过下调CCL2抑制舌鳞状细胞癌肿瘤微环境中M2巨噬细胞的极化
2023-11-27唐显帅邹军荣
唐显帅 邹军荣
舌癌(tongue squamous cell carcinoma,TSCC)的发生将严重影响舌癌患者的正常生活。且TSCC具有非常强的侵袭、转移和复发性,肿瘤早期区域淋巴结转移率很高,严重影响患者生存率[1]。临床上,对于通过组织学检测确诊的舌鳞癌患者,主要采用以手术和放、化疗的综合治疗为主,然而治疗后患者的5 年生存率仅为50%左右[2]。因此,深入研究舌鳞癌发生、发展的分子机制,寻找能更好改善患者预后的治疗方式对舌癌的治疗具有重要意义。
口腔是直接与外部环境连接的重要通道,舌癌组织具有大量的单核细胞浸润。肿瘤相关巨噬细胞(Tumor associated macrophages,TAMs)是肿瘤微环境的最常见单核细胞,为响应肿瘤基质特殊的抑制肿瘤微环境(tumor micro-enviroment,TME)的改变,可以分化为M1型和M2型[3]。目前主流观点认为,M1型TAM能释放多种促炎因子、免疫激活因子和趋化因子(CCL2,CCL18,CCL17,CXCL4等)[4],通过急性促炎反应、免疫活化反应以及细胞吞噬功能,发挥抗肿瘤的作用。而M2型巨噬细胞可通过分泌细胞因子直接促进癌细胞的增殖、调节肿瘤微血管的形成等多种方式促进癌症的进展[5]。因此,有研究团队提出了多种基于巨噬细胞的癌症免疫治疗方法,比如嵌合抗原受体(chimeric antigen receptor,CAR)巨噬细胞等[6]。
然而,参与TME巨噬细胞的极化的调控方式极其复杂。其中,癌细胞对巨噬细胞的驯化是最受关注的机制之一。研究显示,舌癌细胞的代谢重编程是癌症重要的特征,可通过激活炎症信号通路调节TME至适宜自身生长的环境[7]。单磷酸腺苷激酶(AMP-activated protein kinase,AMPK)作为肿瘤能量感受器,对肿瘤糖酵解获取能量的方式(Warbug效应)具有抑制作用[8]。然而,其作为肿瘤治疗靶标越来越受到质疑,比如一项关于二甲双胍对乳腺癌风险的影响的研究显示,二甲双胍的使用与ER阳性乳腺癌风险降低有关,但三阴性乳腺癌的风险反而有了大幅度升高[9]。目前文献对AMPK在舌癌中的作用报道不一。其是否参与调节舌癌的TME巨噬细胞的极化,尚未见文献报道。为此,本研究主要探究了AMPK的磷酸化水平对患者预后的影响,及肿瘤细胞的AMPK的激活状态对TME中浸润的单核细胞极化的影响。
1 材料与方法
1.1 主要试剂
多重免疫荧光所使用Opal多重免疫荧光染色试剂盒(Akoya Biosciences公司,美国);多重免疫荧光组织芯片(HOraC080PG01,上海芯超公司);胎牛血清(FBS)(Hyclone,β-mercaptoethanol,北京索莱宝);免疫组化二抗(PV6000)及其相关试剂(北京中杉金桥)。
1.2 实验方法
1.2.1 免疫组织化学 收集45 例2009 年1 月~2015 年12 月在南昌大学病理科术前未进行放疗和化疗的舌癌患者手术切除标本,其中男性31 例,女性14 例,年龄36~89(57.5±12.5) 岁。标本为手术切除后1 h内获得,立即放入福尔马林固定过夜,蜡块包埋切片。患者基本资料见表1。本研究由南昌大学第一附属医院伦理委员会批准(批准号:20200031)。

表1 一抗及其对应的Opal染料
采用免疫组织化学法检测舌癌组及癌旁组的组织中p-AMPK的蛋白表达水平(抗体来源于CST,浓度1∶500),免疫组化染色方法参考本文作者已经发表论文,采用德国半定量评分法[10],以“-”和“+”为p-AMPK低表达组(p-AMPKlow),以“++”和“+++”为p-AMPK高表达组(p-AMPKhigh)。并对患者进行随访,比较两组患者的生存时间。
1.2.2 多重免疫荧光 通过免疫组化预实验初步确定各个抗体的浓度,单荧光预实验确定多色荧光浓度。多色荧光预实验确定各个抗体的通道组合。多色荧光实验步骤:组织脱蜡水化、柠檬酸修复液微波加热抗原修复1 h,胎牛血清室温封闭液30 min,滴加一抗,4 ℃过夜,TBST洗涤(3×3 min)。滴加二抗孵育30 min,TBST洗涤。Opal染料孵育10 min,TBST洗涤,再次微波炉加热修复,滴加一抗,重复上述步骤,直至最后一个抗体结束,DAPI染核,荧光封片剂封片。所使用一抗及其对应的opal染料如下表1。
实验结束后,染色好的组织芯片用Akoya Vectra Polaris组织全景多光谱扫描及inform分析系统(Akoya Bioscience)进行分析。阳性率以阳性细胞数/总细胞数代表某指标的阳性率,以CD68+CD163-代表M1型巨噬细胞,以CD68+CD163+代表M2型巨噬细胞。
1.2.3 细胞培养 人舌癌细胞Cal27(上海交通大学医学院第九人民医院口腔医学重点实验室)。将细胞在DMEM中培养,用含10% FBS,10 mg/mL双抗(P/S)的DMEM培养基进行培养。人THP-1细胞(武汉Procell公司),用含10%FBS,0.05 mmol/L β-mercaptoethanol以及1%P/S的RPMI-1640进行培养。细胞培养环境为37 ℃,5%CO2。
1.2.4 Western-blot PBS或者metformin(10 mmol/L)刺激Cal27细胞8 h,时间到了后收集细胞,lysis buffer 4 ℃裂解30 min。使用BCA蛋白质测定法(thermo fisher scientific)定量蛋白质浓度。将等量的蛋白质(约20 μg)在10% SDS-PAGE中电泳,随后转移到NC膜上。在5%脱脂奶粉中室温封闭1 h,置于相应的目的蛋白抗体中4 ℃下摇床孵育过夜。TBST洗涤3 次,二抗室温孵育1~2 h,TBST洗涤3 次,每次10 min,使用ECL检测系统进行曝光。使用ImageLab软件定量免疫反应条带。
1.2.5 MTT实验 接种细胞12 h后,用二甲双胍(10 mmol/L)处理Cal27细胞,观察细胞12~48 h的细胞增殖。药物处理结束后,向每个孔中加入20 μL MTT(5 mg/mL),并将板在37 ℃下孵育4 h。然后弃去MTT培养基混合物并向每个孔中加入150 μL二甲基亚砜。酶标仪检测490 nm的吸光度。
1.2.6 RT-PCR检测CCL2转录水平 在6 cm dish中,接种5×105个Cal27细胞,使用二甲双胍(10 mmol/L)处理Cal27细胞,使用RNA提取试剂盒(北京天根)提取总RNA,并逆转录为cDNA备用。使用荧光定量PCR试剂盒(Promega)进行RT-PCR检测细胞CCL2的转录水平。引物序列如表2。

表2 引物序列
1.2.7 ELISA检测细胞培养上清CCL2水平 取上述RT-PCR实验所培养细胞的上清。将上清于1 500 r/min离心5 min去除死细胞,取上清,混匀后取200 μL备用。使用人CCL2检测试剂盒(ELISA,百奥莱博,ZN2069),按照试剂盒说明书步骤检测细胞培养上清中CCL2的水平。
1.2.8 THP细胞体外分化实验 人单核细胞THP-1细胞购于武汉Procell。M1型巨噬细胞的分化:细胞分化先用25 ng/mL的佛波醇12-肉豆蔻酸酯13-乙酸盐(PMA,Sigma,美国)处理24 h,然后在RPMI培养基中孵育24 h,使细胞分化成M0巨噬细胞。然后用LPS(100 ng/mL,Sigma)和IFN-γ(20 ng/mL,PeproTech,美国)进一步刺激细胞72 h。M2型巨噬细胞在的分化:THP-1细胞用25 ng/mL PMA刺激48 h,然后在没有PMA的RPMI-1640培养基中静置48 h后,用IL-4(50 ng/mL,PeproTech)和IL-13(20 ng/mL,PeproTech)进一步刺激细胞48 h。
1.2.9 流式检测巨噬细胞的分化情况 细胞的分化情况采用流式细胞术检测细胞的分化。在细胞实验结束后,取1×105个细胞,PBS洗涤3 次,先用同源血清室温封闭30 min,在M1和M2分化实验样品中分别加入2 μL CD68抗体(FITC,BD,美国)和2 μL CD163抗体(PE荧光,BD,美国)。 37 ℃孵育30 min,PBS洗涤3 次上机检测(Accuri C6,BD)。在本实验中,以CD68+为M1型巨噬细胞,CD163+为M2型巨噬细胞。实验结束后,将数据导出为fcs格式文件,用Flowjo V10软件分析数据。
1.3 统计学分析

2 结 果
2.1 舌癌组织中AMPK活性显著低于正常组织
为探究AMPK在舌癌患者中的表达及与预后的关系。本研究采集了本院45 例舌癌患者的石蜡标本进行免疫组化染色。免疫组化结果显示,p-AMPK阴性9 例(20%),阳性36 例(80%)(表3)。其表达强弱与不同性别、不同年龄和不同TNM分期组中无显著性差异,但是在分化程度上,p-AMPK的表达呈现显著性差异(图1A)。统计学分析结果显示,在高分化与中/低分化组中,p-AMPK有显著性差异(P=0.04)(图1B)。并且其修饰水平与分化程度(R2=-0.39,P=0.01)和TNM分期(R2=-0.311,P=0.038)呈现负相关(表3)。
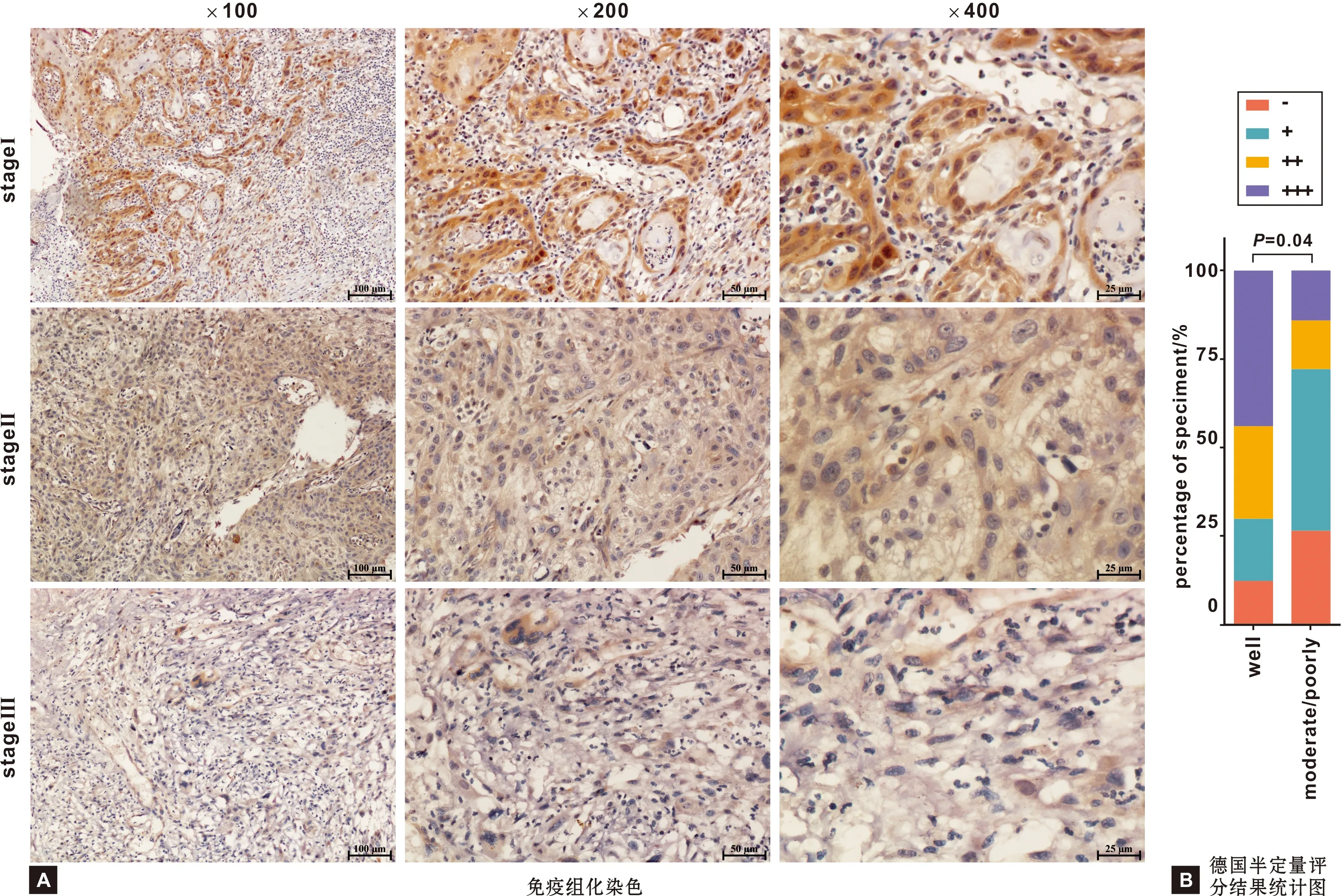
图1 AMPK的磷酸化水平在不同分化程度的舌癌组织中的表达情况
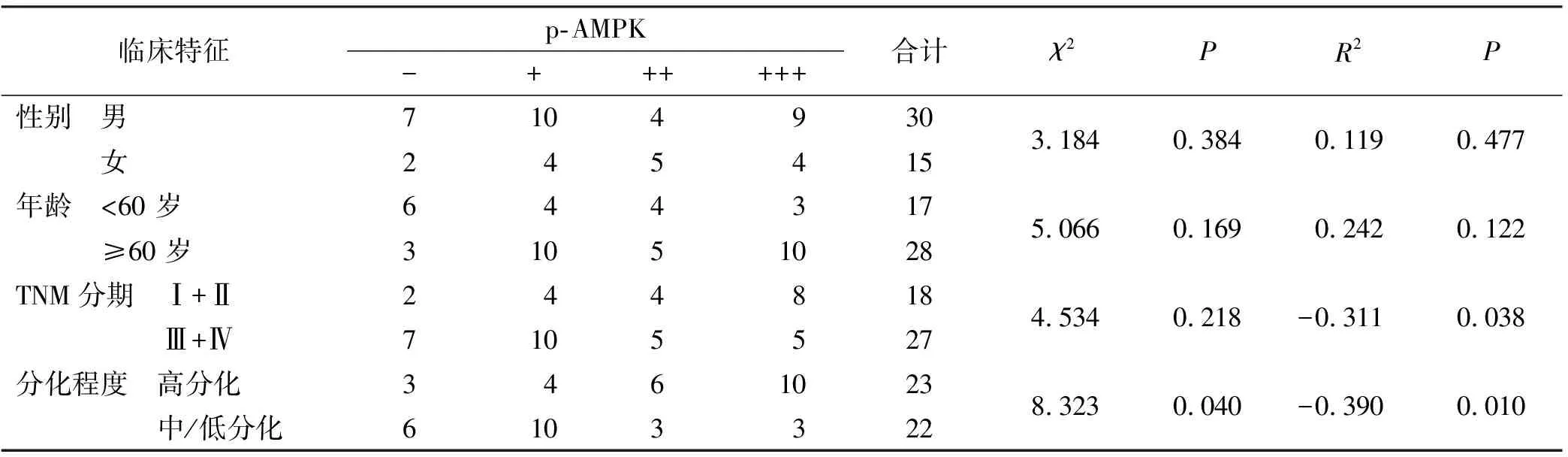
表3 p-AMPK免疫组化临床信息
为进一步观测患者预后与AMPK激活状态的关系,将上述纳入研究的患者分成AMPK磷酸化修饰水平高和低两组(p-AMPKhigh和p-AMPKlow),对患者生存时间进行了随访。结果显示,虽然AMPK的磷酸化修饰水平与患者的总生存率(59%vs43.5%)无统计学差异,但是AMPK的磷酸化修饰水平越高,患者的平均生存时间越长(49.8vs36.7 个月),差异具有统计学意义(Gehan-Breslow-Wilcoxon检验,P=0.047,图2)。患者总生存率无统计学差异(log-rank检验,P=0.15)。
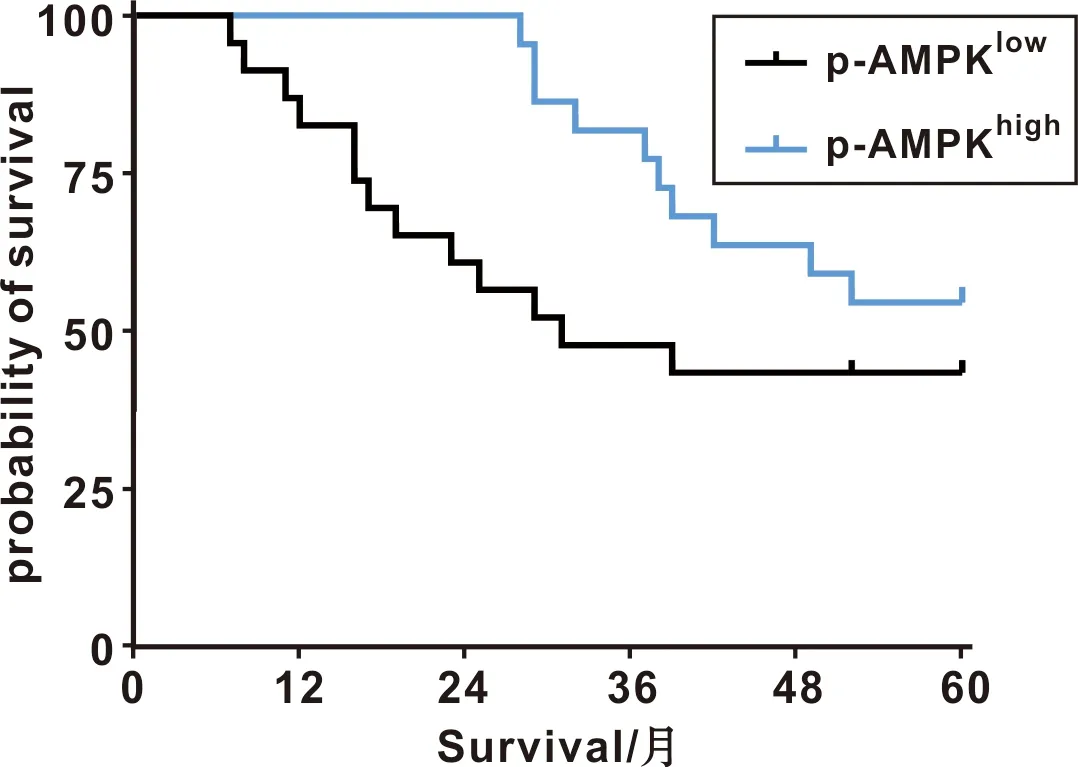
图2 AMPK磷酸化修饰与患者预后的关系
2.2 AMPK磷酸化修饰的激活剂metformin抑制舌癌细胞株的增殖
课题组长期从事AMPK在癌症中作用的研究。为明确AMPK在舌癌中的作用,并确定本研究后续实验最佳的给药浓度,本研究给予Cal27细胞10 mmol/L浓度的metformin刺激8 h。相较于PBS对照组,该给药方式能显著激活AMPK(图3A~B)。同时,AMPK激活后,对Cal27增殖速度有明显抑制(图3C)。上述结果提示10 mmol/L的二甲双胍能很好的激活AMPK,同时,AMPK的激活将抑制舌癌细胞的增殖能力。

图3 metformin抑制舌癌细胞株的增殖
2.3 AMPK的活化水平与舌癌组织中的M2型巨噬细胞浸润呈正相关
为了进一步探究AMPK与肿瘤微环境中的巨噬细胞的分化的关系,本研究在一商品化的组织芯片中,通过多重免疫荧光染色,观察AMPK的磷酸化水平与M1和M2型巨噬细胞浸润的关系。结果显示,在p-AMPK(绿色)高表达的患者癌组织中,呈现更高的M1型巨噬细胞浸润,以及更低的M2型巨噬细胞浸润。而在p-AMPK高表达的患者中,这种趋势正好相反(图4A)。对染色结果进行软件扫描阅片,统计每个癌组织的阳性细胞比例,并用Pearson检验p-AMPK与巨噬细胞浸润的关系。结果提示,p-AMPK高表达预示着更高的M1型巨噬细胞浸润(图4B)和更低的M2型巨噬细胞浸润图4C)。遗憾的是,这种关系并无统计学意义。
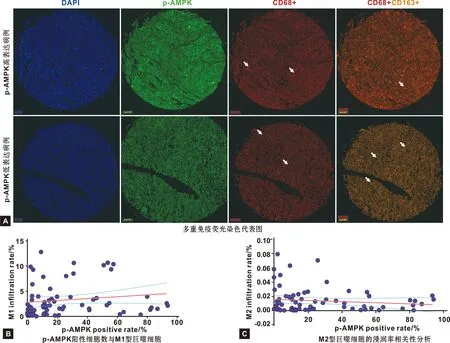
图4 多重免疫荧光染色及相关性分析结果
2.4 舌癌细胞中AMPK激活后的培养上清抑制M2巨噬细胞的分化
为进一步验证上述现象,本研究采用体外诱导的方法,观察舌癌细胞在肿瘤微环境中对巨噬细胞分化的影响。结果提示,THP-1细胞在用Cal27细胞培养上清处理后,相对于正常诱导条件下,M2诱导成功率更高,而用二甲双胍处理后的Cal27细胞培养上清处理THP-1细胞,其诱导成功率下降(图5E~5H)。在M1型巨噬细胞诱导实验中,情况刚好相反(图5A~5D)。
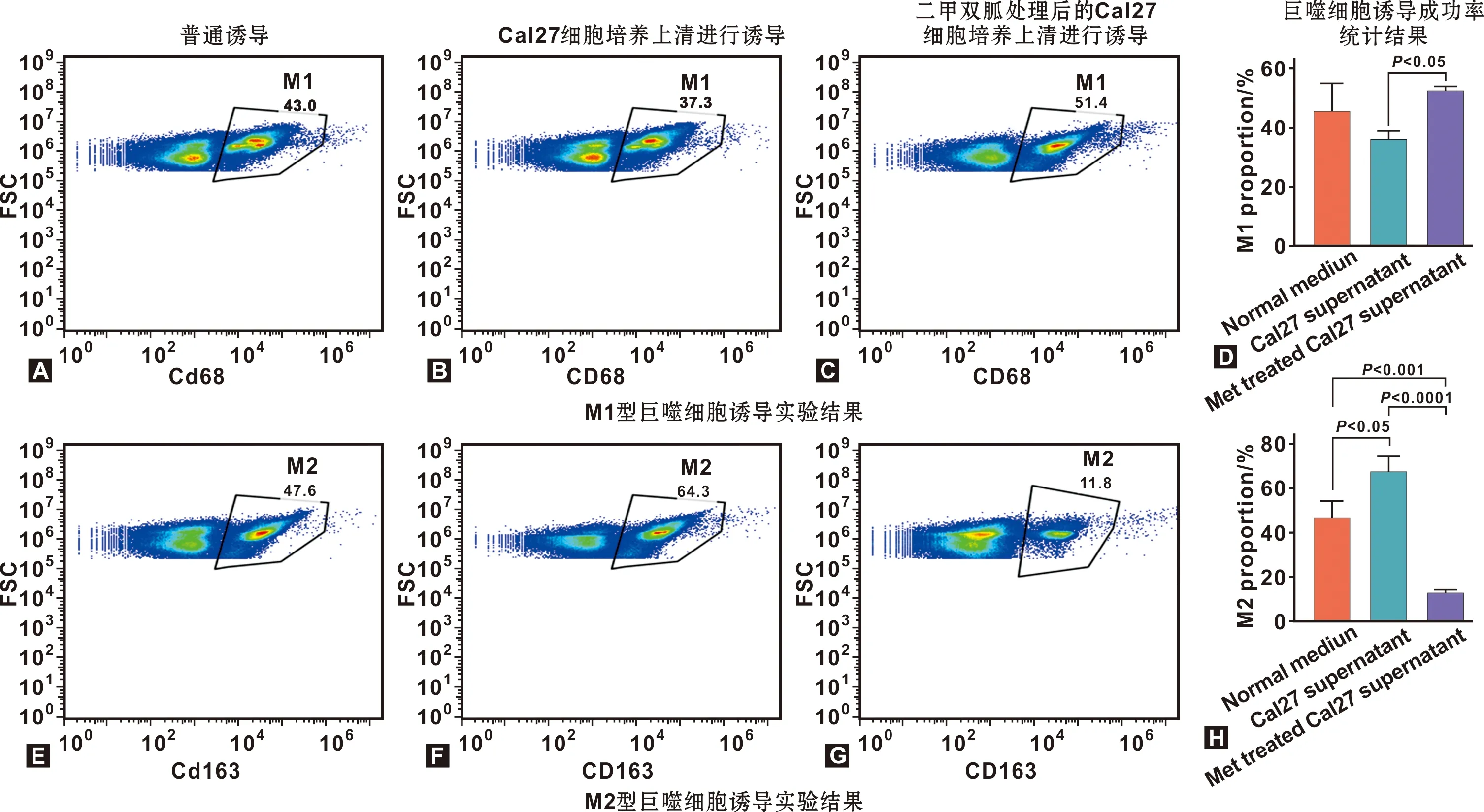
图5 AMPK影响THP-1体外诱导成功率
2.5 AMPK抑制CCL2的表达可能与NF-κB信号通路的抑制有关课题组在一项关于巨噬细胞的研究中发现,AMPK激活后可以抑制巨噬细胞的NF-κB信号通路的激活以及CCL2的表达[11]。为探究AMPK与巨噬细胞浸润关系可能的机制,以及AMPK是否也对舌癌细胞的CCL2表达起调控作用,本研究通过给予Cal27细胞二甲双胍处理,观察NF-κB的激活以及CCL2的表达情况。结果提示,当AMPK被激活后,NF-κB信号通路受到抑制(图6A),同时CCL2的转录水平(图6B)以及分泌(图6C)都受到相应的抑制。
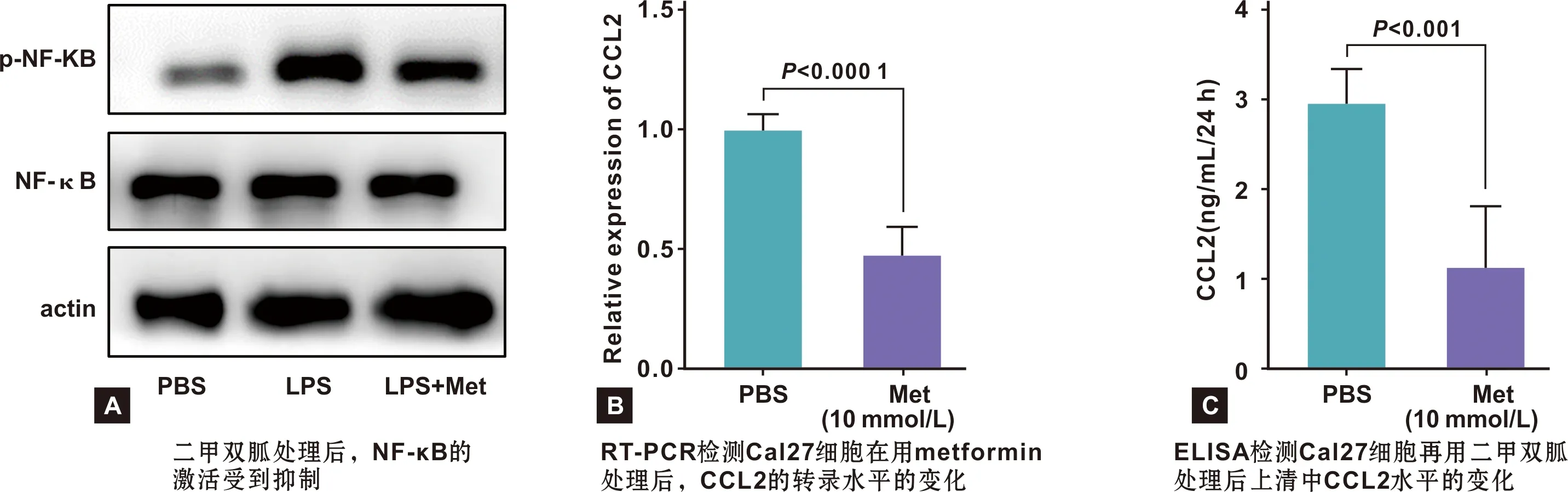
图6 激活AMPK抑制舌癌细胞NF-κB信号通路及CCL2表达
3 讨 论
AMPK作为肿瘤的能量感受器以及重要的蛋白激酶,参与调节了肿瘤的增殖、迁移等过程,但同时其临床价值越来越受到质疑[12]。其在舌癌的作用研究主要集中在通过抑制癌细胞的增殖抑制癌症的进展等方面。本文通过检测了临床患者的AMPK的激活状态,并通过患者术后随访,验证了AMPK的磷酸化水平越低,患者的预后越差。虽然本研究中,由于纳入研究的病例有限,患者的总生存率与AMPK的磷酸化水平无显著差异,但是与患者的总生存时间呈现正相关,提示AMPK可抑制舌癌的进展。
AMPK已经被诸多研究证实能够通过影响SIRT1、FoxO家族和过PGC-1α等,抑制炎症因子的表达影响肿瘤细胞炎症信号通路的激活[13]。为证实这一现象,本研究通过组织芯片多重免疫荧光染色观察到AMPK磷酸化水平低的患者,其M1巨噬细胞浸润率也更低,而M2型巨噬细胞浸润率增加。即AMPK的磷酸化水平与M2型巨噬细胞浸润呈现负相关。虽然在本研究中,二者的相关性并无统计学意义(可能CD68和CD163的特异性有关),但是该结果提示了二者的间接关系。为明确AMPK激活后对巨噬细胞极化是否直接相关,采用了单核细胞株体外条件性共培养观察肿瘤细胞AMPK激活后对巨噬细胞的极化的影响。结果显示,当用二甲双胍处理舌癌细胞株后的上清处理诱导的THP-1细胞,其M2诱导成功率下降。上述结果提示,AMPK的磷酸化可能抑制巨噬细胞的M2极化。
课题组前一项研究提示在巨噬细胞中AMPK的激活将导致NF-κB信号通路的抑制及其相关趋化因子的表达[11]。为探究AMPK介导M2巨噬细胞极化的可能机制,本研究采用二甲双胍激活AMPK后,细胞的NF-κB信号通路激活受到抑制。同时,其下游巨噬细胞趋化因子CCL2的表达下降。研究显示,CCL2可以招募巨噬细胞,同时促进巨噬细胞向M2型极化。综上,本研究认为AMPK激活后通过抑制NF-κB信号通路下调CCL2的表达,进而抑制M2型巨噬细胞的极化。鉴于NF-κB信号通路的广泛作用,CCL2可能不是其唯一的调节方式,尚需后续的进一步明确。
综上所述,AMPK作为细胞的能量感受器和重要的蛋白激酶,参与了癌症的能量代谢和细胞增殖、迁移等多个细胞重要生物学过程,参与了复杂的信号通路交叉调控。然而,正是由于AMPK的作用复杂性,其作为肿瘤的治疗靶点尚需进一步的探索。认为其作为肿瘤治疗的辅助靶点可能是今后的重要方向,正如AMPK通过调控舌癌细胞表达CCL2参与调控肿瘤微环境,可作为药物发挥肿瘤抑制作用的协同给药策略。
