糖酵解关键酶HK2通过诱导NF-κB核转位调控口腔鳞癌B7-H3的表达机制
2023-11-27赵振彦韩雪娇杨子桧黄军红雷德林魏建华李欢
赵振彦 韩雪娇 杨子桧 黄军红 雷德林 魏建华 李欢
口腔鳞癌(oral squamous cell carcinoma,OSCC)是发生在口腔黏膜的恶性肿瘤,占口腔癌的90%以上[1]。口腔癌每年新增病例超过37 万例,死亡人数超过17 万例[2-3]。口腔鳞癌总体5 年生存率约为50%~60%,中晚期口腔癌患者的5 年生存率低于50%,多年来,口腔鳞癌5 年总体生存率并未得到明显改善[4-5],OSCC主要通过淋巴通道转移,且OSCC一旦出现颈淋巴转移,生存率可下降50%[6],目前常规治疗包括外科手术及放、化疗等方法,虽然治疗技术及理念也在不断更新,但复发率、转移率高,远期治疗毒性及治疗导致的器官功能损伤等问题依旧存在。因此,提高OSCC患者预后,研究治疗新策略迫在眉睫。
近年来,免疫治疗已成为癌症研究的一个重要领域,肿瘤微环境中免疫状态异常对癌症的发生发展有巨大影响[7]。目前,肿瘤免疫治疗主要包括细胞因子治疗、肿瘤疫苗治疗、细胞过继免疫治疗以及免疫检查点治疗等[8]。其中,拮抗免疫检查点的药物在多种肿瘤的临床试验中获得了良好的疗效[9-10]。而迄今为止,在OSCC及其他多种肿瘤中的研究表明,免疫检查点抑制剂对部分患者有很好的疗效,但仍有诸多患者响应率低,或在短暂应答之后病情加速恶化[11-12]。因此,可能还有其它免疫逃逸关键分子参与肿瘤免疫逃逸进程。B7-H3是重要的新型免疫检查点分子,目前没有已知的信号基序,其受体尚未被识别,但仍被认为是一种有巨大前景的免疫治疗研究方向[13]。
B7 homolog 3 protein(B7-H3)在多种肿瘤中高表达,导致患者预后不良和临床转归差[14-15]。目前已有研究表明,己糖激酶2(hexokinase 2,HK2)和核转录因子kappa B(NF-κB)关系密切,高糖条件下,HK2可以激活NF-κB通路并促进PD-L1的表达[16-18]。然而,口腔鳞癌中B7-H3是否受糖酵解途径调控仍不明确,B7-H3具体表达调控机制仍需要进一步探讨。该研究发现合并2型糖尿病的口腔鳞癌患者预后差[19],但该类患者的肿瘤样本中B7-H3的表达情况尚不明确。故本研究旨在探索高糖微环境对OSCC细胞B7-H3表达的影响,并探讨其表达调控机制。
1 材料与方法
1.1 主要仪器与试剂
HK1 抗体、HK2 抗体、B7-H3 抗体、NF-κB p65抗体、Lamin B1抗体、α-tubulin 抗体、β-actin抗体(GeneTex,美国);DMEM 高糖培养基(HyClone,美国);显微镜(DM2500,Leica,德国);Chemi-Doc XRS+WB发光成像仪(Biorad,美国);核酸蛋白测定仪和酶标仪(Eppendorf,德国)。
1.2 方法
选取口腔鳞癌细胞系CAL-27(北京大学口腔医院),置于含高浓度葡萄糖的低糖培养基DMEM中处理24h,葡萄糖设置浓度梯度(0、5、25、50 Glc mmol/L),通过qRT-PCR和Western blot检测不同浓度葡萄糖条件下细胞系中B7-H3的表达情况。引物见表1。

表1 用于qRT-PCR 的引物序列
将上述细胞系在含有不同浓度梯度葡萄糖(0、5、25、50 Glc mmol/L)的培养基中培养24 h,在高浓度葡萄糖(50 mmol/L)培养基中加入放线菌素D(1 mg/mL)预处理,通过qRT-PCR和Western blot检测上述条件下细胞系中B7-H3的表达。
为保证实验结果的可靠性,对实验用的细胞株进行STR鉴定。敲低CAL-27细胞HK2,用G-6-P或葡萄糖处理12 h,Western blot检测B7-H3、HK2表达情况。上述细胞系在含特定浓度葡萄糖的培养基中缺氧培养24 h,检测B7-H3、HK2表达。
HK2和NF-κB免疫共沉淀:首先加入含蛋白酶抑制剂的细胞裂解缓冲液以制备细胞裂解液,与相应抗体在4 ℃孵育过夜,接下来与20 mL ProteinA/G免疫磁(Life Technologies,Carlsbad)4 ℃孵育2 h,蛋白质通过SDS-PAGE凝胶分离并转移到PVDF膜上,使用ECL方法检测信号。
检测蛋白相互作用:通过Discovery studio软件进行蛋白质的预处理,删除其中的水分子、加氢以及电荷,提取结构中的原配体,采用Discovery studio软件中Zdock模块进行研究蛋白与蛋白对接,对接的受体蛋白HK2,对接的配体蛋白是NF-κB,选取E_rdock能量评分最低的Pose(表2)。

表2 e-rdock 精确对接分析评分表
在CAL-27细胞中过表达HK2,并通过免疫荧光和Western blot分析检测NF-κB的表达;过表达/敲低NF-κB,qRT-PCR检测B7-H3的表达。
1.3 统计学分析

2 结 果
B7-H3在口腔鳞癌合并2型糖尿病患者肿瘤组织、口腔鳞癌肿瘤组织中的表达量存在明显差异,B7-H3 在口腔鳞癌合并2型糖尿病患者肿瘤组织中表达更高(图1A)。将CAL-27细胞在葡萄糖缺失的DMEM中培养24 h,并补充相应浓度的葡萄糖,通过Western blot检测不同浓度葡萄糖条件下细胞中B7-H3的表达情况,发现B7-H3的表达随葡萄糖浓度的提高而增加(图1B)。在高浓度葡萄糖条件下,用转录抑制剂放线菌素D(1 mg/mL)处理细胞,能抑制该作用,B7-H3表达显著降低(图1C)。通过qRT-PCR检测不同浓度葡萄糖条件下B7-H3的表达,发现与Western blot结果趋势一致,即随葡萄糖浓度的提高B7-H3的表达逐渐增加(P<0.05)(图1D)。接下来用G-6-P或不加G-6-P处理HK2-shRNA稳定表达或对照shRNA的CAL-27细胞12 h,Western blot检测B7-H3、HK2表达情况,发现即使给予葡萄糖或G-6-P刺激,B7-H3表达依旧减少,表明HK2是葡萄糖诱导B7-H3表达的关键(图1E)。稳定表达HK2-shRNA或对照shRNA的CAL-27细胞在含特定浓度葡萄糖的培养基中缺氧培养24 h,结果表明敲低CAL-27细胞HK2,即使在缺氧环境下,B7-H3 表达依然减少,证明高糖诱导CAL-27细胞中B7-H3表达的HK2依赖性上调,与肿瘤微环境是否缺氧无关(图1F)。敲低CAL-27细胞的HK1,B7-H3的表达没有改变,进一步证实高糖诱导B7-H3以HK2依赖的方式表达上调(图1G)。
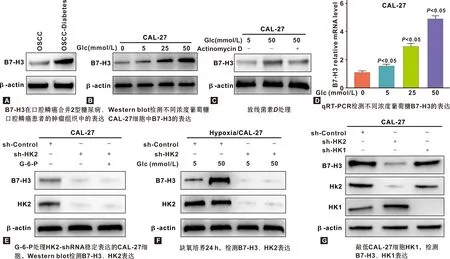
图1 高糖诱导B7-H3以HK2依赖的方式表达上调
通过免疫共沉淀分析,表明HK2与NF-κB密切相关(图2A)。采用Discovery studio软件中Zdock模块进行研究蛋白与蛋白对接,对接的受体蛋白HK2,对接的配体蛋白是NF-κB,选取E_rdock能量评分最低的Pose,为1.87844。二维相互作用见图2B,红色的虚线为盐桥,绿色的虚线为氢键(H:HK2;N:NFκB)。三维相互作用见图2C,绿色代表HK2,天蓝色为代表NF-κB,虚线为氢键,如Q103和S240形成氢键相互作用,其氢键的距离为2.2。表明HK2与NF-κB密切相关。在CAL-27中过表达HK2,Western blot检测提示NF-κB发生了核转位(图2D),免疫荧光也检测到过表达HK2导致NF-κB核转位(图2E)。接下来,qRT-PCR结果显示B7-H3 mRNA因过表达NF-κB而显著升高,因沉默NF-κB而降低(图2F),提示NF-κB可调控CAL-27细胞中B7-H3的表达。综上,HK2诱导NF-κB核转位导致B7-H3表达上调。
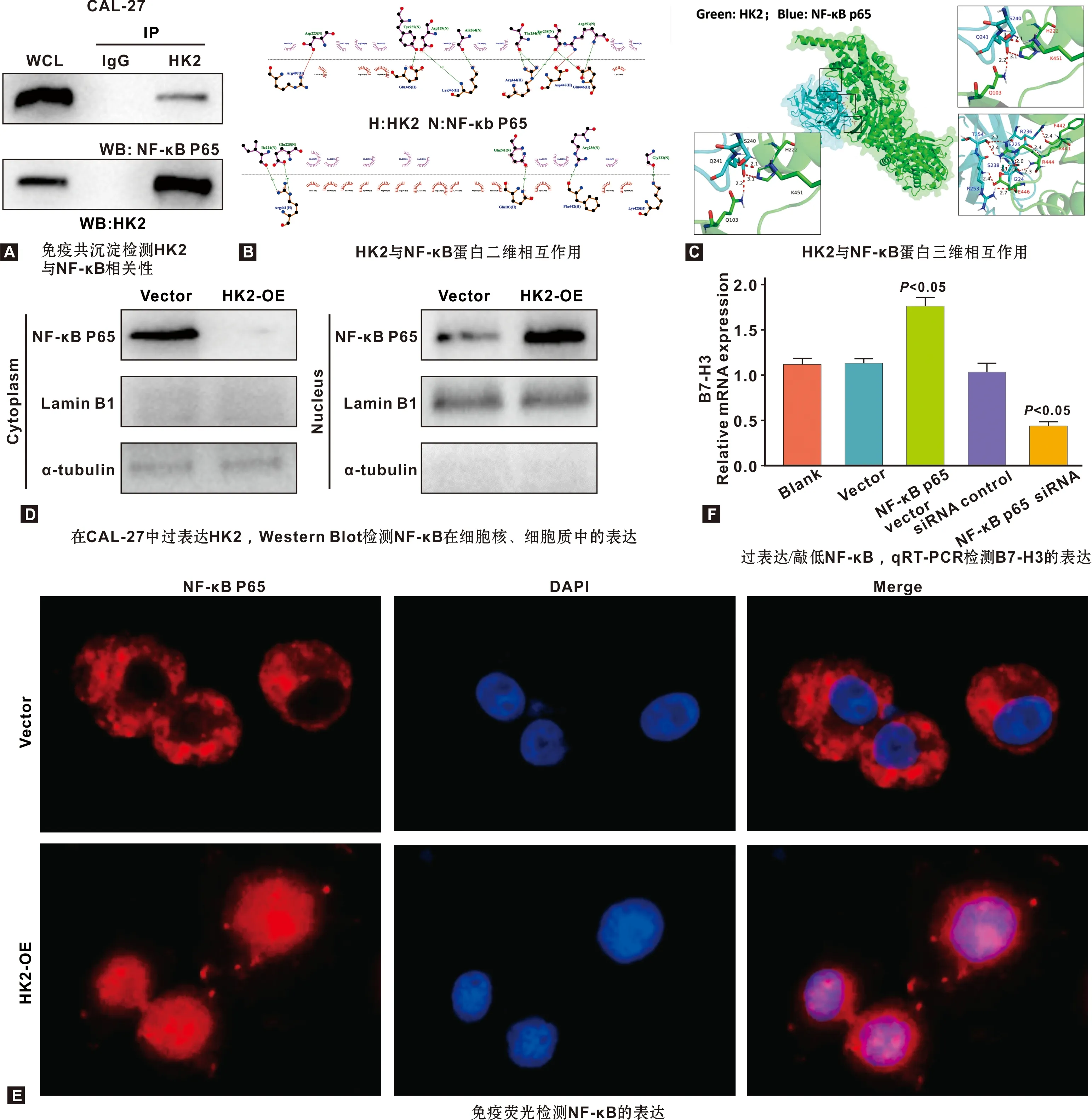
图2 HK2诱导NF-κB核转位导致B7-H3表达上调
3 讨 论
口腔鳞癌是口腔颌面部最常见的恶性肿瘤之一[20],绝大部分临床首诊患者已为局部晚期(TNM 临床分期Ⅲ、Ⅳ期),5 年生存率仅50%~60%,预后较差。外科切除辅助放化疗为目前口腔鳞癌常规治疗手段,但患者的功能恢复与远期预后仍差强人意。近年来,免疫治疗逐渐成为肿瘤治疗的创新方案。目前针对CTLA-4 和PD-1/PD-L1 通路的阻断抗体也已经被广泛应用[11],部分患者取得了显著疗效,但仍有大量患者对免疫检查点的响应率低,往往不足20%。因此,找到新的免疫逃逸关键分子并明确其免疫调控机制,对提高患者生存质量,改善患者预后具有重要的临床意义。
B7-H3又称为CD276,是重要的新型免疫检查点分子。众多研究表明,B7-H3 在多种肿瘤中高表达,导致患者预后不良和临床转归差。目前,临床靶向B7-H3 的药物已达数十款,方向涉及CAR-T 细胞疗法、ADC和单双抗等[21],部分结果显示出有希望的早期临床活性,展现出巨大的临床应用前景。研究表明,口腔鳞癌细胞B7-H3 通过抑制CD8+T 细胞活性实现免疫逃逸[22]。然而,B7-H3 具体表达调控机制以及介导免疫逃逸的具体途径仍不明确。
肿瘤细胞生长在营养水平波动的肿瘤微环境中,大多数肿瘤细胞通过糖酵解作用为自身供能,即使在氧气充足的条件下也会发生,称为“Warburg 效应”[23]。研究表明,高糖酵解水平的肿瘤对于免疫检查点抑制剂的治疗获益相对有限[24-25],肿瘤高水平的糖酵解活动调控免疫逃逸进程。最新研究表明,葡萄糖经糖酵解诱导脑胶质瘤细胞PD-L1 表达上调来调控免疫逃逸。但B7-H3 作为新型免疫检查点分子[26],在口腔鳞癌中的表达是否受糖酵解途径调控目前未见报道。该研究发现,合并2 型糖尿病的口腔鳞癌患者预后极差,并且在该类患者的肿瘤样本中发现B7-H3 显著高表达。接下来发现,无论是缺氧还是常氧,B7-H3的表达都随葡萄糖浓度的提高而增加,而转录抑制剂能抑制该作用,表明葡萄糖经糖酵解在转录水平调节OSCC细胞B7-H3表达。大量研究证实,己糖激酶 2(hexokinase 2,HK2)与肿瘤预后、转移密切相关[27-29]。接下来敲低OSCC细胞的HK2,发现即使给予葡萄糖或6-磷酸葡萄糖(Glucose-6-phosphate,G-6-P)刺激,B7-H3表达依旧减少,表明HK2是葡萄糖诱导B7-H3表达的关键。研究表明,高糖酵解产生的G-6-P与HK2结合并可能诱导构象变化促进HK2从VDAC和线粒体外膜分离,以应对环境和代谢应激[30]。通过CO-IP及分子对接等实验,发现HK2可导致NF-κB发生核转位,NF-κB作为转录因子可上调肿瘤细胞B7-H3的表达。故糖酵解关键酶HK2将葡萄糖转化为G-6-P,高糖酵解产生的G-6-P与HK2结合促使HK2从线粒体外膜分离,HK2使NF-κB发生核转位,从而促进OSCC细胞中B7-H3高表达。
综上所述,高糖微环境可以增加CAL-27 细胞中B7-H3的表达,作用机制为以HK2依赖的方式诱导NF-κB核转位导致人口腔鳞癌细胞CAL-27中B7-H3的表达上调。本研究初步探讨了高糖微环境介导口腔鳞癌免疫逃逸的新机制,将为改善口腔鳞癌患者的生存质量,提升生存率,提高免疫治疗疗效提供重要实验依据。
