蓝斑NE能神经元在束缚应激致小鼠咬肌紧张度升高中的作用
2023-11-27刘杨李强陈永进赵雅娟
刘杨 李强 陈永进 赵雅娟
口颌肌肌肉痛是颞下颌关节紊乱病(temporomandibular disorders,TMD)最常见的临床分类,在TMD患者中的发生率约为80%,严重影响患者的正常生活[1-2]。据报道,存在口颌肌肌肉痛的TMD患者往往比正常人群有更高的焦虑或抑郁水平[3-4];受到慢性心理应激的人群更易出现口颌肌的紧张与疲劳,引发或加重肌肉与颞下颌关节的疼痛[5-6]。因此,应激导致的口颌肌紧张度升高与肌疲劳被认为是TMD口颌肌肌肉痛表现的重要诱发因素。
肌电活动变化是评价口颌肌功能状态、评估TMD的发展与治疗效果中重要检测指标[7-8]。临床研究显示,TMD患者咬肌肌电水平明显高于正常人群[9-10];动物实验研究亦证实,心理应激状态下的实验动物会出现焦虑样行为,并且其咬肌会出现紧张度升高以及能量代谢异常[11-12]。
位于脑干的蓝斑(locus coeruleus,LC) 与机体的应激反应密切相关[13]。LC内神经元类型主要为去甲肾上腺素(noradrenaline,NE)能神经元,其合成并分泌的神经递质NE在应激相关的行为变化、情绪、以及认知等方面发挥重要调控作用[14-15]。在解剖结构上,LC与调节口颌肌运动的重要核团三叉神经中脑核(Mesencephalic trigeminal nucleus,Vme)不仅位置相临近,同时LC还发出神经投射至Vme,调控Vme神经元的兴奋性[16]。研究证实,应激可导致Vme神经元兴奋性升高,并与应激后咬肌紧张度升高密切相关[17],然而,肌紧张度升高是否是由于LC神经元被激活,进而通过神经通路投射至Vme所致,仍需进一步探究。
本研究拟采用经典的束缚应激建立动物模型,观察小鼠应激状态下的行为学改变与清醒状态下咬肌肌电水平的变化,同时检测LC神经元的激活情况,采用化学遗传学技术特异性地抑制LC内NE能神经元的激活,探究LC在心理应激诱发口颌肌紧张度升高中的调控作用,为深入研究“应激-中枢神经-外周神经-口颌肌的全传递调控通路”在TMD发病中的作用和机理提供实验及理论依据。
1 材料与方法
1.1 实验动物
本研究共使用SPF级雄性C57BL/6小鼠40 只(6~8 周龄),由空军军医大学实验动物中心提供[许可证号:SCXK(陕)2019-001]。饲养环境温度(25±1) ℃,湿度(50±5)%,12 h光/暗循环,随意进食饮水。所有动物实验经过空军军医大学第三附属医院伦理委员会批准(批准号:K9-2022-020)。
1.2 主要实验设备与试剂
自制束缚器;高架十字迷宫系统(RD1208-EP,上海移数公司);定制肌电采集电极(苏州科斗脑机科技有限公司);MP46型生理记录仪(BIOPAC,美国);立体定位注射仪(68025,深圳瑞沃德),微量进样器(平头1 μL,上海沪鸽);冰冻切片机(Leica CM1800,Leica,德国);FV1000激光共聚焦显微镜(Olympus,日本);病毒载体rAAV-TH-hM4D(Gi)-mCherry-WPRE-hGH pA(武汉枢密);叠氮平-n-氧化物(clozapine-n-oxide,CNO)(Sigma,美国);小鼠抗Fos(Abcam,英国);兔抗-TH(Millipore,美国);A594 驴抗小鼠IgG、A647 驴抗兔IgG(Thermo Fisher Scientific,美国)。
1.3 小鼠束缚应激动物模型的建立
本研究采用的束缚应激动物模型参照相关文献[17],将应激组小鼠置于管壁带有数个通气孔的50 mL离心管中;每日早上8:00开始连续束缚4 h,1 次/d,共束缚14 d。在给予束缚应激的过程中,小鼠禁食禁水。对照组小鼠正常饲养。
本研究共分两部分实验。第一部分:将16 只小鼠随机分为对照组与应激组(n=8),研究束缚应激是否能够导致小鼠出现行为学改变、咬肌紧张度升高,同时观察LC内神经元的激活情况。第二部分:将24 只小鼠随机分为对照+溶剂组、应激+溶剂组和应激+CNO组(n=8),采用化学遗传学技术抑制LC内NE能神经元的激活,再次观察束缚应激后小鼠的行为学变化与咬肌的紧张度。
1.4 行为学测试
采用高架十字迷宫(elevated plus maze text,EPM)实验检测动物的焦虑水平[18]。EPM距离地面50 cm,由2 个相对的开放臂、2 个相对的闭合臂以及中央活动区域组成。实验开始时,将小鼠放置在中央区域,任其自由活动5 min,通过摄像头记录其活动情况。通过自动分析系统,得出各组小鼠进入开臂次数百分比和开臂滞留时间百分比,作为评估焦虑水平的参数。
1.5 咬肌肌电水平检测
采用定制电极采集小鼠咬肌肌电位(electromyography,EMG)水平。使用绝缘软导线(长2.5 cm,直径0.5 mm),一端焊接一根2 mm长的不锈钢金属微针(直径0.15 mm),另一端焊接于2×3的圆孔排母接口,排母上焊接一根银丝做地线。实验开始前,参照文献[19]将电极提前置于小鼠左侧咬肌。腹腔注射戊巴比妥钠麻醉后(35 mg/kg),在小鼠左侧面颊及颅顶部备皮、消毒。切开左侧下颌与颅顶皮肤,将电极微针插入左侧咬肌肌腹并缝合固定,缝合面颊皮肤。将绝缘导线经耳后及颅顶皮下走行,于颅顶切口处穿出,将排母接口端用牙科自凝塑料固定于颅顶骨上,再次对术区进行消毒。
术后恢复1 周后开始进行实验。束缚应激结束后,采集各组小鼠在清醒状态下的咬肌肌电活动水平。采集方法:采用连接线将小鼠颅顶排母接口与MP46型2导生理记录仪相连,置于饲养笼内适应30 min,使用AcqKnowledge软件(Biopac公司,美国)采集小鼠清醒状态下咬肌肌电信号(每只小鼠采集30 min),并对数据进行统计分析,得到每只小鼠咬肌的累积肌电(integral EMG,iEMG)及振幅均方根(root mean square,RMS)。
1.6 免疫组织荧光染色
采用NE能神经元的特异性标记物——酪氨酸羟化酶(tyrosine hydroxylase,TH)来标记LC神经元;采用即刻早期基因fos的表达产物——Fos蛋白标记被激活的神经元;通过免疫荧光双重染色观察LC内Fos阳性神经元的数量,评估应激后LC神经元激活情况。
戊巴比妥钠腹腔注射深度麻醉后(60 mg/kg),小鼠经心脏灌流100 mL 0.01 mol/L磷酸盐缓冲液(PBS,pH 7.4),以及200 mL 4%多聚甲醛进行灌注固定,取出脑组织进行后固定及蔗糖脱水。根据小鼠脑立体定位图谱[20],修整脑组织块至LC(Bregma尾侧5.34~5.68 mm)部位,冰冻切片(厚30 μm),0.01 mol/L PBS漂洗,10%驴血清室温孵育30 min,加入一抗(小鼠抗Fos,1∶500;兔抗-TH,1∶500)孵育过夜,0.01 mol/L PBS漂洗,加入二抗(A594 驴抗小鼠IgG,1∶500;A647 驴抗兔IgG,1∶500),避光孵育4 h,0.01 mol/L PBS漂洗,裱片,室温晾干,荧光封片。激光共聚焦显微镜下观察拍照,采用Image-Pro Plus 图像分析系统计算各组LC核团内Fos阳性神经元的数量。
1.7 化学遗传学实验
小鼠腹腔注射戊巴比妥钠(35 mg/kg)麻醉,头部备皮并采用碘伏消毒后,固定于立体定位仪上,沿头部正中矢状位剪开皮肤1~2 cm,充分暴露颅骨。根据小鼠脑图谱[20]定位LC(前囟尾端5.50 mm,中线外侧0.90 mm,脑表面向下3.90 mm),按上述坐标在颅骨钻孔,将携带有TH启动子以及抑制性G蛋白受体基因hM4D(Gi)的腺病毒载体rAAV-TH-hM4D(Gi)-mCherry-WPRE-hGH pA(2.0E+12 vg/mL)置于微量注射器内,定位注射于LC区域(注射量0.05 μL)。术后1 周,将肌电电极埋置于左侧咬肌,再恢复1 周后进行分组与实验。待应激结束后,各组小鼠腹腔注射药物CNO或溶剂,给药30~40 min之后进行行为学与咬肌肌电水平的检测。之后对小鼠进行灌注取材,切片验证病毒转染效果。
1.8 统计学分析
2 结 果
2.1 束缚应激可导致小鼠焦虑样行为与咬肌肌电活动水平增强
小鼠行为学结果如图1。应激组小鼠在高架十字迷宫的活动中,其进入开臂次数百分比、滞留开臂时间的百分比显著低于对照组(P=0.0083,P=0.0010),提示束缚应激可导致小鼠焦虑样行为。
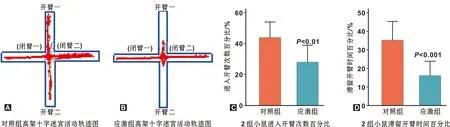
图1 小鼠慢性束缚应激后行为学检测结果
小鼠咬肌肌电水平结果如图2。在受到14 d束缚应激后,应激组小鼠咬肌肌电的iEMG与RMS水平均显著高于对照组(P=0.0002,P=0.0002),提示束缚应激可导致小鼠咬肌紧张度升高。
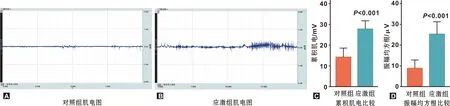
图2 小鼠慢性束缚应激后咬肌肌电水平检测结果
2.2 束缚应激后蓝斑神经元显著激活
两组小鼠Fos表达结果如图3。蓝色荧光显示为TH阳性神经元,作为LC的位置标记。红色荧光显示为Fos阳性神经元细胞核。在LC核团范围内进行Fos阳性神经元计数结果显示,应激组LC部位的Fos阳性神经元数量显著高于对照组(P=0.0003),提示束缚应激可致LC神经元显著激活。
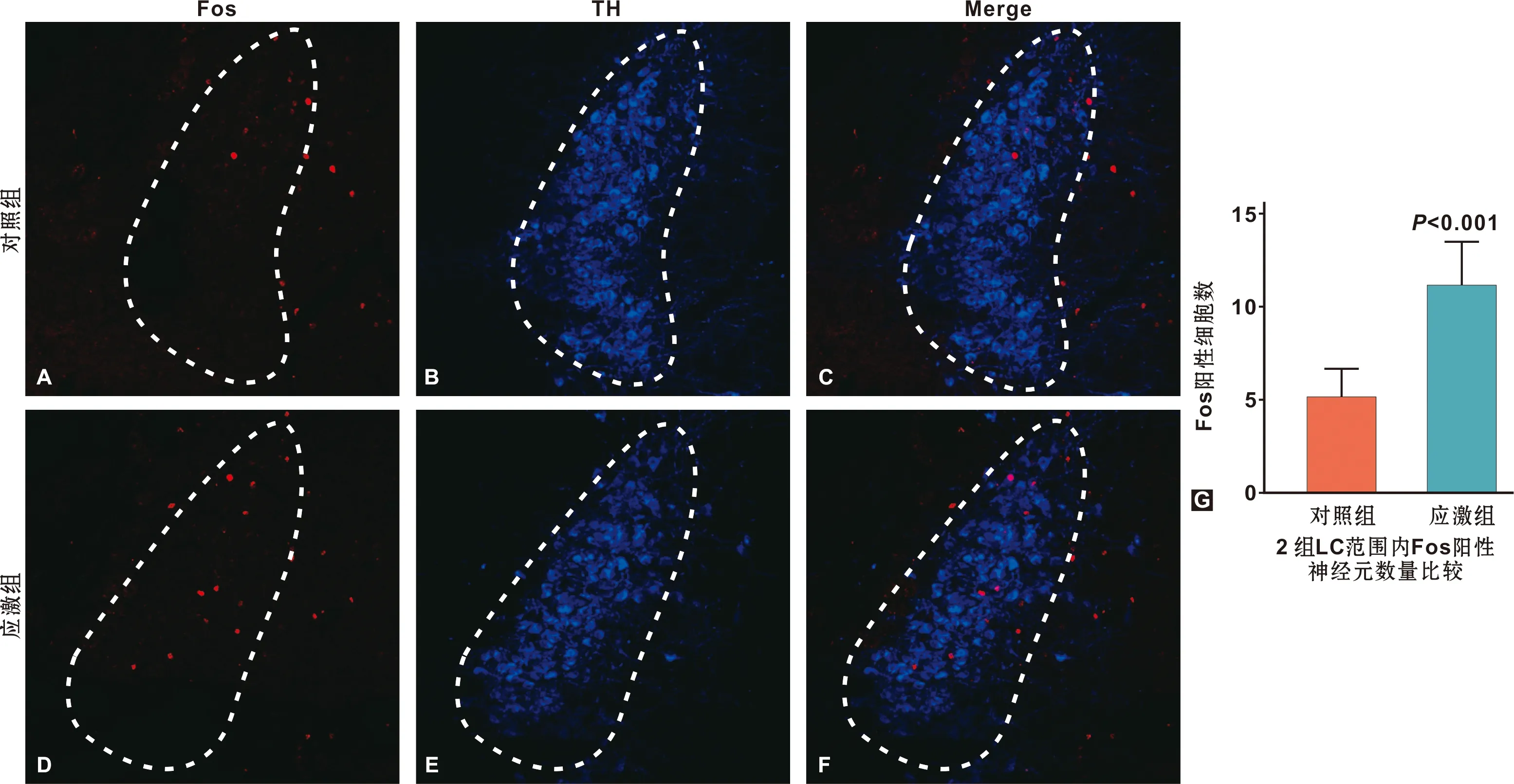
图3 慢性束缚应激后小鼠LC内Fos染色结果
2.3 特异性抑制蓝斑内NE能神经元活动可缓解束缚应激导致的焦虑行为与咬肌肌电水平
为了进一步验证LC在束缚应激致咬肌肌电水平增高过程中的作用,采用化学遗传学技术特异性抑制LC内NE能神经元的激活(图4)。实验结束后组织切片结果显示,带有红色荧光的病毒载体成功转染至LC神经元胞体内(图4B~C),确保了给予CNO后能够有效抑制LC内NE能神经元的激活。
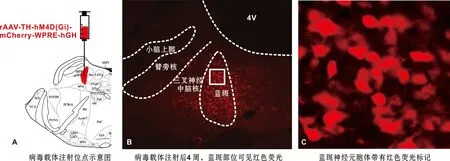
图4 用于化学遗传学的病毒载体转染结果
行为学结果显示(图5),应激+溶剂组小鼠在高架十字迷宫中进入开臂次数百分比、滞留开臂时间的百分比低于对照+溶剂组(P=0.0007,P=0.0008),应激+CNO组小鼠高架十字迷宫中进入开臂次数百分比、滞留开臂时间的百分比高于应激+溶剂组(P=0.0218,P=0.0131)。肌电结果显示(图6),应激+溶剂组小鼠咬肌肌电的iEMG与RMS水平高于对照+溶剂组(P=0.0003,P=0.0002),应激+CNO组小鼠咬肌肌电的iEMG与RMS水平低于应激+溶剂组(P=0.0078,P=0.0248)。表明抑制蓝斑内NE能神经元的激活可缓解束缚应激导致的焦虑行为与咬肌紧张度升高。
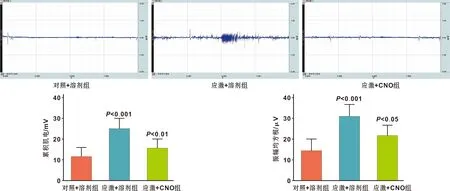
图6 化学遗传学给药后各组小鼠咬肌肌电水平检测结果
3 讨 论
越来越多的研究认为,心理应激是TMD发生与发展的重要危险因素[3-6,21]。中枢神经系统是机体应激反应的重要部分,探究心理应激如何通过中枢神经通路的调控,影响TMD的发生发展,对深入理解二者密切相关的中枢层面原因、并寻求更有针对性的治疗具有重要的意义。通过动物应激模型是研究心理因素与TMD的关系,探讨其发生发展机制的常用方法。本研究采用小鼠建立心理应激动物模型,实验中采用的束缚应激方式因其操作方便、重复性好等优点,在有关心理应激相关的研究中被广泛采用[17,22]。连续14 d、4 h/d的慢性束缚应激构建心理应激动物模型,观察到小鼠在高架十字迷宫中进入开放臂的次数与时间显著降低,表明慢性束缚应激可成功诱导小鼠出现焦虑样情绪,与以往的研究结果相一致[18,22]。
临床研究表明,焦虑情绪与口颌肌的紧张度的关系可能是加重TMD症状的重要原因[5-6]。本研究进一步检测了小鼠受到应激后咬肌的肌电活动水平。以往研究中,实验动物由于难以配合,多采用麻醉状态下记录肌电活动,限制了实验结果的参考价值。本课题组根据小鼠口颌部解剖特点,参照相关文献[17],定制了植入式针式电极,将其植入小鼠的咬肌内,并在颅骨部位进行固定,可在小鼠清醒并自由活动的状态下,进行长时间咬肌肌电的采集。结果发现,慢性束缚应激可引起咬肌肌电水平的显著升高。咬肌是颌面部最重要的一对口颌肌,其运动由中枢内三叉神经运动核(trigeminal motor nucleus,Vmo)支配,Vme调控咬肌的本体觉传入,并向Vmo发出谷氨酸能投射。本课题组前期的研究证实,慢性束缚应激可导致Vme神经元兴奋性升高,Vme-Vmo谷氨酸能投射增强,并与应激导致的肌紧张度升高有关[17]。然而,应激后Vme神经元的兴奋性增加是否是由于受到了中枢内应激相关核团的投射影响所致,仍需进一步探究。
紧邻Vme内侧的LC作为大脑的应激相关中枢之一,被认为与注意、唤醒、记忆等生理功能密切相关,并介导了压力性应激反应[13-15]。LC中的NE能神经元是大脑内合成NE的主要部位,与应激反应密切相关,许多精神疾病诸如焦虑症、抑郁症都存在LC内NE能系统的失调[23-24]。本研究为证实束缚应激是否能够引起LC神经元的直接激活,检测了LC内即刻早期基因c-fos的表达产物Fos蛋白的表达水平[25]。TH是细胞合成NE过程中的关键酶,用TH来标记蓝斑神经元[26],结果发现,小鼠受到14 d应激后,可观察到应激组在TH阳性神经元的范围内,Fos阳性细胞的数量明显多于对照组,说明束缚应激可导致LC神经元的显著激活。由于LC紧邻Vme,且已有文献证实,LC直接向Vme发出神经投射,调控Vme神经元的兴奋性变化[16]。因此推测,应激后LC神经元激活,并通过向Vme的神经投射使得Vme神经元兴奋性升高,从而导致咬肌的紧张度升高。为验证以上假说,进一步采用了化学遗传学的方法,探究应激后LC神经元的激活是否与咬肌紧张度的升高有关。
化学遗传学的核心技术是使用可被特定药物来激活的特定人工设计的受体(designer receptors exclusively activated by designer drugs,DREADDs),从而对神经细胞群或神经环路的活性进行特异性的控制[27]。在神经科学研究中,最常用的两种DREADDs包括可激活神经元放电的hM3Dq和可抑制神经元放电的hM4D(Gi)。DREADDs可被生物惰性配体CNO高选择性地激活,且对其余中枢靶点缺乏亲和力[28]。以DREADDs加上CNO定向激活的化学遗传学方法为最小侵入性、特异性调控神经元活性的研究提供了有力的技术支撑。本研究由于应激后LC神经元出现激活,故选用了抑制性DREADDs hM4D(Gi)。为了使其能够特异性的抑制LC神经元,又添加了TH启动子,并使用腺病毒载体辅助将构建的DREADDs定位注射入LC。在应激结束后,给予每组动物腹腔注射CNO或溶剂,结果显示,应激+溶剂组小鼠相比对照+溶剂组出现了显著的焦虑样改变,而给予CNO后,其焦虑水平又显著降低;另一方面,应激+溶剂组小鼠的咬肌肌电水平显著高于对照+溶剂组,而给予CNO后,咬肌肌电水平又显著下降。这进一步证明,LC内NE能神经元的激活是束缚应激导致的焦虑行为以及咬肌紧张度升高的重要原因。有文献报道,Vme神经元细胞膜含有α2A-肾上腺素能受体,并可被来自LC的NE能神经投射所激活,继而导致其神经元电生理特性发生改变[29]。因此,通过LC-Vme神经通路的作用,LC将神经元激活信息传递至Vme,继而影响口颌肌的运动状态,很可能是LC内NE能神经元参与调控应激导致咬肌紧张度升高的中枢机制之一。
综上所述,慢性束缚应激能够造成小鼠的焦虑样情绪改变,且咬肌的肌紧张度升高;而应激后LC内NE能神经元的激活可能是应激导致焦虑样行为与咬肌紧张度升高的中枢调控机制之一。
