肥胖及牙周炎对大鼠两种间充质干细胞成骨能力的影响
2023-11-27于寰董庭妍康健
于寰 董庭妍 康健
近年来,研究发现多种间充质干细胞(mesenchymal stem cells,MSCs)可以增强牙周再生和骨再生[1-5]。MSCs具有高度的自我更新和多向分化潜能,这种多向分化能力受多种细胞因子复杂调控。研究表明炎症环境有可能通过改变干细胞微环境的平衡及干细胞内源性信号的调控作用从而抑制干细胞的再生能力[6-8],这必然会影响组织工程学应用于牙周再生和骨再生的效果。
有证据表明高热量饮食摄入会导致超重或肥胖,使机体处于慢性低度炎症状态(low-grade inflammatory states),导致代谢综合征或其他慢性疾病的发生[9]。肥胖对在组织器官缺损修复中起重要作用的干细胞可能存在重大影响[10]。但肥胖对不同来源的干细胞究竟存在何种影响,其内在机制如何,该领域仍缺乏研究。牙周炎作为一种感染性炎症性疾病,也会对干细胞的增殖及分化能力产生影响。MSCs最终将植入存在牙周炎症的牙周缺损区,这也可能造成干细胞治疗再生效果不佳。本研究选取大鼠骨髓间充质干细胞(bone marrow stem cells,BMSCs)及牙髓间充质干细胞(dental pulp stem cells,DPSCs),检测肥胖及牙周炎状态下干细胞增殖、矿化及成骨能力的变化。
1 材料与方法
1.1 主要试剂
DMEM培养基、胎牛血清、胰蛋白酶、I型胶原酶、琼脂糖凝胶(GIBCO,美国);Dispase(Thermo Forma,美国);地塞米松、β-甘油磷酸钠、维生素C、茜素红、MTT、DEPC(Sigma,美国);ALP检测试剂盒(上海碧云天生物);青霉素、链霉素(Genview,美国);肝素钠、Percoll分离液(北京Solarbio);GAPDH一抗(杭州三鹰);ON、OCN、OPN二抗(Abcam,英国);引物(苏州金唯智);EB(Ethidium Bromide)(北京鼎国);TrizolReagent(Invitrogen,美国);M-mlV逆转录酶、RNA酶抑制剂、dNTP(10 mmol/L)、SYBR Premix Ex Taq试剂盒(Takara,日本);Bio-Oss Collagen(Geistlich,瑞士);DFDBA(山西奥瑞)。
1.2 大鼠肥胖及牙周病模型的建立
20 只4~5 周龄体重约200 g的雄性SD大鼠随机分为牙周健康正常体重组(C组)、牙周健康肥胖组(OB组)、牙周炎正常体重组(PD组)、肥胖牙周炎组(PD+OB组)。
正常体重组大鼠(C组及PD组)饲喂基础饲料,肥胖组(OB组及PD+OB组)大鼠饲喂高脂饲料(基础饲料60%,添加10%蔗糖、20%猪油、10%蛋黄粉)。每周监测大鼠体重。高脂饲养组体重大于对照组20%以上则建模成功。
实验开始第 7 周初,牙周炎组(PD组及PD+OB组)用磨砂纸处理后的 0.2 mm 正畸钢丝环扎大鼠双侧上颌第一磨牙牙颈部。抽取 1 mL 1.5×109CFU/mL 的P.gingivalis菌悬液在双侧上颌第一磨牙的龈沟内接种细菌。每 48 h接种1 次,共接种3 次。以20 mg/只/d的剂量喂饲阿莫西林3 d。从大鼠上颌第一磨牙结扎钢丝完成后起计算,建模时间共计4 周。
10 周后处死实验动物,方块截取包括上颌骨研究区域第一磨牙在内的骨组织块完整标本。生理盐水冲洗,4%多聚甲醛固定,组织块逐级酒精脱水,二次包埋法石蜡包埋。方向沿牙体长轴颊舌向切成厚度为4 μm的组织切片。HE染色,光镜下观察牙周组织变化。观察牙周炎组组织学存在附着丧失、牙槽骨吸收及炎症细胞浸润认定为牙周炎模型建立成功。
1.3 原代干细胞培养及鉴定
1.3.1 大鼠DPSCs 取大鼠双侧上颌第一磨牙无菌牙髓,0.3% I型胶原酶和0.4% dispase酶(1∶1)消化1 h,加入含双抗的20%胎牛血清DMEM培养液,以1×104~1×105/cm2密度接种培养。于37 ℃,体积分数为0.05的CO2饱和湿度的培养箱中培养。每3 d倒置显微镜下观察细胞形态及生长情况并换液。至细胞达到80%汇合率时,换用成骨向定向诱导培养液培养。成骨向定向诱导培养液配制:10%胎牛血清,1%青霉素及2.5 μg/mL链霉素的DMEM培养基,加入地塞米松(0.1 μmol/L)、β-甘油磷酸钠(10 mmol/L)、维生素C(50 mg/L)。
1.3.2 大鼠BMSCs 取大鼠双侧坐骨棘处骨髓液2 mL,吹打5 min。 1 000 r/min离心10 min制成细胞悬液,加入至2 倍体积1.073 g/mL的Percoll分离液上层,2 000 r/min离心25 min,收集中有核细胞层,加入含双抗的20%胎牛血清DMEM培养液,以1×104/cm2密度接种培养。于37 ℃,体积分数为0.05的CO2饱和湿度的培养箱中培养。每2 d倒置显微镜下观察细胞形态及生长情况并换液。至细胞达到80%汇合率时,换用成骨向定向诱导培养液培养。
1.3.3 干细胞鉴定 对数生长期的DPSCs和BMSCs使用Vimentin及CK-14标记,荧光染色。
1.4 MTT法细胞活性检测
三联溶解液配制:SDS 10 g,异丁醇5 mL,10 mmol/L 氯化氢 0.1 mL 用双蒸水溶解配成100 mL溶液。于成骨定向培养的1、 3、 5、 7、 9 d取两种细胞裂解后加入10 μL 5 mg/mL MTT溶液,4 h后再加入100 μL溶解液,继续孵育4~6 h,镜下观察结晶全部溶解后在酶联免疫检测仪测量A570 nm。
1.5 ALP水平定量检测
于成骨定向培养的7、 14、 21 d取2 种细胞裂解后按ALP检测试剂盒说明进行加样操作。用酶联免疫检测仪(BIO-RAD,美国)测量检测A405 nm,计算ALP。
1.6 茜素红染色检测
1.44 g茜素红溶解至90 mL的超纯水,调整pH值为4.2,定容至100 mL,配制成40 mmol/L的茜素红溶液。于成骨定向培养的7、 14、 21 d取两种细胞裂解后,PBS清洗,70%冰乙醇固定1 h。室温下加入1 mL 40 mmol/L茜素红溶液避光染色10 min。镜下观察红色矿化结节着染情况。
1.7 Western blot蛋白水平检测
于成骨定向培养的7、 14、 21 d取2 种细胞裂解,提取胞质蛋白及核蛋白。与SDS-PAGE缓冲液混匀,煮沸变性5 min,冰浴5 min。顺序加样后电泳。湿法将蛋白转至硝酸纤维素膜,350 mA转膜2 h后封闭。孵育一抗(Runx2,OPN,OCN)和二抗(IgG),β-肌动蛋白(β-actin)作为上样量对照。化学发光法发光并收集条带,用LabWorksTM凝胶成像及分析系统(UVP,美国)分析各组条带亮度值。
1.8 Real-time PCR基因水平检测
于成骨定向培养的7、 14、 21 d取2 种细胞裂解,提取总RNA。在逆转录试剂盒中根据说明加入1 μg总RNA及其他试剂合成cDNA。按试剂盒说明书配置反应液。使用Real-time PCR仪器(iQ5,Applied Biosystems,美国)进行实时定量PCR。进行成骨标志蛋白Runx2、OPN、OCN mRNA水平检测。引物序列见表1。

表1 Real-time PCR引物序列
1.9 统计学分析

2 结 果
2.1 模型建立确认及牙周组织形态学结果
10 周后,2 只大鼠(分别为OB组和PD组)死亡。剩余高脂饲养组与对照组大鼠各9 只。其中,高脂饲养组(OB组及PD+OB组)大鼠体重为(612.22±40.11) g,正常饲养组(C组及PD组)大鼠体重为(480.44±56.62) g(P<0.01)。高脂饲养组大鼠体重均大于正常饲养组大鼠平均体重20%以上。
组织学HE染色结果显示牙周炎组(PD组及PD+OB组)存在炎症细胞浸润,结合上皮根向移位及牙槽嵴吸收。牙周健康组(C组及OB组)可能存在炎症细胞浸润,但无附着丧失及牙槽嵴吸收。具体形态如下:C组:结合上皮紧密附着于牙颈部釉牙骨质界处,牙周韧带纤维排列有序、整齐,牙槽嵴顶无吸收(图1)。PD组:结合上皮与牙体分离并向根方增殖加深牙周袋,固有层可见炎细胞浸润,牙周韧带纤维排列紊乱,牙槽嵴顶高度降低(图1)。OB组:结合上皮与牙体分离,未向根方增殖,牙槽嵴顶无明显吸收见图1。PD+OB组:结合上皮与牙体分离并向根方增殖,固有层有炎症细胞浸润,牙槽骨高度降低(图1)。

图1 各组大鼠牙周组织(HE,×100)
2.2 大鼠DPSCs及BMSCs生长情况
干细胞鉴定结果如图2。倒置显微镜下细胞生长情况如图3,各组DPSCs多数细胞为长梭形成纤维状细胞,少数为多角形或不规则形。C组DPSCs的细胞形态呈多角形,细胞间无明显粘连,细胞汇合度较低,PD组DPSCs细胞汇合度高于OB组,PD+OB组DPSCs的细胞汇合度较其他3 组增加。
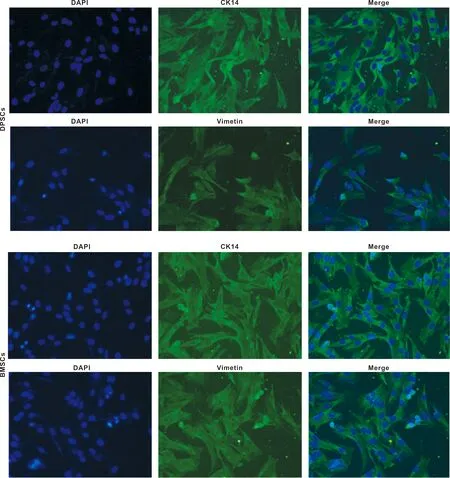
图2 大鼠DPSCs、 BMSCs干细胞鉴定(×200)
各组BMSCs传至第3 代BMSCs纯度较高,呈漩涡状生长。C组BMSCs细胞形态呈星网状,细胞间无明显粘连,细胞汇合度较低,OB组BMSCs的细胞汇合度高于PB组,PD+OB组BMSCs细胞汇合度较其他3 组增加。
细胞增殖活性检测(MTT法)结果显示:各组干细胞生长曲线均成“S”型(图4)。第3 天开始,各组干细胞增殖加快,处于对数生长期,第7 天达到顶峰。到第9 天,两种干细胞C组细胞增殖速度平缓,增殖进入平稳期,其余3 组均出现细胞增殖活性的减低。对于大鼠DPSCs,C组、OB组、PD组、PD+OB组增殖速度依次增加(图4A)。第3 天PD+OB组DPSCs细胞增殖活性(A值)高于其他3 组(P<0.05),而第5、 7、 9 天显著高于其他3 组(P<0.01)。且第5、 7、 9 天的DPSCs细胞增殖活性显著高于OB组(P<0.01)。对于鼠BMSCs,C组、PD组、OB组、PD+OB组增殖速度依次增加(图4B)。第5、 7 天PD+OB组细胞增殖活性(A值)显著高于其他3 组(P<0.01),且OB组的BMSCs细胞增殖活性高于PD组(P<0.05)。
碱性磷酸酶(ALP)相对活性检测结果显示:随着诱导时间的增加,各组ALP相对活性均显著性增加,但均低于C组ALP相对活性。鼠DPSCs各组ALP相对活性值由高到低为C组、OB组、PD组、PD+OB组;鼠BMSCs各组ALP相对活性值由高到低为C组、PD组、OB组、PD+OB组(图5)。在第14、 21 天,PD+OB组的两种干细胞ALP值均显著低于其他3 组(P<0.01)(图5A~5B)。此外,PD组DPSCs的细胞的ALP值显著低于OB组(P<0.01)(图5A),OB组BMSCs的细胞ALP值显著低于PD组(P<0.01)(图5B)。
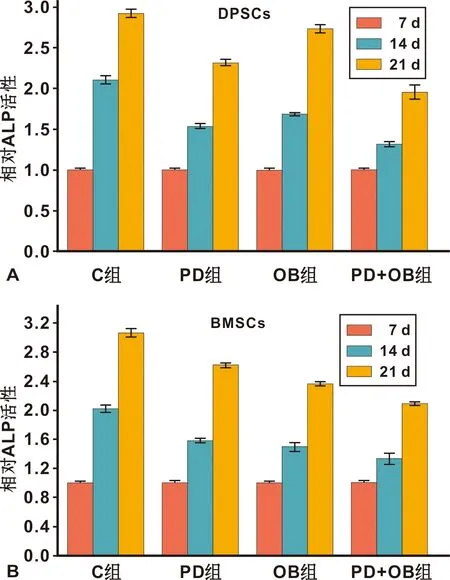
图5 大鼠DPSCs、BMSCs骨向诱导后ALP活性检测结果
2.3 体外诱导大鼠牙髓间充质干细胞及骨髓间充质干细胞矿化及成骨向分化情况
茜素红染色结果显示:倒置显微镜可见诱导液诱导7 d时进行茜素红染色,发现各组细胞没有明显的矿化结节形成;诱导14 d时进行茜素红染色,发现各组细胞均有明显的矿化结节形成,差异不显著;诱导至21 d时,矿化结节显著增加。对于DPSCs,矿化结节明显程度由高至低依次为C组、OB组、PD组、PD+OB组(图6A)。对于BMSCs,矿化结节明显程度由高至低依次为C组、PD组、OB组、PD+OB组(图6B)。
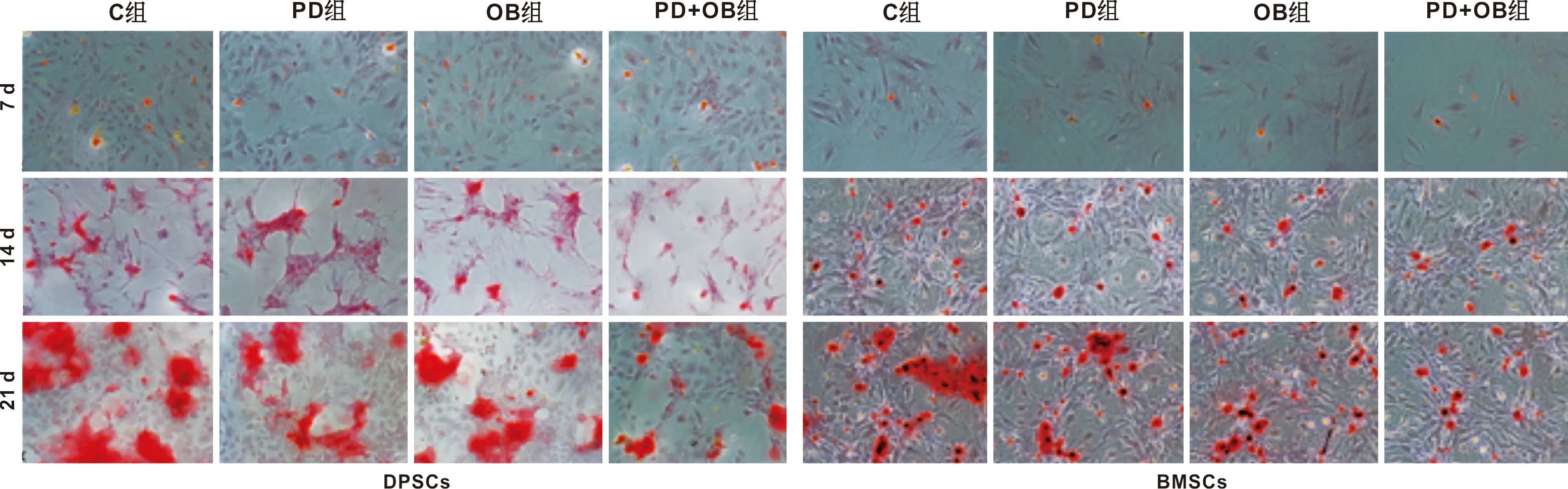
图6 大鼠DPSCs、BMSCs骨向诱导后茜素红染色结果(×200)
体外诱导成骨向分化蛋白检测结果显示:两种干细胞各组Runx2、 OPN、 OCN的蛋白及mRNA随着诱导时间的增加,蛋白相对表达量逐渐升高,各干细胞组内相比Runx2的蛋白及mRNA相对表达量均最高,其次为OCN,最低的为OPN。对于DPSCs,3 种蛋白及mRNA相对表达量由高到低依次为C组、OB组、PD组、PD+OB组。在骨向诱导培养的第7、 14、 21 天,PD+OB组的3 种蛋白及mRNA相对表达量均显著低于其他3 组(P<0.01)。第7 天OB组BMSCs的细胞蛋白及mRNA相对表达量显著高于PD组(P<0.01)。对于BMSCs,3 种蛋白及mRNA相对表达量由高到低依次为C组、PD组、OB组、PD+OB组。在骨向诱导培养的第7、 14、 21 天,PD+OB组的3 种蛋白及mRNA相对表达量均显著低于其他3 组(P<0.01)(图7)。 第7天PD组BMSCs的细胞蛋白及mRNA的相对表达量显著高于OB组(P<0.05)。

图7 大鼠DPSCs、 BMSCs骨向诱导后Runx2、 OCN、 OPN相对蛋白及mRNA表达水平
3 讨 论
牙周治疗的终极目标是达到牙周再生。美国牙周病学学会(AAP)将牙周再生定义为在病损的牙根表面形成新的牙骨质、牙槽骨和有功能的牙周韧带[11]。基于干细胞的牙周组织工程学和骨组织工程学可以增强牙周再生和骨再生。MSCs来源广泛,具有较强的增殖能力和多向分化潜能,是牙周组织工程学的理想种子细胞。其中,BMSCs具有分化成牙周组织细胞的能力,被认为是一种最适宜牙周再生的细胞群[11]。DPSCs是人类发现的第一种牙源性干细胞,具有较强的增殖能力和成骨分化潜力,并具有旁分泌和免疫调节能力,是牙周再生的另一种细胞来源[3-5]。这两种MSCs均被证实可以改善牙周再生治疗的效果[2-3,12-13]。
目前的研究多集中在关注正常培养条件下MSCs植入牙周缺损部位的再生效果。然而,基于干细胞的牙周再生利用的是MSCs高度的自我更新和多向分化潜能。MSCs所处微环境中的物理、化学、非编码区RNA、代谢以及遗传基因将共同参与决定MSCs的分化方向[14]。因此关注炎症微环境下MSCs的性能改变十分重要。炎症微环境对干细胞增殖、矿化及成骨潜能存在极大影响,合理选择种子细胞的来源和治疗对象至关重要。本研究旨在检测BMSCs和DPSCs在肥胖和牙周炎导致的炎症微环境状态下干细胞性能的变化,从而选择更适宜牙周组织再生的干细胞来源。
肥胖在当今极为常见,是II型糖尿病、胰岛素和多种心脑血管疾病的重要危险因素,已成为全球性的健康问题。脂肪组织不仅是能量储存库,更是内分泌和免疫活性器官。肥胖会使机体处于慢性低度炎症状态。这种慢性低度炎症主要表现为血清及组织中促炎因子,如IL-1β、IL-6、TNF-α表达水平升高及抗炎因子,如IL-10表达水平降低[15]。肥胖状态下,多种免疫细胞,如T细胞、B细胞、NKT细胞、树突状细胞等均参与炎症反应。这些免疫细胞可分泌IL-1β、IL-6、TNF-α等促炎因子影响微环境。肥胖状态下脂肪细胞还会分泌一系列的脂肪因子。其中,内脂素、瘦素、抵抗素是促炎因子,表达水平升高;脂联素是抗炎因子,表达水平降低[16]。多项流行病学及动物实验研究表明牙周炎与肥胖间存在显著相关性,并认为肥胖是牙周炎症性破坏的第二大危险因素[17-18]。而牙周致病菌及其代谢产物也会引起全身免疫反应,影响肥胖的发生和发展[19-20]。
本研究对体外成骨诱导后的大鼠DPSCs及BMSCs的细胞生长情况及成骨向分化情况进行了检测。结果发现,对于鼠DPSCs细胞,C组、OB组、PD组、PD+OB组生长速度依次增加,ALP相对活性值依次降低,茜素红染色矿化结节数量依次减少,成骨相关蛋白及mRNA的相对表达量依次降低。对于鼠BMSCs细胞,C组、PD组、OB组、PD+OB组生长速度依次增加,ALP相对活性值依次降低,茜素红染色矿化结节数量依次减少,成骨相关蛋白及mRNA的相对表达量依次降低。这可能是由于肥胖及牙周炎状态均会引起炎症反应,而炎症状态可以促进细胞增殖,造成细胞活性降低,并抑制干细胞的成骨能力。相比较而言,PD组的DPSCs较OB组具有较强的细胞增殖能力及较低的成骨活性;而OB组的BMSCs较PD组具有较强的细胞增殖能力及较低的成骨活性。这可能说明牙周炎状态相比肥胖状态对以DPSCs为代表的牙源性干细胞的成骨能力的抑制作用较大,而肥胖状态相比牙周炎状态对以BMSCs为代表的非牙源性干细胞的成骨能力抑制作用较大。当两种炎症状态同时存在时,对干细胞的成骨能力抑制作用最大。在此前也有研究发现肥胖会使小鼠的BMSCs成脂向分化增强,成骨向细胞的募集减少且骨形成减少,表现为ALP染色减弱,ALP水平的降低,茜素红染色矿化结节加少,成骨特异性基因ALP,Runx2及OCN的mRNA表达水平降低[21-22]。
综上所述,牙周炎和肥胖均会使细胞处于炎症微环境,造成大鼠干细胞细胞增殖加快且细胞活性及矿化能力降低,同时下调多个与成骨相关的基因及蛋白水平。牙周炎合并肥胖会加重对成骨能力的抑制作用。肥胖对大鼠骨髓间充质干细胞的影响大于对牙髓间充质干细胞的影响,而牙周炎对牙髓间充质干细胞的影响大于对骨髓间充质干细胞的影响。该实验结果为后期牙周炎的干细胞治疗选取理想的种子细胞和理想的治疗对象提供理论依据。然而本实验的结果仅局限于动物模型,未能采用临床实验来直接研究肥胖和牙周炎对牙周组织和干细胞的影响,且本实验也尚未深入探讨这种影响的具体调控机制,仍需进一步研究。
