黄芪甲苷抑制TLR4/MyD88/NF-κB信号通路对牙周炎正畸大鼠牙周组织重塑的影响
2023-11-27王丹刘雨笛邵丽萍马稔秋
王丹 刘雨笛 邵丽萍 马稔秋
牙周炎(periodontitis,PD)[1]相关的骨丢失引起的牙齿移动导致的咬合改变通常通过正畸治疗得到纠正[2]。正畸牙齿移动(orthodontic tooth movement,OTM)可增强细菌引起的PD症并导致骨吸收增加从而破坏牙周[3]。Toll样受体4(toll-like receptor 4,TLR4)/髓样分化因子88(myeloid differentiation factor 88,MyD88)/核因子-κB(nuclear factor kappa-B,NF-κB)通路是主要的炎症通路,在PD中可被牙周病原菌激活,控制促炎因子的产生,诱导炎症反应[4]。据报道,在正畸力施加过程中,TLR4水平升高,可促进OTM早期炎症反应[5]。此外,TLR4/NF-κB激活导致基质金属蛋白酶(matrix metalloproteinase,MMP)分泌增加参与牙周重塑和牙齿移动[6]。黄芪甲苷(Astragaloside IV,AS-IV)可通过阻断TLR4/MyD88/NF-κB信号通路,抑制炎症反应[7]。研究显示,AS-IV可以减轻实验性PD大鼠的炎症反应并增强免疫[8]。然而,迄今为止,尚未有关于AS-IV对PD正畸过程中牙周重塑的影响报道。因此,本研究通过构建大鼠PD-OTM模型,观察AS-IV对PD大鼠牙齿移动过程中炎症反应的影响,探讨AS-IV对牙周组织重塑的影响和机制。
1 材料与方法
1.1 动物
90 只SPF级7~8 周龄雄性Wistar大鼠[北京维通利华实验动物技术有限公司,许可证号SCXK(京)2021-0011],体重(200±20) g,所有动物实验均经实验动物伦理委员会批准(批准号:071125090823),符合动物伦理治疗指南。动物自由进食和饮水,饲养条件为室温(25±2)℃、湿度(60±5)%,光照12 h/黑暗12 h。所有大鼠在实验前适应环境7 d。
1.2 主要试剂与仪器
AS-IV(HPLC纯度≥98%,SA8640)、抗酒石酸酸性磷酸酶(TRAP)染色液(G1492)(北京Solarbio);TAK-242(纯度99.72%,TLR4抑制剂,HY-11109,Med Chem Express,美国);牙龈卟啉单胞菌(P.gingivalis)、脂多糖(LPS-PG)、TLR4激活剂(tlrl-pglps)(Invivogen,美国);肿瘤坏死因子α(tumor necrosis factor α,TNF-α)(ml002859)、白细胞介素6(interleukin 6,IL-6)(ml102828)、IL-1β(ml003057)ELISA检测试剂盒(上海酶联生物科技有限公司);苏木精-伊红(HE)染色试剂盒(C0105S,上海碧云天);兔源一抗TLR4(48-2300)、MyD88(PA5-19919)、NF-κB p65(PA5-16545)、β-肌动蛋白(β-actin)(PA5-59497)、NanoDrop ND-2000分光光度计(Thermo Fisher Scientific,美国);ABI Prism®7500荧光定量PCR仪(Applied Biosystems,美国)。
1.3 方法
1.3.1 PD大鼠模型的建立 大鼠腹腔注射0.3%戊巴比妥钠(40 mg/kg,10 mL/kg)麻醉。剥开牙龈,用0.2 mm不锈钢丝结扎左侧上颌第一磨牙[8]。另取18 只大鼠为正常对照(NC)组,只进行麻醉,不做任何处理。大鼠持续喂养4 周,观察到牙龈红肿、探诊出血和牙周袋;经Micro-CT(Quantum GX,PerkinElmer,美国)和病理切片观察牙槽骨丢失和牙龈炎症,证实72 只大鼠PD模型成功建立[8]。
1.3.2 OTM模型的建立 将PD大鼠随机分为4 组(PD组、PD+OTM组、PD+OTM+AS-IV组、PD+OTM+AS-IV+LPS组;n=18/组)。测力计将NiTi螺旋弹簧校准到40 g,0.2 mm正畸不锈钢丝将上颌第一磨牙结扎[9]。戊巴比妥钠麻醉PD大鼠,去掉左上颌后牙区的结扎丝,在大鼠上颌切牙唇侧和第一磨牙的近内侧表面制作深约0.5 mm的保留槽。螺旋弹簧在上颌切牙和第一磨牙之间用正畸不锈钢丝结扎。
1.3.3 实验干预 PD+OTM+AS-IV组大鼠灌胃40 mg/kg的AS-IV混悬液[8],NC组和PD组、PD+OTM组大鼠灌胃等量5%羧甲基纤维素钠,1 次/d,持续2 周;PD+OTM+AS-IV+LPS组大鼠在灌胃40 mg/kg的AS-IV混悬液的同时,每2 d将10 μL LPS-PG(1 μg/μL)注射到牙龈内[10],其余各组大鼠注射生理盐水。
1.4 取材与指标检测
1.4.1 Micro-CT扫描和分析牙槽骨的变化 每组随机选6 只大鼠收集上颌骨,创建牙槽骨的三维(3D)图像。用3D图像测量上颌第一磨牙颊侧釉牙骨质界(cemento enamel junction,CEJ)和牙槽骨嵴顶(alveolar bone crest,ABC)之间的距离(CEJ-ABC距离),监测牙槽骨的吸收;并采用Micro-CT分析软件计算缺损区(感兴趣区域,ROI)骨体积密度(BV/TV)、骨小梁数(Tb.N)和骨小梁厚度(Tb.Th)。
1.4.2 组织学分析 上颌骨样品乙醇脱水包埋。获得连续的4 μm厚的横切片,HE和TRAP染色。在HE染色中,参考文献方法[11]对病理损伤进行分级评分,以量化牙槽骨组织学损伤。在TRAP染色中,TRAP染色将破骨细胞染成红色,对附着在牙槽骨表面的TRAP阳性多核(>3 个核)细胞进行计数。
1.4.3 免疫组织化学染色检测牙周组织NF-κB p65表达 组织切片脱蜡、水化后,0.3% Triton X-100洗涤组织切片,过氧化氢孵育后,切片与二抗(1∶200)一起孵育,DAB显色,苏木精复染。Image-Pro Plus软件(6.0版)分析平均光密度(mean optical density,MOD),并检测NF-kB p65核定位。
1.4.4 ELISA检测牙周组织炎症因子水平 每组随机选取6只大鼠,处死后收集牙周组织,在预冷的生理盐水中匀浆,4 ℃下以14 000×g离心10 min;收集上清液,ELISA测量TNF-α、IL-1β和IL-6水平。
1.4.5 RT-qPCR检测牙周组织MMP-2、MMP-9、核因子κB受体活化因子配体(nuclear factor kappa B receptor activator ligand,RANKL)和骨保护素(osteoprotegerin,OPG)mRNA表达 取剩余6 只大鼠的牙周组织,-80 ℃保存备用。逆转录试剂盒将总RNA合成为cDNA。以cDNA为模板进行PCR扩增。条件:95 ℃预变性5 min,95 ℃变性10 s、 60 ℃退火30 s、 72 ℃延伸30 s的40 个循环。β-actin用作内参基因,2-ΔΔCt评估目标基因表达(表1)。
1.4.6 蛋白质印迹(Western blot)分析牙周组织TLR4/MyD88/NF-κB通路相关蛋白表达 大鼠牙周组织在RIPA裂解液中研磨,离心收集上清液为总蛋白溶液,提取胞核蛋白。用10% SDS-PAGE分离蛋白质并转移到PVDF膜上。室温下用含有5%脱脂牛奶的PBST(含有0.1% Tween-20)封闭膜1 h后,将膜在4 ℃下与如下一抗孵育过夜:TLR4(1∶1 000)、 MyD88(1∶1 000)、NF-κB p65(1∶500)、β-actin(1∶2 000)、Histone H3(1∶1 000)。之后,将膜与辣根过氧化物酶偶联的IgG二抗(1∶2 000)在室温下孵育1 h。使用Super ECL试剂盒对蛋白质条带进行可视化,Image J软件量化条带的灰度值。结果标准化为β-actin或Histone H3。
1.5 统计学分析
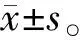
2 结 果
2.1 AS-IV抑制PD-OTM大鼠牙槽骨丢失
与NC组相比,PD组和PD+OTM组CEJ-ABC距离增加,BV/TV、Tb.N和Tb.Th降低(均P<0.05);与PD组相比,PD+OTM组CEJ-ABC距离增加,BV/TV、Tb.N和Tb.Th降低(均P<0.05);与PD+OTM组相比,PD+OTM+AS-IV组CEJ-ABC距离降低,BV/TV、Tb.N和Tb.Th升高(均P<0.05);与PD+OTM+AS-IV组相比,PD+OTM+AS-IV+LPS组CEJ-ABC距离增加,BV/TV、Tb.N和Tb.Th降低(均P<0.05)(图1、 表2)。
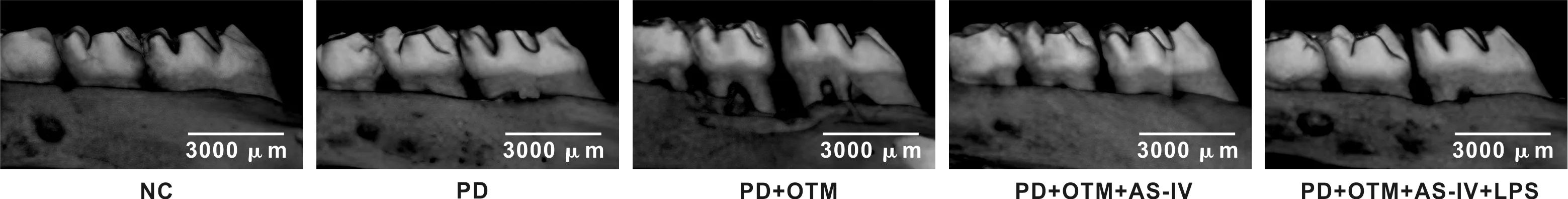
图1 Micro-CT重建的上颌骨3D图像
2.2 AS-IV减轻PD-OTM大鼠牙槽骨组织损伤
HE染色结果显示,NC组大鼠未发现组织病理学改变;与NC组相比,PD组可见炎症细胞浸润遍及牙龈,轻微的牙槽突吸收,牙骨质未见损伤,组织损伤评分增加(P<0.05);与PD组相比,PD+OTM组可观察到牙龈和牙周韧带均存在炎症细胞浸润,且伴随严重的牙骨质和牙槽突破坏,组织损伤评分增加(P<0.05);与PD+OTM组相比,PD+OTM+AS-IV组炎症细胞浸润减少,牙骨质和牙槽突破坏程度减轻,组织损伤评分降低(P<0.05);与PD+OTM+AS-IV组相比,PD+OTM+AS-IV+LPS组炎症细胞浸润加重,组织损伤评分增加(P<0.05)(图2、 表3)。
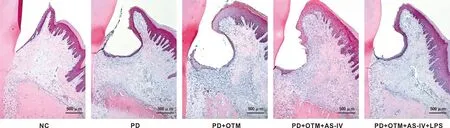
图2 各组大鼠牙周组织病理变化(HE,比例尺=500 μm)

表3 各组大鼠牙周组织损伤评分、破骨细胞数量比较
2.3 AS-IV降低PD-OTM大鼠牙周组织多核破骨细胞数量
牙周组织TRAP染色显示NC组仅存在少量破骨细胞;与NC组相比,PD组和PD+OTM组观察到大量TRAP阳性破骨细胞,多核破骨细胞数量增加(P<0.05);与PD组相比,PD+OTM组多核破骨细胞数量增加(P<0.05);与PD+OTM组相比,PD+OTM+AS-IV组TRAP阳性细胞明显减少,多核破骨细胞数量降低(P<0.05);与PD+OTM+AS-IV组相比,PD+OTM+AS-IV+LPS组TRAP阳性细胞增多,多核破骨细胞数量增加(P<0.05)(图3、 表3)。
图3 各组大鼠牙周组织TRAP染色图像(TRAP,比例尺=200 μm)
2.4 AS-IV降低PD-OTM大鼠牙周组织NF-κB p65核转位
与NC组相比,PD组和PD+OTM组NF-κB p65阳性表达升高(P<0.05),且主要表达在细胞核;与PD组相比,PD+OTM组NF-κB p65阳性表达升高(P<0.05),核NF-κB p65阳性细胞进一步增多;与PD+OTM组相比,PD+OTM+AS-IV组NF-κB p65阳性表达降低(P<0.05),核NF-κB p65阳性细胞明显减少;与PD+OTM+AS-IV组相比,PD+OTM+AS-IV+LPS组NF-κB p65阳性表达升高(P<0.05),核NF-κB p65阳性细胞增多(图4、 表4)。
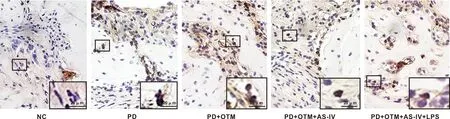
图4 各组大鼠牙周组织NF-κB p65表达(IHC,比例尺=20 μm)

表4 各组大鼠牙周组织NF-κB p65表达比较
2.5 AS-IV降低PD-OTM大鼠牙周组织炎症因子TNF-α、IL-1β和IL-6水平
与NC组相比,PD组和PD+OTM组TNF-α、IL-1β和IL-6水平升高(P<0.05);与PD组相比,PD+OTM组TNF-α、 IL-1β和IL-6水平升高(P<0.05);与PD++OTM组相比,PD+OTM+AS-IV组TNF-α、IL-1β和IL-6水平降低(P<0.05);与PD+OTM+AS-IV组相比,PD+OTM+AS-IV+LPS组上述炎症因子水平升高(P<0.05)(表5)。
表5 各组大鼠牙周组织TNF-α、IL-1β和IL-6水平比较Tab5 Comparison of TNF-a,LL-1β and IL-6 levels in periodontal tissues of rals among the groups
2.6 AS-IV抑制PD-OTM大鼠牙周组织MMP-2、MMP-9、RANKL和OPG mRNA表达
与NC组相比,PD组和PD+OTM组MMP-2、MMP-9和RANKL mRNA水平以及RANKL/OPG比值升高(P<0.05);与PD组相比,PD+OTM组MMP-2、MMP-9和RANKL mRNA水平以及RANKL/OPG比值升高(P<0.05);与PD+OTM组相比,PD+OTM+AS-IV组MMP-2、MMP-9和RANKL mRNA水平以及RANKL/OPG比值降低(P<0.05);与PD+OTM+AS-IV组相比,PD+OTM+AS-IV+LPS组MMP-2、MMP-9和RANKL mRNA水平以及RANKL/OPG比值升高(P<0.05)(表6)。

表6 各组大鼠牙周组织MMP-2、MMP-9、RANKL和OPG mRNA水平比较
2.7 AS-IV抑制PD-OTM大鼠牙周组织TLR4/MyD88/NF-κB通路激活
与NC组相比,PD组和PD+OTM组TLR4、MyD88和核NF-κB p65蛋白水平升高(P<0.05);与PD组相比,PD+OTM组TLR4、MyD88和核NF-κB p65蛋白水平升高(P<0.05);与PD+OTM组相比,PD+OTM+AS-IV组TLR4、MyD88和核NF-κB p65蛋白水平降低(P<0.05);与PD+OTM+AS-IV组相比,PD+OTM+AS-IV+LPS组TLR4、MyD88和核NF-κB p65蛋白水平升高(P<0.05)(表7,图5)。
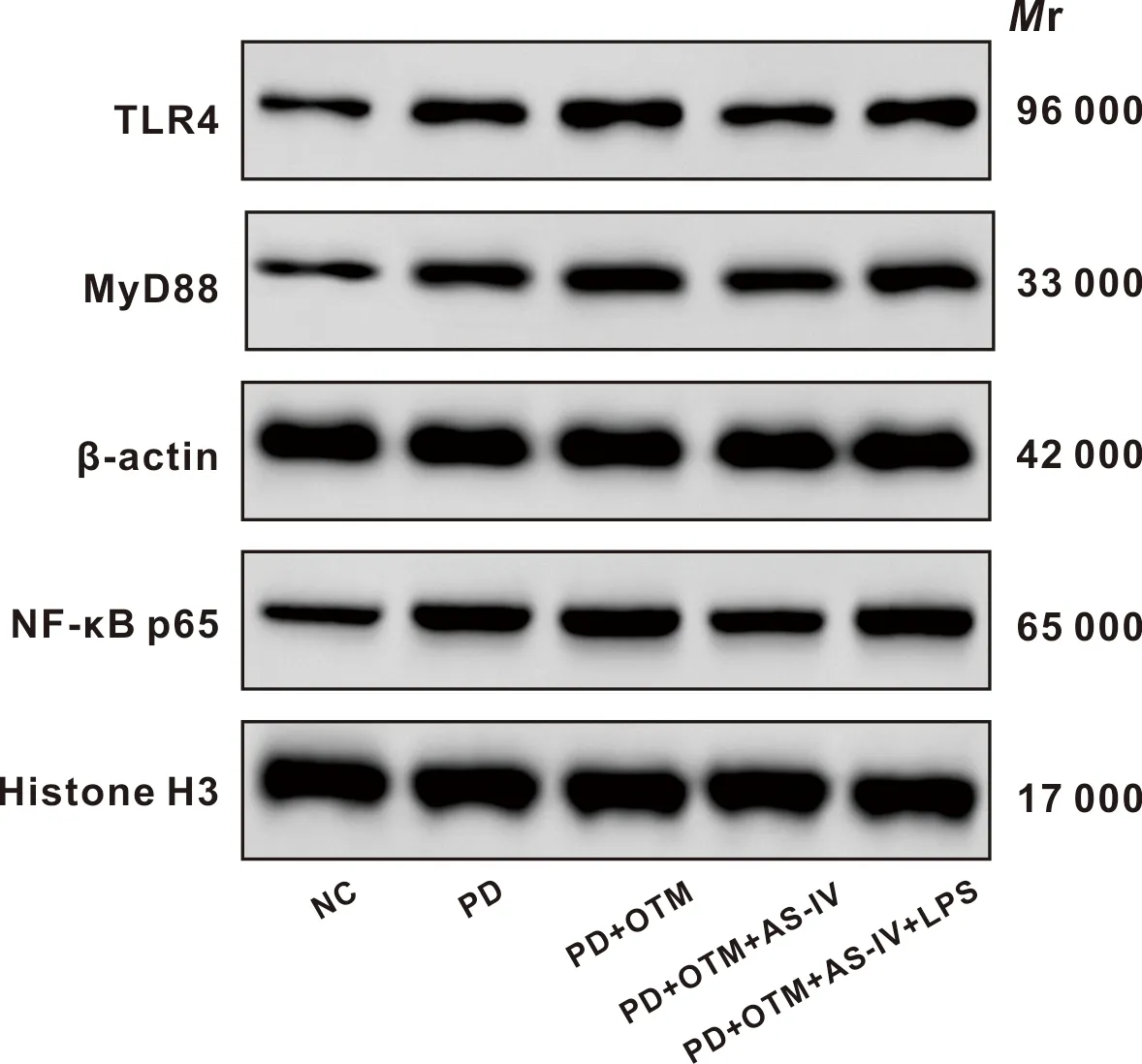
图5 各组大鼠牙周组织TLR4、MyD88、NF-κB p65蛋白表达
表7 各组大鼠牙周组织TLR4、MyD88、NF-κB p65蛋白水平比较Tab7 Comparison of TLR4,MyD88 and NF-kB protein levels in periodontal tissues of rats among the groups
3 讨 论
PD患者的咬合不正,采用的正畸治疗所涉及的机械力可能会放大牙周组织的炎症,增加骨吸收的风险[12-13]。结扎法诱导的实验性PD模型是一种可靠且广泛使用的动物模型。本研究使用结扎法诱导PD,结果显示,大鼠在结扎后出现牙龈红肿、探诊出血和牙周袋,经Micro-CT和病理切片观察到CEJ-ABC距离增加,牙槽骨丢失和牙龈大面积炎症,表明成功建立了实验性PD大鼠模型。OTM进一步增强了炎症反应,加剧了PD诱导的牙槽骨丢失,CEJ-ABC距离增加、炎症因子(IL-6、TNF-α、IL-1β)水平升高和骨小梁更加疏松证明了这一点。因此,控制炎症是PD-正畸治疗中的重要步骤。
AS-IV是黄芪中的主要活性成分,具有抗肿瘤、抗炎、抗氧化和抗心血管疾病作用。据报道,AS-IV可减轻PD大鼠的炎症反应[8],并且可抑制破骨细胞生成,是治疗破骨细胞相关疾病的潜在天然药物[14]。本研究进一步调查了AS-IV对实验性PD-OTM大鼠炎症和牙周组织重塑的影响,结果表明AS-IV可减轻PD-OTM大鼠的炎症反应,对具有活动性炎症的牙槽骨丢失具有保护作用。在牙周组织中,促炎细胞因子(如IL-1β、IL-6和TNF-α)的激活会刺激结缔组织基质的降解、破骨细胞的激活和骨的再吸收[15]。HE和TRAP染色进一步证实,AS-IV可减少牙周组织炎症细胞浸润,减轻牙骨质和牙槽突破坏,抑制破骨细胞生成;提示,AS-IV可抑制炎症反应,减少PD大鼠OTM期间的牙槽骨丢失。
细胞因子TNF-α、IL-1β和IL-6可以通过增强RANKL的表达诱导破骨细胞活化。为了了解破骨细胞分化和形成的机制,通过RT-qPCR评估了牙周组织中破骨细胞生成相关基因(RANKL、OPG)表达。在PD中,与健康牙周组织相比,RANKL上调,而OPG下调,导致RANKL/OPG比值增加[16]。在本研究中,OTM进一步上调了PD大鼠RANKL/OPG比值;而AS-IV可降低RANKL/OPG比值,减少破骨细胞生成,抑制骨吸收。因此,AS-IV对RANKL表达的抑制可能是PD大鼠OTM期间破骨细胞分化、形成和骨丢失减少的重要机制。
RANKL/OPG系统的失衡与NF-κB激活有关。在实验性牙齿移动期间,骨细胞中NF-κB信号传导的激活了诱导RANKL表达来增强破骨细胞生成,从而加速正畸牙齿的移动[17]。TLR4在PD中高表达,TLR4介导NF-κB信号传导参与PD的发病机制[18]。NF-κB主要在破骨细胞中迅速产生,响应正畸力[19]。TLR4激活后,可通过MyD88快速激活在细胞质中处于静息状态的NF-κB p65,促进NF-κB p65与其抑制蛋白IκBα分离并转移到细胞核中,促进促炎细胞因子的释放。在本研究中,在PD大鼠牙周组织中观察到NF-κB p65表达增加,正畸力可进一步增加NF-κB p65的核移位,表明在PD大鼠OTM期间TLR4/MyD88/NF-κB信号通路被进一步激活。给予AS-IV干预后,PD-OTM大鼠牙周细胞中NF-κB p65的核移位大部分被阻断,同时TLR4、MyD88和核NF-κB p65蛋白水平均降低;表明AS-IV可抑制TLR4/MyD88/NF-κB信号通路的激活。
另一个重要发现是牙周组织中细胞外基质(ECM)紊乱,PD-OTM大鼠牙周组织中MMP-2和MMP-9表达增加。MMP-2和MMP-9的过量产生会导致在PD等病理条件下加速基质降解[20],与OTM过程中牙周组织的炎症水平、胶原ECM重塑的速率和程度有关[21]。而AS-IV降低了PD-OTM大鼠牙周组织MMP-2、MMP-9表达水平。在慢性PD期间,LPS-PG会引起单核细胞积累和分化为巨噬细胞,并通过与TLR4相互作用诱导促炎细胞因子释放,增加MMP分泌[22]。在本研究中,LPS-PG干预导致AS-IV对TLR4/MyD88/NF-κB信号通路的抑制作用降低,增加了细胞核NF-κB p65表达,减弱了AS-IV对PD大鼠OTM期间牙周炎症反应和MMP-2、MMP-9表达的抑制作用以及对牙槽骨丢失的改善作用。研究结果提示,AS-IV可能通过抑制TLR4/MyD88/NF-κB信号通路,减少了PD大鼠OTM期间的牙槽骨丢失。
综上所述,AS-IV可抑制炎症反应,减少PD大鼠OTM期间的牙槽骨丢失,改善牙周组织重塑,其作用机制可能与抑制TLR4/MyD88/NF-κB信号通路有关。本研究表明,AS-IV可能是牙周组织工程和PD-正畸治疗中的一种新型药物。然而,本研究主要关注了破骨细胞的变化以及TLR4/MyD88/NF-κB信号通路,AS-IV在减轻骨吸收和促进成骨方面的具体调控机制仍需进一步探索。此外,关于AS-IV用于体内实验的安全性问题,在未来的研究中将考虑采用HE染色评估其对体内主要脏器的影响。
