钛表面有序微米凹坑结构的构筑及其对BMSCs成骨活性的影响
2023-11-27曾秀霞赖颖真贺于奇黄俊徽许志强
曾秀霞 赖颖真 贺于奇 黄俊徽 许志强
机械抛光纯钛已广泛应用于骨内植物,但其属于生物惰性材料,难于直接与骨组织发生紧密键合[1]。改造钛基材料的表面形貌特性以提升其生物活性至关重要[2]。既往常用喷砂或酸蚀等方式来构筑表面微观形貌,但制备的结构大多是无序和各向异性,不能模仿天然骨组织的有序特征而呈现出较低的成骨活性[3]。学者们已尝试通过3D打印、微铣削和激光刻蚀等方法来构筑有序微米形貌,但是这些方法通常价格昂贵且难以应用于形状复杂的骨内植入物[4]。本研究采用简单的电化学刻蚀法,在纯钛表面构筑出了仿细胞尺寸的有序微米凹坑阵列结构,并通过与骨髓间充质干细胞(BMSCs)共培养,对其成骨活性进行评价。
1 材料与方法
1.1 试样制备
纯钛圆片(直径14.5 mm,厚度1 mm,宝鸡市德鑫钛业有限公司)砂纸逐级打磨抛光并除油预处理后,随机分为A、B、C 3 组(n=3)。A组未再做任何处理;B组用1.5 wt% HF酸蚀15 min;C组进行电化学刻蚀处理,石墨片和预处理的钛圆片分别为阴极和阳极,以0.5~5 mol/L NaCl -0.5~5 mol/L HF混合溶液为电解质,在10~15 V恒定电位下进行电化学刻蚀处理15 min。3 组试样450 ℃热处理2 h后超声清洗并干燥,各种检测及细胞接种前再进行紫外线消毒30 min。
1.2 理化性能表征
1.2.1 表面形貌观察 SEM(S4800,Hitach公司,日本)观察试样表面形貌特征。
1.2.2 表面接触角测试 在室温环境下,利用接触角测试仪(DSA100,KRUSS公司,德国)采用悬滴法测量试样表面液体的静态水接触角。
1.2.3 3D轮廓图及表面粗糙度 在环境温度(20±2) ℃下,使用VK-X250K型号激光显微系统[VK-X250K型号,基恩士(中国)有限公司]对各试样表面三维形貌进行检测,以获得试样3D轮廓图并测量各试样表面糙度数值。
1.2.4 蛋白吸附检测 各组钛试样置于24 孔板中,加入1 mL含10%FBS的DMEM低糖培养基,孵育2 h后,加入1%十二烷基硫酸钠溶液置摇床上振荡,用增强型BCA蛋白浓度测定其蛋白浓度。
1.3 细胞培养
选用SD大鼠BMSCs(广州赛业生物科技有限公司),选择生长良好的P3~P5为实验细胞。
1.4 细胞实验
1.4.1 细胞形态观察 试样置于24孔板中,BMSCs接种密度为2×104/孔。培养2 d后,试样固定、脱水和喷金,SEM观察试样表面黏附的细胞形态。
1.4.2 细胞黏附 BMSCs接种密度为4×104/孔,培养2 h后MTT法检测细胞黏附,具体步骤按照厂家说明进行。
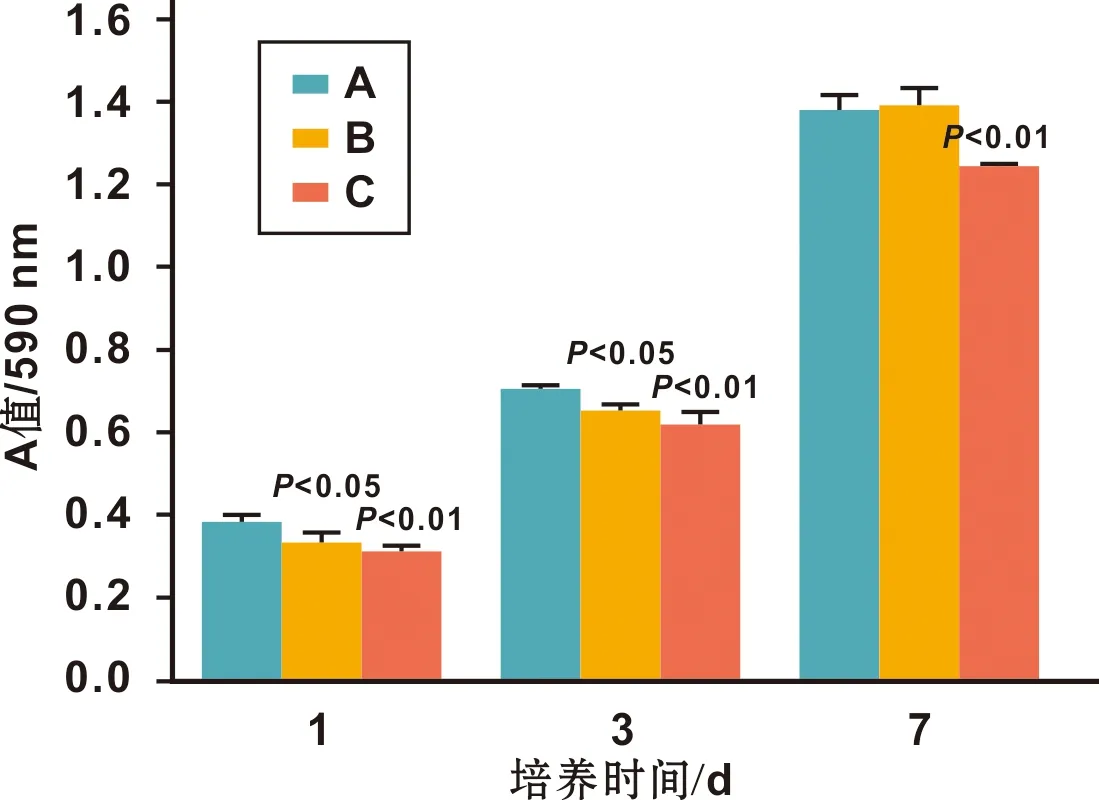
1.4.3 细胞增殖 BMSCs接种密度为2×104/孔,培养1、 3、 7 d后MTT法检测细胞增殖。
1.4.4 细胞胶原分泌 BMSCs接种密度为2×104/孔,培养14 d后固定,选用溶解在饱和苦味酸中的0.1%天狼星红对细胞分泌的胶原进行染色18 h,然后用0.1 mol/L的乙酸反复漂洗试样,直至无红颜色析出为止,体视显微镜照相。为了进一步定量比较,加入洗脱液(用0.2 mol/L氢氧化钠和甲醇以体积1∶1的比例配置)震荡15 min将试样表面的染料洗脱下来,采用用酶标仪在波长540 nm下测其A值。
1.4.5 细胞外基质(ECM)矿化 BMSCs接种密度为2×104/孔,培养14 d后固定,选用茜素红S染色液(1%,pH=4.2)对细胞分泌的ECM染色 5~10 min,然后用三级水轻柔漂洗钛试样5 次,直至不再脱色,体式显微镜照相。为了进一步定量比较,用10%氯化十六烷基吡啶来溶解钛试样表面的茜素红S染料,采用酶标仪(SpectraMax iD3型,Molecular Devices公司,美国)在波长620 nm下检测A值。
1.5 统计学分析
2 结 果
2.1 理化性能表征
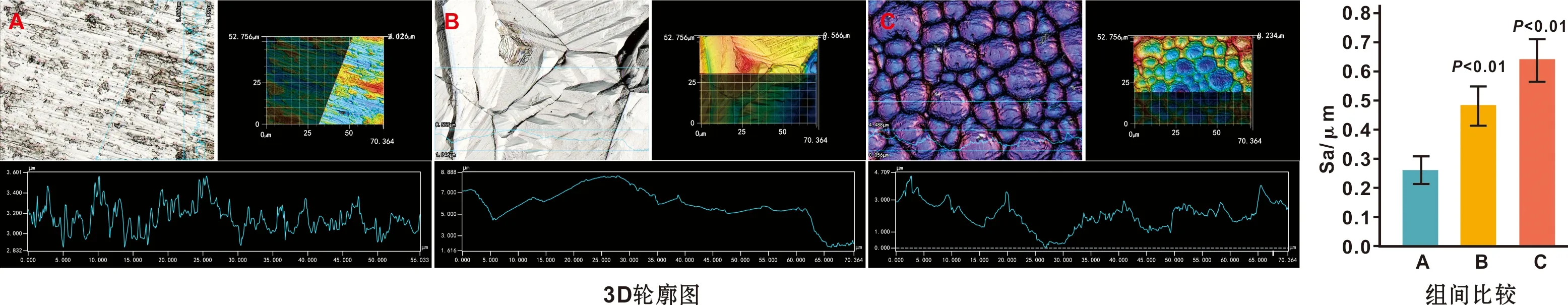
2.1.1 表面形貌 如图1,A组可见沿抛光方向平行排列的细小微沟槽结构;B组低倍镜下可见边缘锐利的无序沟壑状结构,高倍镜下见稀疏分布的边缘圆钝的纳米点状颗粒;C组低倍镜下可见约为20 μm大小的有序微米凹坑阵列,高倍下可见密集分布的顶部较圆钝的纳米凸起颗粒。
2.1.2 接触角和亲水性 如图2,3 组试样的接触角大小关系依次是A 图2 3 组样本表面接触角 2.1.3 3D轮廓图及表面粗糙度3D轮廓图(图3)可见,A组表面呈现轻微起伏的细小划痕沟槽且较光滑,B组表面可见无序沟壑结构,C组表面可见规整有序的微米凹坑结构。表面粗糙度定量比较得知,其大小关系依次是A 图3 3 组试样表面粗糙度比较 2.1.4 早期蛋白吸附 3 组试样表面早期蛋白吸附相比具有统计学意义,其大小依次是A 图4 3 组试样2 h的蛋白吸附量比较 2.2.1 细胞形态及黏附 如图5,A组表面黏附的BMSCs顺着抛光划痕排列更多地呈现出梭状形态,而B组和C组的BMSCs更倾向于多边形黏附形态。其C组表面细胞可紧密地黏附在一个微米凹坑表面,也可跨越多个微米凹坑,细胞铺展拉伸更明显,并且伸出较多细长的伪足与周边的细胞呈现紧密连接。 图5 3 组试样表面BMSCs的细胞黏附 2.2.2 细胞黏附 如图6,C组试样2 h细胞黏附量显著大于A组和B组。 图6 3 组试样表面细胞增殖情况 2.2.3 细胞增殖 如图6,尽管7 d时A组和B组相比没有统计学差异,总体来说,B组和C组表面BMSCs的细胞增殖均受到了一定程度的抑制。但是细胞增殖在3 组试样表面均呈现出时间依赖性,其随着时间的推移而明显增加。 2.2.4 细胞胶原分泌 如图7,3 组试样表面BMSCs均分泌了一定量的细胞胶原,定量结果比较其大小依次是A 图7 3 组试样表面BMSCs的细胞胶原分泌(×50) 2.2.5 ECM矿化检测 如图8,3 组试样表面BMSCs均形成了红色的矿化结节,定量结果比较其大小依次是A 骨内植入物植入体内与血液接触时,材料表面首先快速地吸附血清中的蛋白,以介导随后的细胞响应[5]。一般来说,材料表面的亲水性越好,越有利于表面的蛋白吸附,进而为后续的细胞黏附提供有利环境[6]。经过电化学刻蚀处理的C组试样,材料表面比表面积增大,粗糙度值上升,亲水性提升,从而显著地提升了表面的蛋白吸附量,有利于后续的细胞黏附和生长。C组试样表面还具有精细的纳米柱凸起,可能也会提供更多的吸附位点,协助表面蛋白吸附和细胞黏附[7]。而且C组试样表面有序微米凹坑的直径约为20 μm,这同未铺展开的BMSCs尺寸相当,可能也有利于BMSCs的早期黏附[8]。所以细胞黏附结果显示,相比其它两组试样,C组试样表面早期细胞黏附量最多。 研究发现,BMSCs在材料上的黏附方式和其他多数细胞类似也是通过粘着斑实现[9]。细胞通过粘着斑系统来感知材料表面拓扑结构,表现为表面拓扑结构引起细胞形态改变,导致细胞骨架力信号改变后介导细胞基因表达[10]。在细胞早期黏附时,还未形成ECM,吸附到材料表面的这些蛋白团簇被用于充当了初始的ECM,把材料的表面形貌特征通过粘着斑传递给黏附的细胞。微米结构因易形成蛋白吸附的位点,进而集聚蛋白团簇,从而通过粘着斑来指导贴壁细胞的形状和方向[11]。从细胞在不同钛试样上的黏附形态可见,A试样上BMSCs在沿抛光方向平行排列的细小微沟槽上呈梭状黏附,B组和C组上的BMSC因为沟壑和凹坑结构更倾向于多边形黏附形态。其中C组试样上的BMSCs可以顺利黏附在与其尺寸相当的各个微米凹坑表面,然后逐渐铺展并跨过各个凹坑,伸出伪足同周围细胞形成广泛的连接,促进了细胞间的广泛通信。 研究表面,BMSCs形态呈现为多边形以及伸展的形态,表明细胞骨架拉伸程度高,成骨分化倾向越明显[12]。而且微米凹坑间细胞通过伪足形成的直接连接也是细胞间相互通信的一种方式,这种细胞通信会使得相邻细胞之间的细胞质保持连续性,从而有利于细胞成骨分化[7]。因此,相比对照组纯钛,B组和C组样本上BMSCs的胶原分泌和ECM矿化有了明显的提升,特别在C组样本提升更明显而展示最优的成骨分化能力。既往研究表明,微米结构有利于细胞成骨分化,但不利于细胞增殖,因为细胞分化和细胞增殖间存在互为抑制的关系[13]。该研究也得出同样的结论,经过表面微米改性处理的B组和C组样本表面BMSCs的细胞增殖均受到了一定程度的抑制。但是在早期骨形成阶段,细胞成骨分化可能比初始的细胞增殖更加重要[14]。而且实验中3 组试样的细胞增殖也随着时间的推移而明显增加,说明均具有良好的生物相容性。 综上所述,有序微米结构的C组试样可以促进BMSCs的细胞黏附和成骨分化,并在一定程度上支持其细胞增殖,具有良好的成骨活性。而且其制备工艺简单便捷也适用于形状复杂的种植体,有望成为一种良好的骨内植物表面处理技术。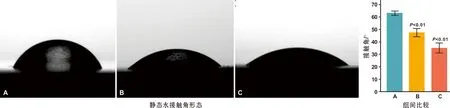

2.2 细胞实验


3 讨 论
