关于氢键本质的认识及教学策略
——基于2023年辽宁省高考化学试题分析
2023-11-27张建钊梁佳祺
芦 峰 张建钊 梁佳祺
一、问题提出
(一)由化学高考题引发的争议
2023年辽宁省高考化学试卷中的第17(2)题如下:
该题考查噻吩和吡咯的沸点差异的原因。标准答案指出吡咯分子间存在氢键而导致其沸点高于噻吩。然而,试题公布后,一些高中教师对这个问题的科学性提出了质疑。疑虑集中在吡咯分子间是否存在氢键。提出质疑的教师认为,形成氢键的电负性原子必须具有孤对电子,且与电正性的H 原子轨道重叠。但是吡咯分子中氮原子的非杂化p 电子对参与了吡咯环的π 键的形成,因此吡咯分子间不存在氢键。这就对该高考试题的科学性产生了质疑,认为该题不严谨。
(二)基于高考题进行问卷调查
基于高考题引发的争议,为了探查高中化学教师对于氢键本质认识的现状,设计如下四个题目。
题目1:与氢原子形成氢键的电负性原子或基团必须具备孤对电子吗?
题目2:决定氢键方向性的因素有哪些?
题目3:在D—H…A 键中,如果A 原子与H 原子距离非常近,也许形成了共价键,距离比较远时,可能只存在范德华作用,距离介于两者之间时,则可能形成了氢键。这一基于距离认识相互作用方式的表述,您认同吗?
题目4:如果您认为与氢原子形成氢键的电负性原子或基团必须具备孤对电子,依据是什么?
本次调研对象为在职高中化学教师,共回收153 份有效问卷,调研结果如表1所示。

表1 高中教师对氢键认识的现状
从问卷调查结果发现,教师对氢键的理解认识存在偏差,主要表现在:79.08%的教师认为氢键的形成需要有孤对电子,教师对氢键的特征认识和辨别视角仅局限于是否有孤对电子,对从化学学科视角认识氢键本质存在不足。对氢键本质认识只基于孤对电子,49.02%的调查对象不能基于氢键特征参数认识或辨别氢键。
二、吡咯分子间的氢键
1999年,Vladimír 等人通过研究吡咯二聚体得出吡咯分子间存在氢键的结论[1]。从分子间的库仑力角度对吡咯分子间氢键作用能进行计算。即:吡咯分子中N—H 中的H 原子近乎“裸露”,显示出很强的电正性,与其邻近的另一吡咯环分子内的大π 键致使这个吡咯环有很强的电负性,二者间具有较强的静电引力,形成氢键。
吡咯分子间氢键的方向如何呢?如图1所示。
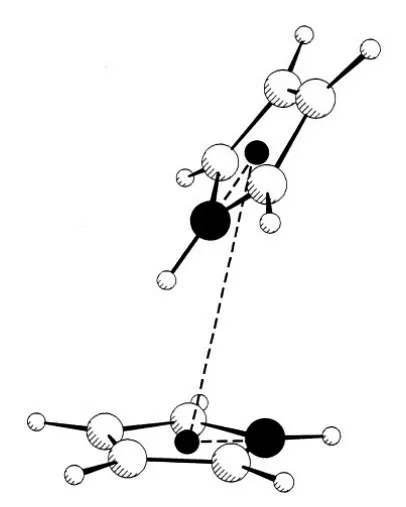
图1 吡咯二聚体的实验结构[1]
从图1 可以看出,两个分子间是反向非平行结构。这是因为一个分子的N—H 中电正性的H 原子与另一分子的π 体系负电荷之间相互吸引,以及两分子的π 体系相互排斥综合作用的结果,这叫作π-π 堆积。在高中教学中,π-π 堆积作用在高中教材阐述石墨结构时是有所体现的。石墨层状分子之间就存在π-π 平行堆积,由于两个六元环的π 体系相互排斥,π-π 堆积并不采取上下重叠方式,而是每一层六元环的中心正对相邻六元环的顶。
三、化学教材对氢键的界定
(一)人教版高中化学教材对氢键的界定
人教版高中教材《化学·物质结构与性质》(2019年版)将氢键的概念界定为:“由已经与电负性很大的原子形成共价键的氢原子与另一个电负性很大的原子之间的作用力。”教材从电负性视角阐述了氢键的形成,电负性较大的原子致使与其相连的氢原子具有较强的正电性,而另一个电负性较大的原子带有较强的负电性,因此氢键的形成是电性吸引的结果。教材对氢键的作用强度予以了特殊的说明:“与化学键比较,氢键属于一种较弱的作用力,比化学键小1~2 个数量级,不属于化学键。”这么说明氢键的形成不是轨道间的相互作用。
(二)大学化学教材对氢键的界定
表1 结果显示,30.07%的高中化学教师是根据大学教材的阐述,认为与氢形成氢键的电负性原子必须具有孤对电子。
大学教材对氢键的界定主要基于相互作用对象视角分析。《物理化学(第四版)》[2]和《新大学化学》[3]等强调氢键模型中N、O、F 原子强电负性对小半径原子以及孤对电子的作用。然而,《无机化学(第二版)》[4]、《物质结构》[5]和《普通化学(第六版)》[6]等主要从质子受体基团的存在以及键能和键长的特征性参数等角度对氢键进行了阐述,这几本化学学科书籍对氢键的解释包容性更强,其相互作用的发生不局限于孤对电子,而是扩大至质子受体,如吡咯分子的π 体系就可以作为氢键中的质子受体,对氢键本质的认识具有更强的解释力。
可见,有些学科书籍只基于常规氢键的形态对氢键及其形成条件进行阐述,而忽略了非常规氢键,这可能会导致高中教师对氢键概念的理解产生偏差。实际上,2011年IUPAC(国际纯粹与应用化学联合会)给出了最新的氢键定义,明确了常规氢键与非常规氢键的统一性[7]。吡咯分子间形成的就是非常规氢键。因此,对于氢键的理解和教学应充分考虑其多样性和复杂性。
四、教学策略
(一)认真研读,准确理解教材内容
1.教材是重要的课程资源,是教师教和学生学的重要参考资料。在新课程理念指导下,高中化学教材强调培养学生建立化学学科观念,体现了适应时代发展、社会需求的特征。教师应该认真研读教材中的每一个词句,准确理解其中的内涵。例如,教材强调氢键的本质是静电引力,即库仑力,而非以量子力学为基础的轨道间相互作用。所以孤对电子只是带有强电负性,而不是像配位键一样,孤对电子与空轨道间的相互作用。再如,关于“构造原理”,教材强调了这一思维模型和假想过程的科学普遍性。对于短周期元素原子第一电离能的锯齿状变化,从电子排斥能和半满结构的角度进行了深度解析,并强调了定量计算的重要性。教材集成两个相似但不同的概念,如原子的电离能和元素的电负性,着力提升学生的理解能力。这种综合方法不仅能够帮助学生深入理解科学知识,还提供了不同的认识视角。
2.教材通过“探究”栏目引导学生绘制电负性变化曲线和第一电离能变化曲线。对比和分析这两个概念,也可以促进知识深度学习和多角度理解认识。这种融合多视角的教学方法有助于增进学生对科学知识理解,增强科学思维能力。这为重新思考如何优化和改进课堂教学策略提供了一个新的角度。
(二)基于学科理解,建构认识视角和认识思路
1.引导学生建构认识视角与认识思路。科学思维方式主要包含两个要素:“从哪儿想”和“怎么想”。这两个要素在本质上属于认识视角和认识思路范畴。认识视角主要是指认识物质及其变化的特征与规律的角度或切入点。而认识思路则是指认识物质及其变化的特征与规律的程序、路径或框架。这两个方面对于学生找到解决问题的突破口以及构建解决问题的框架具有重要价值[8]。新的教学课程已经将“基本思路与方法”纳入化学课程内容。因此,教师在教学过程中应该注重引导学生建构认识视角,并总结和概括认识思路。例如,在教授氢键时,教师可以引导学生观察不同的氢键、共价键、范德华力的作用能数据和作用距离。在对数据进行比较分析的基础上,引导学生构建键能和键长认识视角,并形成基于键能与键长判断化学相互作用类型的一般思路。
2.教师在教学过程中,还应该注重显性化和结构化地呈现认识视角,以落实化学课程内容,进一步发展学生的科学思维方式。例如,在教授“水溶液中物质转化程度的探究”时,教师可以设计三个学习板块,其中学习板块一为认识水体系中物质的转化程度,学习板块二为改变水体系中物质的转化程度。在前两个板块中帮助学生建构浓度商和反应耦合视角认识和改变水体系中物质的转化程度。学习板块三为基于浓度商和耦合视角评价一项前沿研究成果以评价学生的学习成果。实践研究表明,这种教学方式能够将大概念(水体系中物质的转化程度)的建构与学生科学思维方式的培养有机结合起来,从而有效地促进学生科学思维素养的发展[9]。
(三)转变教学模式,从传授化学知识到培养化学思维
1.基于学科前沿,转变知识理解。教师需要根据IUPAC 在2011年发布的氢键定义,结合课程标准进行教学,不再执着于过去多年形成的固有理解。教师不仅要关注化学学科的最新发展,还要紧跟国际科学教育的最新研究动向。例如,Talanquer 提出转变教学方式应注重开发和实施新型课程,深入地讲解核心理念而非涵盖多个主题,将不同单元的核心理念以明确定义的学习路径进行连接,引导学生了解并采用现代的化学思维和问题解决方式,同时让学生参与到实际的决策制定和问题解决活动中。这一方式代表了与传统化学教学截然不同的教育模式,将重点从传授化学知识转向培养学生的化学思维,有助于学生更好地应对21世纪化学研究和化学教育研究的实践、思考和应用[10]。例如,在“通过学科核心问题和教学视角来重塑化学思维”一文中,通过构建包含三个学科核心问题和12 个领域特定视角的化学思维框架,为培育化学思维提供了新的视角[11]。国际科学教育已经从“教知识”转向为“教思维”。
2.转变教学模式,培养思维方式。将教学焦点从传统的知识传授转变为培养学生的化学思维,这种转变符合21世纪的教育改革发展趋势,帮助学生更好地解决真实问题,提高学生对生产生活中实际问题和新知识学习问题的解决能力。在这个过程中,教师的角色不再仅仅是知识的传播者,更是引导者和促进者,通过多元化的教学方法,激发学生对氢键等化学概念的学习兴趣和探索精神,促使学生在学习过程中主动思考、积极探索。在素养的培育过程中,强调知识、技能、态度的整合与超越[12]。
