基于UHPLC-Q-Orbitrap HRMS和HPLC-DAD法研究不同干燥方式对马蓝叶化学成分的影响
2023-11-27贺亚男谢慧娟纪奇森张定堃
苏 娟,贺亚男,杨 鑫,谢慧娟,纪奇森,杨 明,张定堃*,韩 丽*
•药剂与工艺·
基于UHPLC-Q-Orbitrap HRMS和HPLC-DAD法研究不同干燥方式对马蓝叶化学成分的影响
苏 娟1,贺亚男1,杨 鑫1,谢慧娟1,纪奇森2,杨 明3,张定堃1*,韩 丽1*
1. 成都中医药大学 药学院西南特色中药资源国家重点实验室,四川 成都 611137 2. 雅安迅康药业有限公司,四川 雅安 625600 3. 江西中医药大学 现代中药制剂教育部重点实验室,江西 南昌 330004
研究阴干、晒干、真空冷冻干燥、热风干燥4种干燥方式对马蓝叶化学成分的影响,寻找差异成分,并建立HPLC-DAD同时定量分析5种吲哚类生物碱成分的方法,以期为建立规范的马蓝叶干燥方式提供理论依据。利用UHPLC-Q-Orbitrap HRMS对4种干燥处理的马蓝叶进行定性分析,并结合热图聚类分析(heat map clustering analysis,HCA)、主成分分析(principal component analysis,PCA)和正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)筛选差异成分。共鉴定出67个共有化合物。HCA和PCA将阴干和热风干燥归为一类。OPLS-DA筛选出14个差异成分,多为生物碱类,且呈现出不同的变化规律。HPLC-DAD结果表明,不同干燥方式马蓝叶中的5种吲哚类生物碱含量存在明显差异。其中,热风干燥样品的靛蓝含量最高,靛玉红含量最低;阴干样品的靛红、色胺酮、靛玉红含量最高。不同的干燥方式对马蓝叶的品质有明显影响。热风干燥和晒干有利于吲哚苷水解合成靛蓝,但靛红和靛玉红的含量较低。而阴干和真空冷冻干燥样品的靛蓝含量较低,而靛玉红含量较高。阴干和热风干燥能显著提高马蓝叶药效成分的总含量。建议在初加工马蓝叶时使用阴干或热风干燥,为进一步探究马蓝叶的产地加工方式提供了数据支持,同时也为评估马蓝叶的质量提供了技术支持。
马蓝叶;UHPLC-Q-Orbitrap HRMS;HPLC-DAD;靛蓝;靛玉红;吲哚苷;靛红;色胺酮;合成途径;多元统计分析
马蓝叶(南大青叶)是福建的道地药材,属于爵床科板蓝属多年生草本植物,具有清热解毒、凉血消斑、泻火定惊的功效[1]。现代药理研究表明,马蓝叶有抗菌、抗病毒、抗内毒素、抗癌、增强免疫等作用,临床上主要用于防治流感、流脑、病毒性肝炎等[1-2]。由于马蓝茎叶种植范围大、易栽培和产量高,目前被广泛用作生产青黛的主要植物来源。
产地初加工是中药材生产的关键环节,直接影响到饮片的质量,其中干燥方式是内外质量的决定性因素[3]。研究发现新鲜植物中的胞内酶可以分解有效成分(次生代谢物等),未经干燥或杀青(杀酶)的新鲜植物放置时间越长,其次生代谢物的含量降低也更明显[3]。此外,干燥过程中的温度和含水量的变化会影响植物中的正常代谢以及生理生化过程的稳态,诱导与次生代谢产物合成相关酶的表达,从而促进次生代谢产物的生成[4]。
马蓝叶的主要化学成分包括生物碱类、黄酮类、五环三萜类等次级代谢产物,其中靛蓝、靛玉红是主要药效成分[5]。已有研究证明,不同的干燥方式会明显影响马蓝叶中的靛蓝和色胺酮含量,然而目前市售的马蓝叶并没有统一的干燥方法,导致其质量参差不齐。因此,本实验采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UHPLC-Q- Orbitrap HRMS)技术[6]结合多变量模式识别方法[主成分分析(principal component analysis,PCA)与正交偏最小二乘-判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)]对马蓝叶在不同干燥方式下进行系统评价,寻找差异化学成分,为阐明不同干燥方式马蓝叶中药效成分的变化规律和机制提供参考,也为建立规范化的马蓝叶干燥方式提供了数据支持。
1 仪器与材料
1.1 仪器
Vanquish型超高效液相色谱联用Q Exactive四极杆-静电场轨道阱高分辨质谱仪、Ultimate 3000型高效液相色谱仪,美国Thermo Fisher Scientific公司;Thermo Scientific AccucoreTMC18色谱柱(100 mm×3 mm,2.6 μm),美国Thermo Fisher Scientific公司;Welchrom-C18色谱柱(250 mm×4.6 mm,5 μm),月旭科技(上海)股份有限公司;KQ-500DE型超声波清洗机,昆山市超声仪器有限公司;BT25S型1/10万分析天平,德国Sartorius公司;CR-400型色彩色差计,日本柯尼卡美能达株式会社;FEI Inspect F50型扫描电子显微镜(SEM),美国Thermo Fisher Scientific公司;MB25型水分测定仪,奥豪斯仪器(常州)有限公司。
1.2 材料
马蓝于2022年10月由四川迅康公司提供,经成都中医药大学药学院西南特色中药资源国家重点实验室韩丽教授鉴定,为爵床科板蓝属植物马蓝(Nees) Bremek.,实验所需的2批药材分别采摘于10月上旬和下旬,均来自于四川雅安。
-酪氨酸,批号CHB-L-010,购自成都克洛玛生物科技有限公司;对照品靛红(批号DSTDD01820)、靛玉红(批号DSTDD012201)、吲哚苷(批号DST220317-664)、色胺酮(批号DST 200611-256)、靛蓝(批号DSTDD008801)、吲哚(批号AFCB1556)、-精氨酸(批号DSTDJ021701)、-正亮氨酸(批号DST201101-152)、松脂素-β--吡喃葡萄糖苷(批号DS0024-0020)均购自成都德思特生物技术有限公司,所有对照品质量分数均大于95%;对照品毛蕊花糖苷,批号AF21081201,购自成都埃法生物科技有限公司,质量分数大于98%;水为超纯水,甲醇为色谱级;,-二甲基甲酰胺(,-dimethylformamide,DMF)、二甲亚砜(dimethyl sulfoxide,DMSO)为分析级。
2 方法与结果
2.1 样品干燥
用清水冲洗新鲜马蓝叶的表面泥土,然后用吸水纸吸取表面多余水分。将马蓝叶片分成4份,每份1500 g,分别进行阴干、晒干、真空冷冻干燥、热风干燥,干燥的最后标准是叶片脆碎。阴干组:将样品铺在单层托盘上,放置于通风阴凉处3~4 d;晒干组:将样品铺在单层托盘上,然后将干燥托盘暴露在22~28 ℃的阳光下,直到表皮起皱;真空冷冻干燥组:先在−20 ℃冰箱中预冻3 h,于真空冷冻干燥机(真空度6.0 Pa;冷阱温度−60 ℃)干燥;热风干燥组:将马蓝叶置于40 ℃的鼓风式恒温干燥箱中干燥。干燥后,将样品用打粉机打碎成细粉,过40目筛后储存在4 ℃下。
2.2 含水量测定
分别精密称取4种干燥方式下的马蓝叶粉末2 g于水分测定仪的样品盘中,均匀平铺,水分测定仪自动测定不同干燥方式马蓝叶粉末样品的含水率,结果见表1。根据表1可知,不同干燥方式的马蓝叶样品的含水率有所不同。从高到低,4种干燥方式的马蓝叶粉末含水率依次为阴干、晒干、热风干燥和真空冷冻干燥。自然干燥(阴干和晒干)干燥耗时长、效率较低、含水率较高,而相较于自然干燥,真空冷冻干燥、热风干燥耗时更短,干燥效率更高。因此,机械干燥能有效提高干燥速度,达到快速降低水分的目的。
表1 不同干燥方式下马蓝叶粉末水分含量(, n = 3)
2.3 色泽测定
以*=100、*=0、*=0为参照校正色,经校准后,分别取4种不同干燥方式处理的马蓝叶粉末(图1)测得各样品的*、*、*、Δ*。*值的正、负代表红色、绿色,*值的正、负代表黄色、蓝色,Δ*代表着总色差,数值越大表示与白板相比色差越大。不同干燥方式的马蓝叶粉末颜色测定结果见表2。不同干燥方式对样品的表观品质有显著影响(<0.05)。
真空冷冻干燥样品粉末的*、*、*分别为43.36±0.02、−7.57±0.01、17.69±0.01,与真空冷冻干样品相比,阴干、晒干、热风干燥样品粉末*、*均显著降低,*显著升高。这说明阴干、晒干、热风干燥这3种干燥方式的样品色泽变暗,比真空冷冻干样品少绿、少黄(多红、多蓝)。这可能是由于马蓝叶中糖类、氨基化合物、酚类物质,长时间放置在高温潮湿的环境中,易发生氧化反应和美拉德反应,高温环境还会加剧样品中的糖苷类物质发生降解,从而降低色泽。而真空冷冻干燥在亚大气压环境下干燥,会减少热损伤和氧化损伤,最大程度上保留了样品的色泽和营养成分。

图1 不同干燥方式马蓝叶粉末外观性状
表2 不同干燥方式下马蓝叶粉末颜色测定结果(, n = 3)
同列不同字母表示显著性差异(<0.05)
different letters in the same column indicate significant differences (< 0.05)
2.4 SEM观察
将各样品粉末分别用双面导电胶固定到样品台上,经离子溅射仪真空喷金镀膜后,置于SEM下进行观察并拍照。不同干燥方式的马蓝叶粉末的SEM观察结果见图2。结果表明,不同干燥方式的马蓝叶样品粉末的微观形态具有明显差异。阴干样品表面略微收缩,呈现团块状;晒干样品的表面皱缩更为明显,同时呈现团块状并出现裂痕;真空冷冻干燥样品表面相对平整,基本无皱缩,内部疏松多孔;热风干燥样品表面明显皱缩和凹陷,多呈实心团状。
2.5 基于UHPLC-Q-Orbitrap HRMS的化学成分分析
2.5.1 混合对照品溶液的制备 精密称取对照品-精氨酸、缬氨酸、-正亮氨酸、吲哚苷、靛红、松脂素-β--吡喃葡萄糖苷、毛蕊花糖苷、吲哚、靛蓝、靛玉红于25 mL量瓶中,加入适量DMSO,超声(150 W、40 kHz)溶解后用DMSO溶剂定容。取1 mL溶液于5 mL量瓶中,用色谱甲醇稀释,配制成质量浓度分别为64.0、84.4、66.4、90.0、75.6、120.4、88.0、135.2、78.4、57.6 μg/mL的混合对照品溶液,溶液过0.22 μm微孔滤膜后,供UHPLC-Q-Orbitrap HRMS检测分析。
2.5.2 供试品溶液的制备 精密称取4种干燥方式下的马蓝叶粉末0.5 g,置于具塞三角瓶中,加入DMSO 25 mL,超声(150 W、40 kHz)提取30 min,静置,8000 r/min离心(离心半径1 cm)5 min。精密移取上清液1 mL置10 mL量瓶中,加甲醇定容,过0.22 μm微孔滤膜,即得供试品溶液。
2.5.3 色谱条件 Thermo Scientific AccucoreTMC18色谱柱(100 mm×3 mm,2.6 μm,美国Thermo Fisher Scientific公司),以1%冰醋酸水溶液-甲醇为流动相,梯度洗脱:0~3 min,5%甲醇;3~5 min,5%~10%甲醇;5~10 min,10%~20%甲醇;10~15 min,20%~30%甲醇;15~20 min,30%~50%甲醇;20~25 min,50%~55%甲醇;25~30 min,55%~60%甲醇;30~35 min,60%~70%甲醇;35~36 min,70%~80%甲醇;36~40 min,80%~90%甲醇;40~45 min,90%甲醇;检测波长255 nm;体积流量0.3 mL/min;柱温为30 ℃;进样量为5 μL。
2.5.4 质谱条件 电喷雾离子源(ESI),正、负离子模式检测,喷雾电压+3.5 kV/−3.0 kV,辅助气加热温度350 ℃,鞘气体积流量35 arb,辅助气体积流量10 arb,离子传输管温度320 ℃。扫描模式为一级质谱全扫描结合自动触发二级质谱扫描模式(full MS/ dd-MS2),一级分辨率35 000,二级分辨率17 500,离子扫描范围/50~1500,碰撞能量梯度为20、40、60 eV。
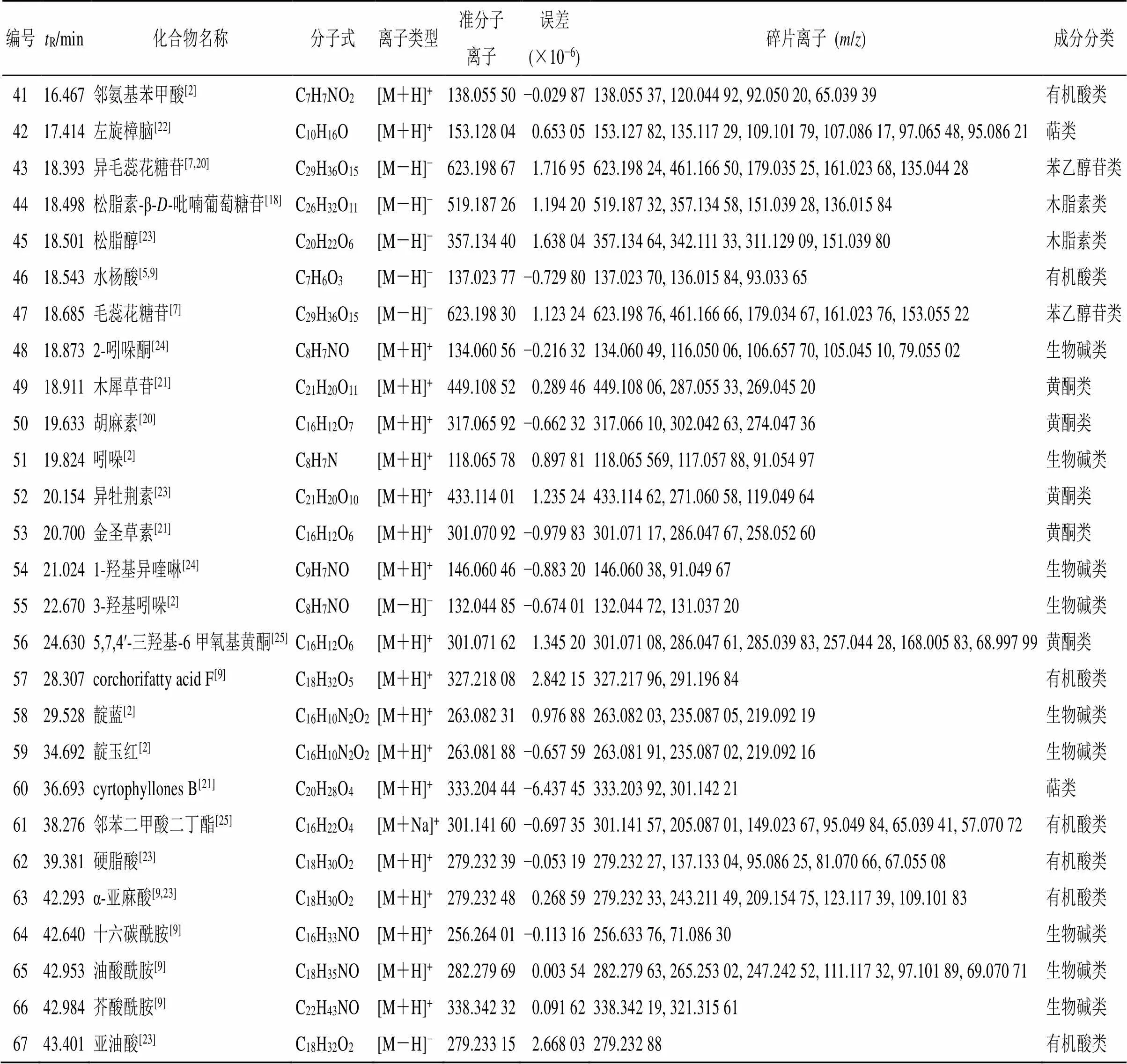
2.5.5 化学成分鉴定 将采集得到的原始数据导入Compound Discoverer 3.0软件进行峰对齐和峰提取。利用提取得到的分子离子色谱峰、同位素峰拟合出可能的分子式,并将二级碎片实测谱图与mzCloud网络数据库及mzVaul数据库进行匹配。设置匹配结果过滤参数为:一级及二级质量偏差1×10−5,匹配度分值高于80。对过滤后的离子与数据库中的化合物信息及对照品进行比对,结合相关文献和在线数据库(PubChem、Human Metabolome Database、CNKI)对化学成分进一步分析鉴定。在正、负离子模式下,对照品和供试品溶液的总离子流图如图3所示。鉴定结果(表3)显示,从4种不同干燥方式的样品中共鉴定出67个共有成分,包括17种生物碱、17种有机酸、13种氨基酸、6种核苷、5种黄酮、2种萜类、2种木脂素、2种苯乙醇苷、2种糖类、1种香豆素类成分。各成分的保留时间、质谱信息和结构鉴定见表3。
2.5.6 PCA和聚类分析 以共有峰的峰面积为变量,利用Metabo Analyst进行聚类分析、SIMCA-P 14.0进行PCA,以研究同种样品之间的相似性和不同种样品间的差异性的关系和趋势,结果见图4、5。热图(图4)结果表明,不同干燥方式的马蓝叶存在明显的分组模式,样品可聚为2类,其中阴干、热风干燥聚为一类,晒干、真空冷冻干燥聚为一类。PCA结果(图5)表明,不同干燥方式被分为3组,其中阴干、热风干燥样品为一组,晒干、真空冷冻干燥样品各为一组。阴干和热风干燥2组显示出部分重叠,表明这2组间的化学成分含量较为相似,而晒干和真空冷冻干燥组在PC2方向上的间距较大,说明这2组样品的成分含量存在差异。4组组内样本间的离散均较小,表明组内均一性良好。因此,综合PCA和聚类分析结果发现,不同干燥方式马蓝叶的化学成分含量存在差异,阴干和热风干燥样品相似,而与晒干、真空冷冻干燥样品化学成分含量差异明显。
2.5.7 差异成分分析 利用SIMCA-P 14.0将阴干、晒干、热风干燥组分别与真空冷冻干燥组进行OPLS- DA和S-plot分析,并以VIP>1和|p(corr)|>0.58为标准筛选出显著差异化合物,结果见图6。
由图6-a~c可知,各组OPLS-DA模型均表现出更明显的分离趋势。OPLS-DA模型验证结果中各组参数指标均大于0.85且2>0.9,说明模型构建良好,预测性可靠。散点得分图(S-plot)可以表示组间的差异成分,数据点离原点越远,则该变量对样本分组差异的贡献越大。
如图6-d~f所示,共筛选出个14个差异化合物。阴干真空冷冻干燥筛选出10种差异化合物,其中上调的化合物有3种,包括靛蓝、靛红、葡萄糖酸,下调的化合物有7种,包括吲哚苷、2-吲哚酮、靛玉红、绿原酸、奎宁酸、芥酰胺酸、缬氨酸;晒干真空冷冻干燥筛选出12种差异化合物,其中上调的化合物有4种,包括靛蓝、缬氨酸、金圣草素、5,7,4′-三羟基-6甲氧基黄酮,下调的化合物有8种,包括靛玉红、吲哚苷、绿原酸、靛红、芥酰胺酸、毛蕊花糖苷、2-吲哚酮、油酸酰胺;热风干燥真空冷冻干燥筛选出10种差异化合物,其中上调的化合物有2种,包括靛蓝、5,7,4′-三羟基-6甲氧基黄酮,下调的化合物有8种,包括吲哚苷、靛玉红、绿原酸、毛蕊花糖苷、2-吲哚酮、奎宁酸、缬氨酸、芥酸酰胺。
此外,分析发现靛蓝、靛红、靛玉红、吲哚苷、2-吲哚酮这5种吲哚类生物碱是3个比较组模型的共有差异代谢物。因此,不同干燥方式会对马蓝叶的代谢产生影响,尤其是与靛蓝、靛玉红等吲哚类生物碱相关的代谢途径。
2.6 HPLC法吲哚生物碱含量测定
2.6.1 对照品溶液的制备 精密称取靛蓝、靛玉红、色胺酮、靛红、吲哚苷对照品适量于10 mL量瓶中,加入DMF适量,超声溶解后定容,配制成质量浓度为108.0、132.0、121.0、68.8、142.0 μg/mL的混合对照品溶液。
2.6.2 供试品溶液的制备 精密称取马蓝叶粉末10 mg于10 mL量瓶中,加入适量DMF,超声(150 W、40 kHz)提取30 min,静置,加DMF定容,过0.22 μm微孔滤膜,即得供试品溶液。
2.6.3 HPLC条件 色谱柱为Welchrom-C18柱(250 mm×4.6 mm,5 μm);以纯水-甲醇为流动相,梯度洗脱:0~8 min,20%~40%甲醇;8~12 min,40%~44%甲醇;12~17 min,44%~70%甲醇;17~37 min,70%~85%甲醇;37~42 min,85%甲醇;42~47 min,85%~20%甲醇。
2.6.4 线性关系考察 按照“2.6.1”项下方法制备对照品溶液,并以DMF为溶剂,逐级稀释至7个不同质量浓度,得到系列对照品溶液。按照“2.6.3”项下HPLC条件测定不同梯度质量浓度混合对照品溶液中各成分的峰面积。以对照品质量浓度为横坐标(),峰面积值为纵坐标()绘制标准曲线,进行线性回归计算,得到线性回归方程:吲哚苷=0.132 8+0.005 0,2=1.000 0,线性范围0.043 2~108.000 μg/mL;靛红=0.189 7+0.022 3,2=0.999 9,线性范围0.058~132.000 μg/mL;色胺酮=0.210 6+0.003 4,2=1.000 0,线性范围0.048 4~121.000 μg/mL;靛蓝=0.324 9+ 0.290 4,2=0.999 5,线性范围0.133 6~66.800 μg/mL;靛玉红=0.843 6+0.005 5,2=1.000 0,线性范围0.056 8~142.000 μg/mL;结果回归方程2值均大于0.999,表明线性关系考察结果良好。
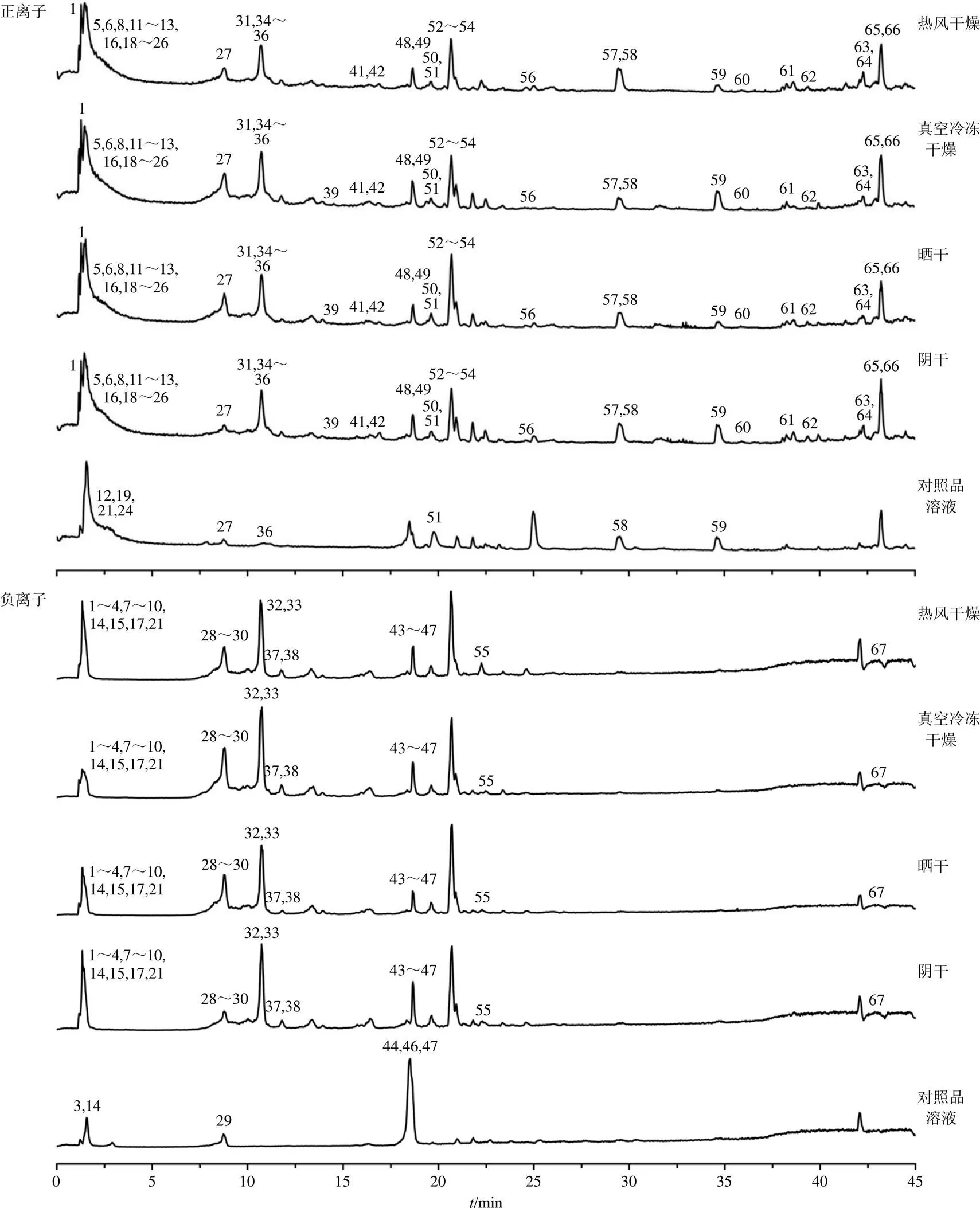
图3 混合对照品和4种不同干燥方式马蓝叶粉末UHPLC-Q-Exactive MS正、负离子模式的总离子流图
续表3
2.6.5 精密度试验 取吲哚苷、靛红、色胺酮、靛蓝、靛玉红混合对照品溶液,按照“2.6.3”项下色谱条件连续测定6次,计算各成分峰面积的RSD值。结果表明吲哚苷、靛红、色胺酮、靛蓝、靛玉红峰面积的RSD分别为0.13%、0.19%、0.25%、0.53%、0.19%,均小于5%,精密度试验结果良好。
2.6.6 重复性试验 根据“2.6.2”项下的制备方法平行制备马蓝叶阴干样品溶液6份,按照“2.6.3”项下色谱条件测定6份样品溶液中吲哚苷、靛红、色胺酮、靛蓝、靛玉红的峰面积,利用标准曲线计算各成分质量分数的RSD值。结果表明吲哚苷、靛红、色胺酮、靛蓝、靛玉红的峰面积RSD分别为3.24%、4.16%、2.18%、0.63%、0.40%,均小于5%,精密度试验结果良好。
2.6.7 稳定性试验 根据“2.6.2”项下的制备方法阴干马蓝叶样品溶液,按照“2.6.3”项下色谱条件测定,分别在0、2、4、6、8、10、12、24 h吲哚苷、靛红、色胺酮、靛蓝、靛玉红峰面积的RSD值,分析样品在24 h内的稳定性。结果表明吲哚苷、靛红、色胺酮、靛蓝、靛玉红峰面积的RSD分别为0.86%、2.72%、3.94%、1.38%、0.36%,马蓝叶样品溶液在24 h内的稳定性良好。
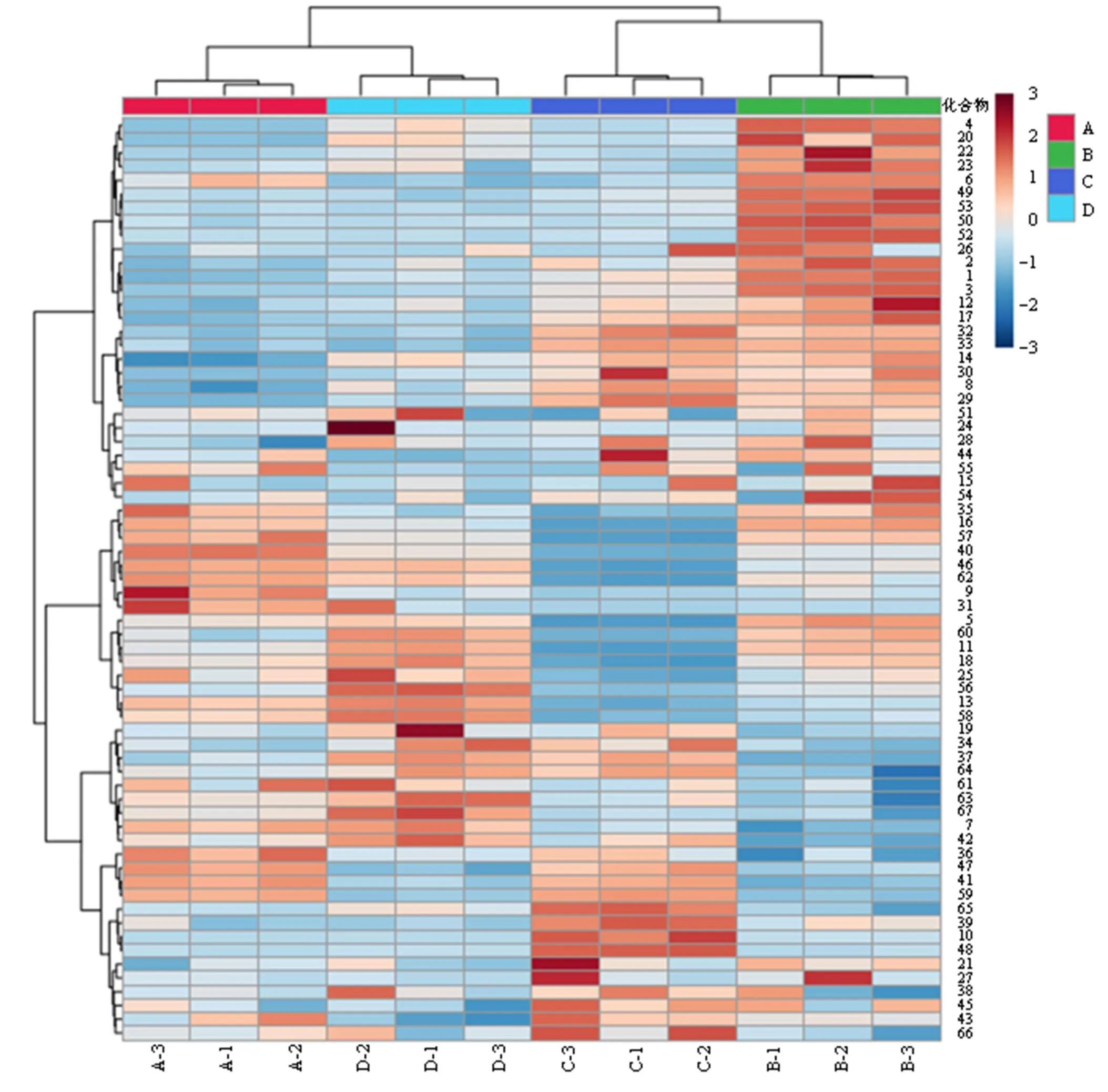
A-阴干 B-晒干 C-真空冷冻干燥 D-热风干燥 1~67-化合物峰号(图5、6同)
2.6.8 加样回收率试验 精密称取6份已测定的马蓝叶阴干样品10 mg,分别加入与样品中等质量的吲哚苷、靛红、色胺酮、靛蓝、靛玉红对照品溶液,混合后,按照“2.6.2”项下制备方法进行制备,按照“2.6.3”项下色谱条件进行测定,计算加样回收率。结果吲哚苷、靛红、色胺酮、靛蓝、靛玉红的平均加样回收率分别为100.60%、101.20%、99.20%、96.59%、100.99%,RSD分别为3.87%、1.88%、1.74%、1.30%、2.50%。
2.6.9 吲哚生物碱含量测定 取4种不同干燥方式的马蓝叶样品,根据“2.6.2”项下方法制备样品溶液,按照“2.6.3”项下色谱条件进行分析,记录峰面积。根据线性关系计算吲哚苷、靛红、色胺酮、靛蓝、靛玉红5种生物碱的含量并进行含量方差分析(ANOVA)。不同的字母(a~d)代表各组在<0.05的水平上具有显著差异,无字母代表无显著差异,马蓝叶样品中各成分含量结果见表4。
4组马蓝叶样品中的吲哚苷、色胺酮、靛蓝含说明一定的干燥温度可能促进酶/微生物的活性,进而有助于植物代谢合成靛蓝,但会降低靛玉红(靛蓝的同分异构体)的含量。色胺酮的含量与文献报道[25]的后熟现象一致,即在低温低氧下真空冷冻干燥样品中的色胺酮含量最低,甚至有时含量过低而未检测到,而阴干、晒干、热风干燥样品的色胺酮含量均有增加,表现为阴干>晒干>热风干燥。这可能是由于阴干法干燥温度适中,干燥时间较长,其次是晒干、热风干燥,在药材未完全干透之前有利于色胺酮的后熟,致使其含量升高。以靛蓝、靛玉红为代表的吲哚生物碱类成分是马蓝发挥药效的重要物质基础。结合多元统计分析结果和HPLC含量测定结果,认为阴干和热风干燥更能明显提高靛蓝、靛玉红的总含量,保障马蓝叶的质量。
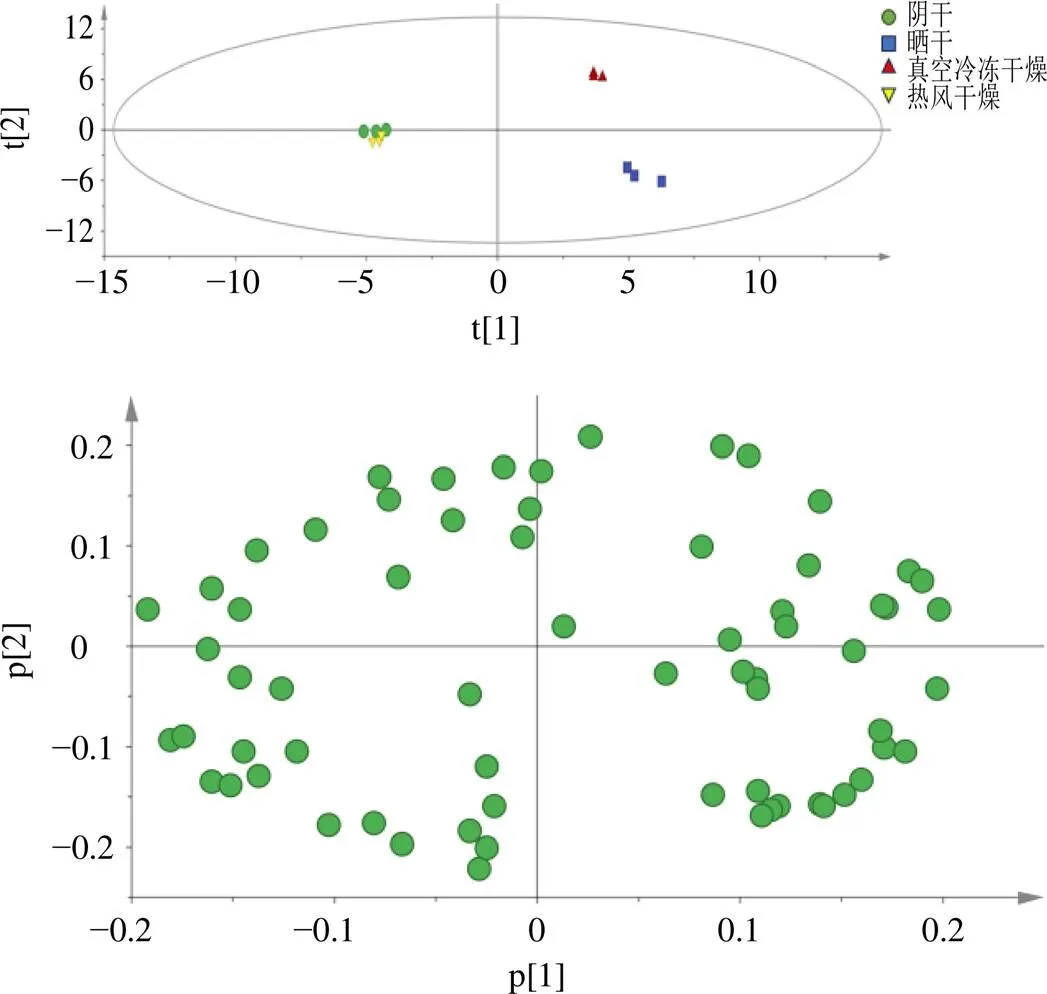
图5 不同干燥方式马蓝叶粉末PCA得分图和载荷图
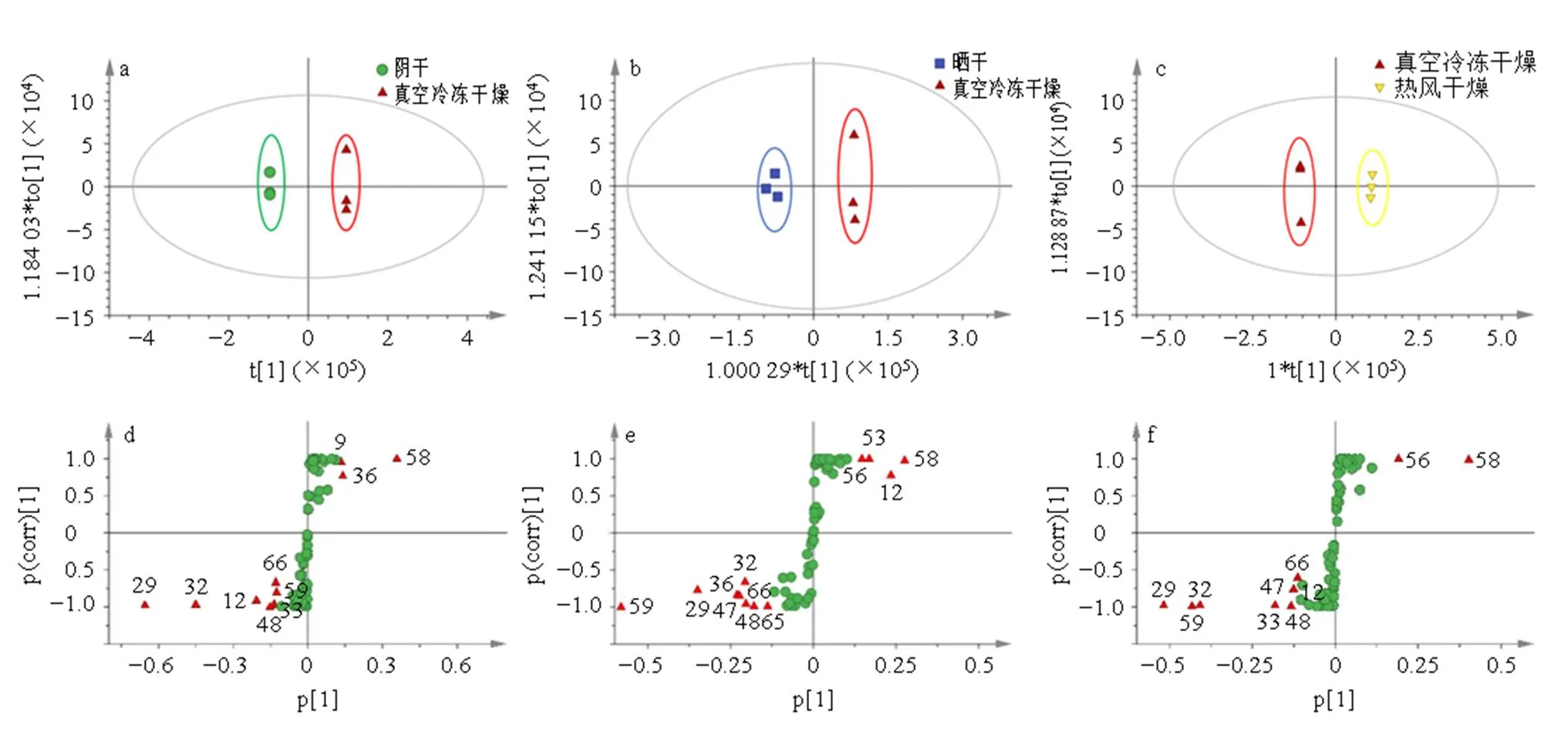
d~f图中三角形代表符合筛选条件的差异化合物的分子离子峰
2.7 不同干燥处理方式对靛蓝、靛玉红合成途径的影响分析
基于上述实验结果发现不同干燥方式对马蓝叶的化学成分有明显影响,尤其是吲哚类生物碱的含量,其原因可能是干燥过程中的温度和含水量变化会影响马蓝叶中的正常代谢以及与次生代谢产物合成相关酶的表达和微生物的活性,所以导致靛蓝、靛玉红等次生代谢产物含量的变化。

表4 不同干燥方式马蓝叶中的吲哚生物碱含量(, n = 3)
同行的不同的字母(a~d)代表各组在<0.05的水平上具有显著差异,“−”表示未检测出
different letters (a—d) of the peer group represented significant differences at< 0.05 level, “−” indicates that alarm is not detected
靛蓝、靛玉红合成途径(图7)[15-16,19]有2种方式:莽草酸途径和分解储存在液泡中的前体物质(吲哚苷、大青素B、大青素C等成分)。通过分析合成途径发现靛红、2-吲哚酮、2-羟基吲哚、3-羟基吲哚是合成靛蓝、靛玉红的关键物质。
进一步对合成途径中的多元成分进行了方差分析,结果(表5)显示,不同干燥组的莽草酸合成途径中的多元活性成分相对峰强度差异较小,然而尿苷二磷酸葡萄糖、吲哚苷、靛红、2-吲哚酮的相对峰面积含量显示出明显差异。由于3-羟基吲哚和吲哚的稳定性较差且易氧化,所以二者的相对峰强度未体现差异。因此,不同干燥方式可能主要通过影响吲哚苷的合成和水解进而影响2-羟基吲哚、3-羟基吲哚、靛红、2-吲哚酮等中间物质的生成,最终影响靛蓝、靛玉红的含量。
真空冷冻干燥是在低温低氧的条件下进行干燥,对植物的代谢影响较小,各成分的含量可能更接近最初的状态。相比之下,阴干在较温和的条件下干燥,水分挥发速度较慢,干燥时间长,吲哚苷水解的时间更长;热风干燥温度较高,会提高β--葡萄糖苷酶的活性,从而提高吲哚苷水解速率。晒干样品中的吲哚苷含量则介于阴干和热风干燥之间。
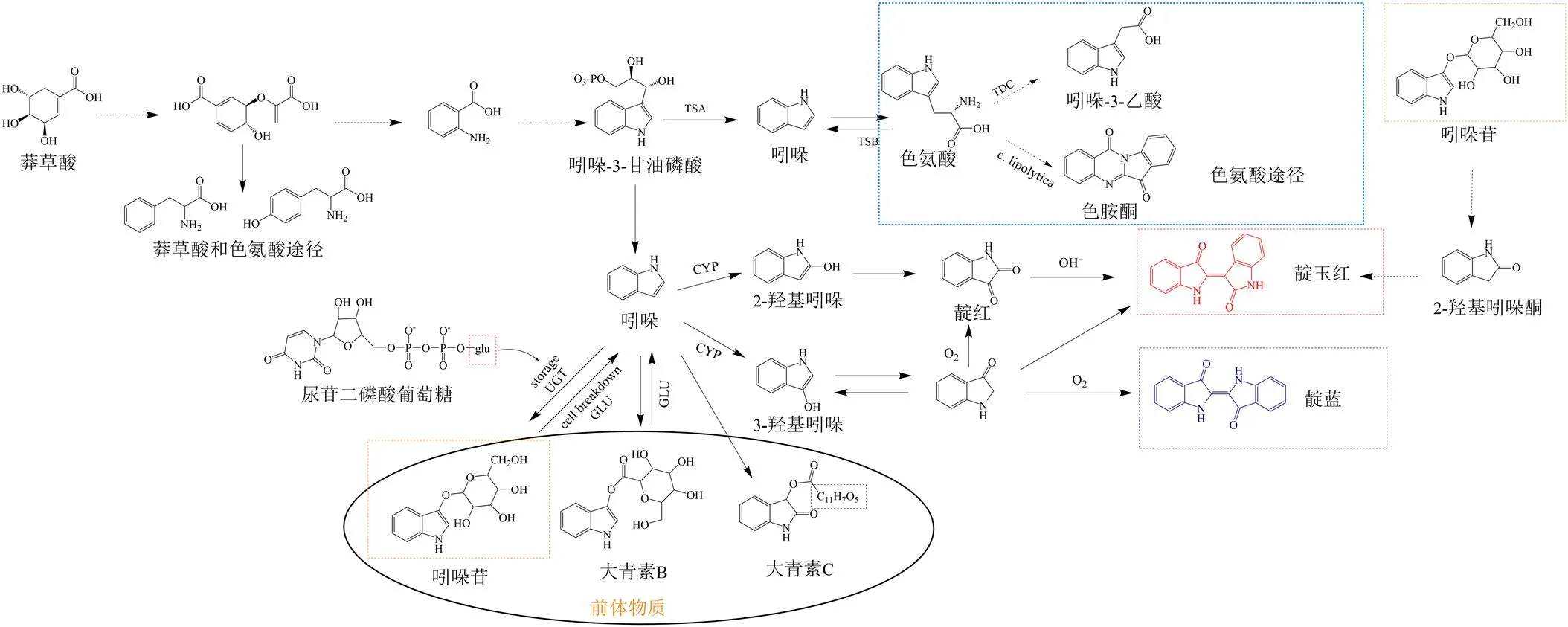
CYP-细胞色素酶P450 glu-葡萄糖 UGT-UDP-葡糖基转移酶 GLU-β-D葡萄糖苷酶,虚线表示多步反应
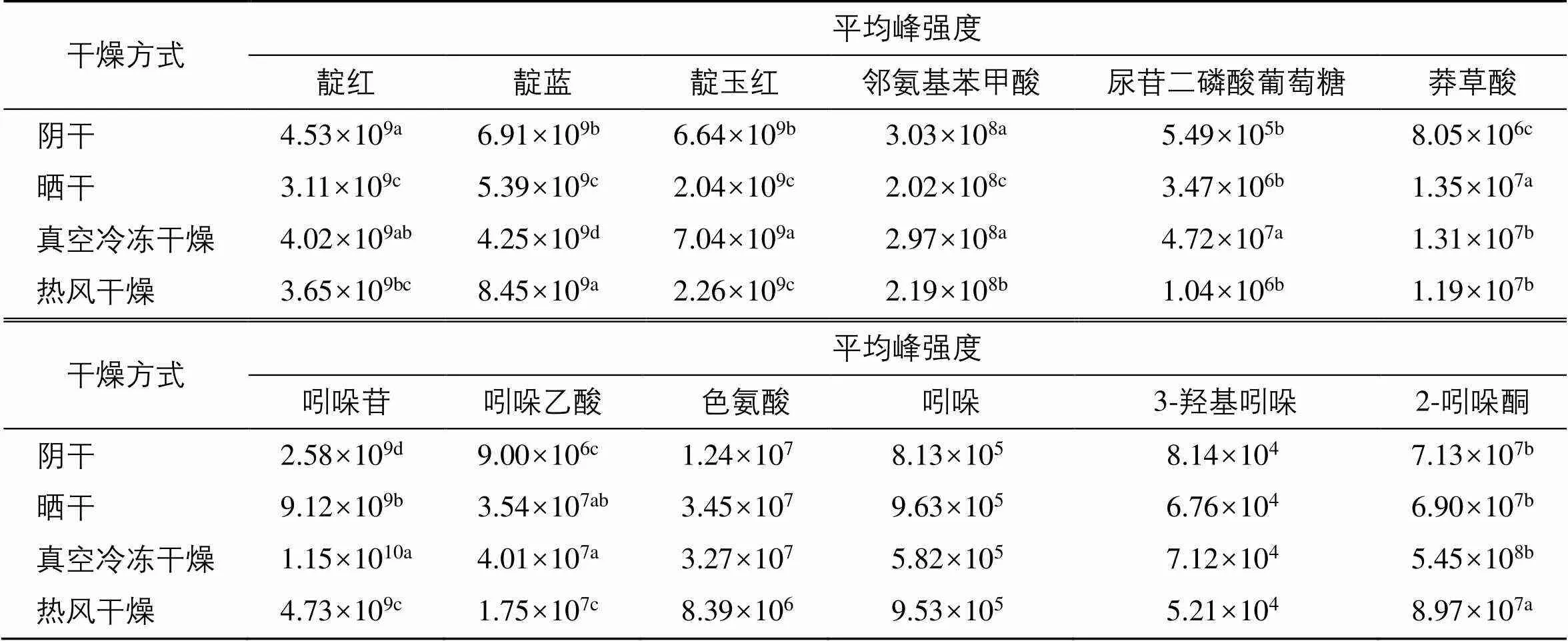
表5 不同干燥方式马蓝叶中多元活性成分的方差分析(n = 3)
不同的字母(a~d)代表各组在<0.05的水平上具有显著差异
different letters (a to d) represented significant differences among groups at< 0.05 level
与真空冷冻干燥相比,其余3种方式的靛蓝含量均升高,而靛玉红含量均降低,差异显著。除阴干样品的靛红含量有所上升外,晒干、热风干燥样品的靛红和2-吲哚酮含量以及阴干样品的2-吲哚酮含量均下降,说明阴干、晒干、热风干燥的条件更有利于促进合成靛蓝。此外,靛蓝的耐光、耐热性较差,吲哚苷水解合成靛蓝、靛玉红的过程与氧气、温度、水分、光照等因素均有一定关联。因此,对于影响该过程的因素以及干燥工艺的最佳参数还需要进行深入探索。
3 讨论
本实验利用UHPLC-Q-Orbitrap HRMS和多元统计分析技术,分析出不同干燥处理马蓝叶样品中的显著差异成分和主要药效成分(靛蓝、靛玉红)含量变化规律及原因。聚类分析和PCA将阴干和热风干燥归为一类,OPLS-DA筛选出14个差异化合物,多数为生物碱类成分,其中5种吲哚类生物碱成分为各组的共有差异化合物。HPLC-DAD测定和多元活性成分的方差分析进一步显示阴干和热风干燥样品中主要药效成分(靛蓝、靛玉红)的总量更高。在阴干、晒干、真空冷冻、热风干燥4种干燥方式中,热风干燥、晒干的温度会提高β--葡萄糖苷酶和与靛蓝合成相关的微生物的活性,促进吲哚苷分解,进一步转化和合成靛蓝,但温度的升高会导致靛红和2-吲哚酮等中间成分含量减少,进而导致靛玉红含量降低,而阴干、真空冷冻干燥样品的靛玉红含量较高。因此,建议马蓝叶初加工时采用阴干或热风干燥的方法。本研究结果为深入研究马蓝叶的产地加工方式提供数据支撑,并解释了不同干燥方式导致马蓝叶中靛蓝、靛玉红等药效成分含量差异的机制。此外,还建立了一种同时测定5种吲哚类生物碱成分含量的方法,该方法具有灵敏度高,重复性和专属性好的特点,为评价马蓝叶的质量提供了一定的技术支持。
利益冲突 所有作者均声明不存在利益冲突
[1] 樊莉, 李婉姝, 刘望才, 等. 马蓝叶化学成分的分离与鉴定 [J]. 中药材, 2023, 46(3): 648-651.
[2] 马乐乐, 许润春, 张定堃, 等. 古今青黛饮片形式的变化: 靛花与粗靛质量的系统对比研究 [J]. 中国中药杂志, 2021, 46(13): 3188-3197.
[3] 董娟娥, 龚明贵, 梁宗锁, 等. 干燥方法和提取温度对板蓝根、大青叶有效成分的影响 [J]. 中草药, 2008, 39(1): 111-114.
[4] 李泽娜, 刘畅, 吴乾峰, 等. 基于超高效液相色谱-串联质谱的不同加工干燥方法下的杜仲代谢组学分析 [J]. 分析测试学报, 2022, 41(7): 998-1006.
[5] Chen J, Zhu Z P, Gao T H,.and: A systematic review on ethnopharmacology, phytochemistry and pharmacology [J]., 2022, 283: 114648.
[6] 孙志, 张媛媛, 周胜楠, 等. 基于UHPLC-Q-Orbitrap HRMS和生物信息学探讨瓜蒌薤白汤治疗冠心病的潜在药效物质基础和作用机制 [J]. 中草药, 2022, 53(18): 5613-5624.
[7] 徐志琴, 赵志敏, 马庆, 等. 南板蓝根化学成分、药理作用及质量控制研究进展 [J]. 世界科学技术—中医药现代化, 2021, 23(9): 3365-3375.
[8] 黄玉香, 谭何新, 于剑, 等. 药用植物生物碱次生代谢工程研究进展 [J]. 中草药, 2016, 47(23): 4271-4281.
[9] 田世民, 谢锦, 尚强, 等. 基于UPLC-Q-Orbitrap HRMS和GC-MS技术的抗病毒颗粒化学成分分析 [J]. 中国医院药学杂志, 2023, 43(2): 134-144.
[10] 沈继伟, 马小毛, 魏道智. 马蓝邻氨基苯甲酸合成酶基因的克隆及生物信息学分析 [J]. 基因组学与应用生物学, 2020, 39(12): 5773-5780.
[11] 雷黎明, 潘清平. 板蓝根化学、药理、质量及提取方法的研究进展 [J]. 时珍国医国药, 2007, 18(10): 2578-2580.
[12] 刘泽玉, 苏柘僮, 杨明, 等. 马蓝叶中β-葡萄糖苷酶的提取及酶学性质的研究 [J]. 中草药, 2010, 41(9): 1461-1464.
[13] Marcinek H, Weyler W, Deus-Neumann B,. Indoxyl-UDPG-glucosyltransferase from[J]., 2000, 53(2): 201-207.
[14] 李柯城, 袁铭铭, 代敏, 等. 大青叶中生物碱类成分研究 [J]. 中成药, 2022, 44(12): 3879-3884.
[15] 郭志英, 李卿, 吴循循, 等. 马蓝WRKY转录因子家族生物信息学及表达特征分析 [J]. 药学学报, 2022, 57(9): 2864-2875.
[16] 张一鸣, 黄元贞, 万会花, 等. 植物中靛蓝生物合成途径研究进展 [J]. 中国中药杂志, 2020, 45(3): 491-496.
[17] 胡永胜. 菘蓝中木脂素生源合成途径五个关键酶基因的克隆与功能分析 [D]. 上海: 第二军医大学, 2010.
[18] 张东东. 板蓝根化学成分及其抑制一氧化氮释放活性研究 [D]. 上海: 上海中医药大学, 2020.
[19] 林文津. 福建马蓝有效成分累积及其分子基础研究 [D]. 福州: 福建农林大学, 2015.
[20] 何雨晴, 陈迪路, 张郑洁, 等. UPLC-Q-TOF-MS联合UNIFI筛查平台快速分析湘产大青叶化学成分 [J]. 亚太传统医药, 2021, 17(5): 33-37.
[21] 罗文艳, 段和祥, 刘绪平, 等. HPLC-一测多评法同时测定大青叶中6种抗肿瘤活性成分的含量 [J]. 中国药房, 2018, 29(19): 2635-2639.
[22] 姬志强, 张建民, 李永丽, 等. 大青叶脂溶性成分的GC-MS分析 [J]. 中国药师, 2014, 17(6): 950-952.
[23] 杨立国, 王琪, 苏都那布其, 等. 菘蓝属植物化学成分及药理作用研究进展 [J]. 中国现代应用药学, 2021, 38(16): 2039-2048.
[24] 聂黎行, 王馨平, 黄烈岩, 等. 板蓝根化学成分信息库的构建 [J]. 中国药学杂志, 2022, 57(6): 428-452.
[25] 徐志琴, 蔡铱妮, 陈奕弟, 等. 马蓝叶化学成分研究 [J]. 中药材, 2021, 44(8): 1875-1879.
[26] 廖维, 宋娇, 韩丽, 等. 天然产物色胺酮的研究进展 [J/OL]. 天然产物研究与开发, 2022-09-30. https://kns. cnki.net/kcms/detail/51.1335.Q.20220928.1836.002.html.
Effects of different drying methods on chemical composition ofleaves based on UHPLC-Q-Orbitrap HRMS and HPLC-DAD methods
SU Juan1, HE Ya-nan1, YANG Xin1, XIE Hui-juan1, JI Qi-sen2, YANG Ming3, ZHANG Ding-kun1, HAN Li1
1. State Key Laboratory of Southwestern Chinese Medicine Resources, School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. Ya’an Xunkang Pharmaceutical Co., Ltd., Ya’an 625600, China 3. Key Laboratory of Modern Preparation of TCM, Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China
The effects of four drying methods by drying in the shade, sun drying, vacuum freeze-drying, and hot air drying on the chemical components of Malan () leaves were studied to searched for the differential compounds, and a method for simultaneous quantitative analysis of five indole alkaloids was established by HPLC-DAD, in order to provide theoretical basis for establishing standardized drying methods ofleaves.UHPLC-Q-Orbitrap HRMS was used to qualitatively analyze theleaves with four drying methods, and heat map clustering analysis (HCA), principal component analysis (PCA) and orthogonal partial least square-discriminant analysis (OPLS-DA) were used to screen the differential compounds.A total of 67 common compounds were identified. Heat map clustering analysis (HCA) and PCA analysis classified the drying in the shade and the hot air drying in one class. OPLS-DA screened 14 differential components, most of which were alkaloids, and showed different change rules. The results of HPLC-DAD showed that the contents of five indole alkaloids inleaves were significantly different by different drying methods. Among them, the hot-air drying samples had the highest indigo content and the lowest indirubin content. The drying in the shade samples had the highest content of isatin, tryptanthrin and indirubin.Different drying methods have a significant impact on the quality ofleaves. Hot air drying and sun drying favor the hydrolysis of indican to synthesize indigo, but the content of isatin and indirubin is lower. Drying in the shade and vacuum freeze-dried samples had a lower indigo content, while indirubin a higher content. Drying in the shade and hot air drying significantly increased the total content of theleaves efficacy components. It is suggested to use drying in the shade and hot air drying in the initial processing of theleaves, which provides data support for further study of the processing methods of theleaves, and also provide technical support for evaluating the quality of theleaves.
leaves; UHPLC-Q-Orbitrap HRMS; HPLC-DAD; indigo; indirubin; indican;isatin; tryptanthrin; synthetic pathway; multivariate statistical analysis
R283.6
A
0253 - 2670(2023)22 - 7374 - 13
10.7501/j.issn.0253-2670.2023.22.014
2023-06-13
国家自然科学基金面上项目(82173976)
苏 娟,女,硕士,研究方向为从事中药制剂新技术研究。E-mail: 1105072526@qq.com
通信作者:韩 丽,女,博士,教授,研究方向为主要从事中药制剂新技术研究。E-mail: hanliyx@163.com
张定堃,男,博士,副教授,研究方向为主要从事中药制剂新技术研究。E-mail: zhangdingkun@cdutcm.edu.cn
[责任编辑 郑礼胜]