白藜芦醇对脑缺血损伤的保护作用及机制研究进展
2023-11-27张文静徐浩群韩冰冰张义敏
张文静,徐浩群,李 冲,韩冰冰,张义敏
白藜芦醇对脑缺血损伤的保护作用及机制研究进展
张文静,徐浩群,李 冲,韩冰冰*,张义敏*
山东中医药大学,山东 济南 250355
脑缺血及其再灌注损伤是全球人口死亡和致残的主要原因之一,从天然植物或药物中提取单体开发神经保护剂已成为治疗脑缺血损伤的关键方法。白藜芦醇作为一种天然多酚类化合物,广泛存在于植物与食物中。大量研究表明白藜芦醇可通过保护血脑屏障、抑制炎症反应、抗氧化应激、抑制细胞凋亡、调节自噬等多种途径改善脑缺血损伤。在治疗及预防脑缺血损伤方面,白藜芦醇的有效性已被证实,但其具体的作用机制及分子靶点尚未完全阐明。因此,通过分析近10年国内外相关文献,对白藜芦醇治疗脑缺血损伤的作用靶点及机制研究、药动学、药物递送系统及安全性评价等进行综述,为白藜芦醇的开发和推广应用提供理论依据。
白藜芦醇;脑缺血损伤;作用机制;药动学;药物递送;安全性评价
脑卒中是导致全球人口死亡和残疾最常见原因之一,且发病率逐年攀升。其由于脑组织缺血、缺氧及再灌注损伤造成一系列级联反应,如线粒体能量代谢异常、兴奋性氨基酸毒性、氧化应激、炎症反应、细胞凋亡、血脑屏障破坏等引发的神经功能损伤[1]。目前,溶栓药物是唯一批准的治疗脑卒中的药物,但由于有限的时间窗口及出血风险,其临床应用也非常受限。传统中药具有良好的安全性,也是新药开发的有利资源。而部分中药有效成分能够针对脑卒中发展的病理生理过程,所以从中药中提取开发高效能、低毒性、安全和廉价的活性物质对改善脑卒中症状的治疗替代方案具有重要意义。
白藜芦醇是一种天然多酚类化合物,主要来源于虎杖、决明子、藜芦、花生、葡萄、桑椹等多种植物[2],具有抗炎、抗氧化、抗凋亡、抗动脉粥样硬化和提高免疫力等作用,在治疗神经系统疾病及心脑血管疾病方面具有独特优势[3-4]。本文就近10年白藜芦醇抗脑缺血损伤的药理作用机制进行综述,讨论其药动学、药物递送研究及安全性评价,为白藜芦醇的临床应用及开发提供新的思路。
1 防治脑缺血损伤作用
1.1 保护血脑屏障
血脑屏障是外周循环和中枢神经系统间的调节基站,可维持组织稳态并调节脑内物质交换[5-6],由脑血管内皮细胞(brain endothelial cells,BVECs)、神经胶质细胞、周细胞、基底膜等成分构成,其中BVECs是构成血脑屏障的基本单位,在生理状态下,BVECs与多种紧密连接蛋白如闭合蛋白(occludin)、跨膜连接蛋白(claudin-5)和闭锁小带蛋白连接,形成血液和大脑间的界面,因此紧密连接蛋白被认为是血脑屏障功能紊乱的敏感指标[7-8]。脑缺血后,在持续缺氧与能量耗尽的情况下,大量坏死细胞激活白细胞介素-1β(interleukin-1β,IL-1β)、IL-6及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎因子,导致脑血管基质金属蛋白酶(matrix metalloproteinase,MMP)、内皮细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)及血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)异常升高,使紧密连接蛋白与胞外基质降解,血脑屏障结构破坏,造成大量神经元死亡与一系列继发性损伤。
研究发现白藜芦醇可使大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠脑梗死体积显著降低,脑组织含水量减少,微血管形态改善,同时occludin和claudin-5的表达上调。提示白藜芦醇可维持血脑屏障的完整性及通透性,具有改善缺血后脑损伤的作用[9]。张晋霞等[10]发现白藜芦醇可显著改善MCAO大鼠大脑水肿,修复基底膜与内皮细胞间大片状断裂,减少线粒体、核糖体、内质网等细胞器的溶解或破坏,下调ICAM-1和VCAM-1的表达,参与调节白细胞和BVECs间的相互作用,降低白细胞浸润程度,改善血脑屏障通透性及超微结构。
细胞外MMP9在血脑屏障破坏中具有关键作用,研究揭示脑缺血能迅速诱导MMP9上调,导致紧密连接蛋白破坏,血脑屏障损伤[11]。大量研究表明白藜芦醇可下调MMP9的表达,保护血脑屏障功能,减轻缺血再灌注损伤[12-14]。金属蛋白酶组织抑制因子-1(tissue inhibitor of matrix metalloproteinases-1,TIMP-1)作为血脑屏障的重要调节因子,可降低脑缺血后血脑屏障的通透性,同时也是MMP9的抑制剂[15-16]。白藜芦醇可通过调节TIMP-1/MMP9平衡,上调TIMP-1以抵抗MMP9的表达,维持内皮细胞的紧密连接结构,减少血脑屏障的损伤[17]。
内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)是内皮依赖性舒张功能因子,可合成一氧化氮,促进血管平滑肌松弛,增加脑血流量[18]。血管内皮生长因子(vascular endothlial growth factor,VEGF)可诱导体内新生血管生成,同时一氧化氮可调节VEGF促血管内皮细胞增殖和迁移的功能[19]。李杏芮等[20]发现白藜芦醇能上调脑缺血再灌注(ischemia/reperfusion,I/R)大鼠大脑缺血区eNOS、VEGF表达,促进脑内再生,保护血管内皮及血脑屏障。
Wnt/β-连环蛋白(β-catenin)信号通路参与血脑屏障的形成,其转导对维持脑缺血后血脑屏障的完整性至关重要[21]。神经元特异性的糖原合成激酶-3β(glycogen synthesizing kinase-3β,GSK-3β)是Wnt/β-catenin信号通路下游抑制剂,参与多种病理生理信号的调控[22]。在一项MCAO大鼠实验中,白藜芦醇通过激活Wnt/β-catenin信号通路,上调Wnt3a与β-catenin蛋白表达,抑制GSK-3β磷酸化水平,增加occludin和claudin-5的表达,改善脑缺血大鼠血脑屏障的破坏,进而减轻脑水肿[9]。
1.2 抗氧化应激

乔会敏等[27]发现ip白藜芦醇50 mg/kg可促进脑梗死大鼠的神经功能恢复,降低患侧脑组织含水量及梗死体积,增加SOD、CAT、Nrf2和HO-1的表达,下调活性氧水平及丙二醛含量,改善机体氧化应激反应。白藜芦醇通过介导Nrf2与ARE的结合,启动NQO-1转录,增强SOD的表达,降低乳酸脱氢酶活性,改善缺血缺氧再灌注神经损伤[28-29]。
热休克蛋白70(heat shock proteins70,HSP70)作为应激蛋白,可在大脑缺血梗死区域中被显著诱导,其过度表达能够提高组织细胞对缺血缺氧的耐受性,同时清除氧自由基和脂质过氧化物,减少氧化应激细胞损伤,恢复神经功能[30]。张小良等[31]发现在脑I/R时,白藜芦醇可诱导HSP70的表达,增加内源性SOD活性,减轻机体氧化应激,起到神经保护作用。
神经系统性疾病音猬因子(sonic hedgehog,shh)信号通路由Shh蛋白、Shh蛋白受体(Ptched,Ptch)及Gli蛋白家族等成员构成,其作为细胞内重要的抗氧化机制,可诱导多种抗氧化酶激活,发挥细胞保护作用[32]。Gil1是Shh信号通路的执行者,可诱导Ptch1表达[33]。研究发现白藜芦醇能上调Gil1、Ptch1表达,激活Shh信号通路,进而增加病变侧大脑SOD的表达,以抗氧化方式发挥神经保护的作用[34]。
1.3 减轻炎症反应
炎症在缺血性脑卒中的病程进展中发挥重要作用[35]。研究发现,脑缺血后可见受损区域大量炎症因子的浸润,其过度表达使神经细胞进一步损坏。白细胞、小胶质细胞和星形胶质细胞是主要的效应器,通过释放IL-6、IL-1β、TNF-α等诱发炎症反应[36-37]。此外,脑缺血及再灌注损伤发生的本质是促炎和抗炎反应的动态平衡被破坏,因此激活抗炎因子的释放也不容忽视[38]。
多项研究表明白藜芦醇可有效减少炎症因子的含量,显著改善机体炎症反应[39-41]。石锋等[9]发现白藜芦醇可抑制脑缺血后星形胶质细胞的过度激活,减少IL-1β、IL-6和TNF-α炎性因子的释放,保护神经元免受炎性损伤。此外,研究者还发现白藜芦醇不仅可抑制促炎因子表达,还能增加抗炎因子IL-10、IFN-β的表达,从而抑制炎症级联反应[42]。
髓过氧化物酶(myeloperoxidase,MPO)作为炎症的介质能够推动机体参与炎症反应,其释放量与脑缺血的发生发展密切相关[43-45]。Fang等[46]在MCAO小鼠模型中发现,白藜芦醇可显著降低小鼠脑组织中MPO的活性及TNF-α的含量,抑制中性粒细胞浸润,减轻缺血后脑组织炎症反应。
CD147为细胞外基质金属蛋白酶诱导因子,能诱导MMP9的表达和活化,促进炎性因子IL-6、IL-1β的释放,加重炎症反应[47]。以往的研究揭示CD147/MMP9通路参与脑血管疾病的发生发展[48]。白藜芦醇能抑制OGD/R小胶质细胞的刺激和炎症因子的释放,通过抑制CD147的表达下调MMP9的含量,进而降低促炎小胶质细胞标志物(CD11b、CD16)的激活与IL-6、IL-1β及TNF-α的释放,防止炎症反应对脑缺血带来的更大损伤[49]。
微小RNA(microRNA,miRNA)是一种非编码RNA,可通过抑制靶mRNA的表达来调节生物活性。的表达和功能变化与各种中枢神经系统病理有关,其在脑缺血损伤后呈上调,转录因子CCAAT/增强剂结合蛋白β(CCAAT/enhancer binding proteins,C/EBPβ)作为炎症中关键基因表达的调节剂,参与小胶质细胞极化过程,研究发现可介导C/EBPβ的转录,进一步影响抗炎因子的分泌[50]。Ma等[51]发现白藜芦醇通过抑制的表达,以激活C/EBPβ促进小胶质细胞M2极化,增加抗炎因子IL-4、IL-10的释放,减少缺血后的神经炎症损伤。
核因子-κB(nuclear factor-κB,NF-κB)是炎症反应信号通路的关键因子[52],脑缺血时NF-κB活化,诱导小胶质细胞活化为M1表型,即促进IL-1β、TNF-α及活性氧的释放,导致炎症级联反应发生,加重脑组织损伤[53]。以往研究表明白藜芦醇可通过介导NF-κB上游蛋白的表达,抑制NF-κB的活化,减少炎症反应的发生。Toll样受体4(Toll-like receptor 4,TLR4)是TLR家族的主要成员,在脑内小胶质细胞广泛表达,NF-κB是其下游基因,白藜芦醇能通过抑制TLR4/NF-κB通路的激活,下调NF-κB二聚体p65的表达,减少TNF-α和IL-1β的释放,显著改善缺血后炎性损伤[12]。Notch信号通路参与炎症细胞的分化、形成与功能的调节,Notch1能调下游基因的转录,减少下游促炎因子的释放[54]。江海洋等[55]发现白藜芦醇可有效降低缺血性脑卒中大鼠脑组织Notch1和NF-κB表达,下调炎症因子的释放,抑制炎症反应。沉默调节蛋白1(sirtuin 1,SIRT1)是一种依赖NAD+的去乙酰化酶,既往研究表明SIRT1可抑制炎性反应,减轻脑缺血再灌注损伤,促进神经恢复[56]。实验通过尾iv白藜芦醇干预MCAO大鼠,发现其能激活SIRT1的表达,抑制p65与NF-κB启动子的结合,减少下游TNF-α、IL-1β及IL-6的表达,减轻炎症损伤[57]。此外,有研究发现白藜芦醇参与调节SIRT1/NF-κB信号通路,除了能引起上述炎症因子的释放之外,还能增加ICAM-1含量,不仅能减少炎症细胞向脑组织黏附、浸润,还能抑制一系列炎症级联反应的发生[58]。
1.4 抑制细胞凋亡
细胞凋亡在脑缺血后数小时开始,主要见于缺血半暗带。缺血性神经元凋亡主要是由B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)家族基因、半胱氨酸天冬氨酸蛋白酶(cystein-asparate protease,Caspase)家族基因参与的以线粒体为中心的凋亡过程[59]。Caspases-3参与脑缺血后神经元损失,其表达可以反映细胞的凋亡程度,Caspases-3的功能和激活受包括Bcl-2家族蛋白在内的许多分子调控;Bcl-2家族分为抗凋亡蛋白Bcl-2和促凋亡蛋白Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax),在细胞凋亡进程中发挥着重要的调节作用[60]。此外,促凋亡因子p53,在脑缺血状态下能激活其转录和翻译,诱导下游凋亡相关因子的表达,导致神经元凋亡损伤[61-62]。
张黎黎等[28]通过体外构建ODG/R大鼠原代皮质神经元模型,检测神经元活性及蛋白表达情况,发现白藜芦醇干预后可显著增加Bcl-2的表达,减少Caspase-3的含量,提高神经元活力的同时减少凋亡现象,其在体内实验中也得到了相同的结论[63]。此外,对脑I/R 24h后的大鼠ip白藜芦醇30 mg/kg可显著上调Bcl-2蛋白表达,下调Bax表达,减少线粒体向细胞质释放的细胞色素c含量,抑制Caspase-3和Caspase-9的活性,减轻大鼠脑缺血区神经元的凋亡水平[64]。罗国君[65]利用H2O2诱导大鼠肾上腺髓质嗜铬瘤PC12细胞制备神经元凋亡模型,发现诱导后的PC12细胞膜粗糙不光滑,部分细胞变圆、胞体肿胀,细胞失去原有形态,突起减少或消失。而经白藜芦醇处理后可显著改善上述情况,同时结果也显示白藜芦醇通过下调p53含量,减少Caspase-3的表达,上调Bcl-2表达,抑制细胞凋亡过程。
丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)由3个亚家族细胞外调节蛋白激酶(extracellular regulated protein kinase,ERK)、c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)和p38激酶构成,在神经细胞的生长和增殖中具有重要作用[66]。在I/R损伤的机制中,JNK和p38 MAPK等信号通路在调控细胞凋亡中发挥重要作用[67]。JNK通路可以通过介导线粒体凋亡机制在细胞凋亡中发挥作用,而p38通过调节Caspase-9参与细胞凋亡进程[68]。白藜芦醇通过逆转JNK和p38表达的升高,降低p-JNK、p-p38来对抗其转录及修饰后激活的凋亡损伤[69]。
Janus激酶(Janus kinase,JAK)/信号转导和转录激活蛋白(signal transducer and activator of transcription,STAT)信号通路是一条多效性级联反应通路,在I/R损伤中发挥重要作用[70]。JAK2为蛋白络氨酸激酶家族成员,主要在大脑胶质细胞表达。STAT3作为JAK2下游调节因子,其磷酸化由p-JAK2所介导,脑缺血后,JAK2及STAT3蛋白磷酸化水平增加,参与神经元凋亡过程[71-72]。磷脂酰肌醇3-激酶(phosphatidylinositol-3- kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)作为其下游信号通路,能参与细胞内介导凋亡[73]。白藜芦醇通过激活JAK2/STAT3,间接上调PI3K/Akt/mTOR通路,增加p-JAK2、p-STAT3、p-Akt、p-mTOR及Bcl-2的表达,下调Bax和Caspase-3的表达,抵抗大脑I/R的凋亡进展[74]。此外,宋光捷等[75]发现JAK1/STAT1也参与神经元细胞凋亡的调控,白藜芦醇处理可抑制p-JAK1、p-STAT1磷酸化,上调Bcl-2,抑制Bax表达同时下调Caspase-3表达,进而减少神经元凋亡,减轻I/R损伤,最终发挥脑组织保护作用。
1.5 调节自噬
细胞自噬是脑I/R后细胞内清除衰老或受损细胞器的主要代谢途径之一,具有维持机体稳态,促进细胞生存的作用。mTOR是自噬的关键抑制分子[76],可通过调节微管相关蛋白轻链3(microtubule-associatedprotein light chain 3,LC3)、泛素结合蛋白(p62)、及Bcl-2同源结构域蛋白(Beclin-1)等调控自噬[76-77]。LC3以LC3I和LC3II 2种形式存在,LC3II含量或LC3II/LC3I的值增高可反映自噬活性的增强[78]。p62作为经典的自噬受体能通过特殊结构域与LC3II结合,形成自噬小体,并在自噬溶酶体中降解,引发自噬[79]。Beclin-1是调控自噬上游的关键蛋白,参与自噬体膜的合成及自噬相关蛋白的招募[77]。研究表明SIRT1能够调节线粒体结构功能并参与调控自噬相关蛋白p62、LC3II的表达[80]。石瑶等[81]发现白藜芦醇通过上调SIRT1、LC3II的表达,激活自噬,保护脑神经免受缺血损伤。此外,也有研究表明白藜芦醇通过抑制PI3K/Akt信号通路下调mTOR,上调Beclin-1的表达,提高神经细胞自噬水平[82]。
线粒体自噬是通过清除受损线粒体,阻断其损伤诱导的细胞死亡过程,其中所产生的氨基酸、能量可被机体吸收重新参与细胞代谢,因此调控线粒体自噬在脑I/R损伤的治疗中尤为重要[83-84]。PHB2、TOM20蛋白分别位于线粒体内外膜上,其表达能反映受损线粒体的降解情况[85-86]。向菲等[87]发现白藜芦醇可通过激活SIRT1,提高LC3II,降低p62、PHB2、TOM20蛋白表达,促进线粒体自噬发生,减轻小鼠脑I/R损伤。因此研究者认为白藜芦醇在脑I/R中能适当促进线粒体自噬,选择性地降解受损线粒体,对神经细胞存活十分有益[88]。
1.6 促进神经突触的重塑
突触重塑是恢复神经功能的重要机制之一[89]。突触素及突触后致密物-95(postsynaptic density protein-95,PSD-95)是突触发挥信号传导功能的重要蛋白,其表达与突触的结构和功能密切相关[86]。-甲基--天冬氨酸(-methyl--aspartic acid,NMDA)受体NR2A/B是一种重要的中枢神经兴奋性神经递质受体,能调节轴突、树突结构发育、突触可塑性,并影响神经元回路的形成[90]。李华钢等[91]发现白藜芦醇能上调突触素、PSD95和NR2A/B的表达,改善MCAO大鼠模型突触活性区长度和突触后致密物厚度,提高突触连接区面积,促进突触前后距离的缩短,从而提高信息传递效率。余萍萍等[92]在大鼠脑缺血后给予白藜芦醇,发现缺血侧皮质突突触素在1、7及14 d的表达均高于对照组,且14 d时突触素的表达显著增加,表明白藜芦醇可增强神经元突触的重塑。
1.7 调节脑肠轴
脑肠轴是连接中枢神经系统和胃肠道的双向通路,肠道菌群的改变导致小肠免疫功能异常,是引发脑肠轴紊乱的关键[93]。辅助性T细胞17(helper T cell 17,Th17)参与早期炎症反应分泌促炎因子IL-17;调节性T细胞(regulatory T cells,Treg)能抑制外周和脑组织的促炎因子,发挥抑制炎症的作用[94-95]。正常情况下二者能相互转化且处于动态平衡中,当平衡被破坏时,Th17、Treg的效应相互抵抗以致免疫效应降低,导致脑肠轴功能紊乱,引发炎症反应,参与脑缺血损伤发展[96]。白藜芦醇通过减少肠道内Th17细胞数量、增加Treg数量、调节血浆和肠黏膜细胞因子IL-10、IL-17A水平来调控Th17/Treg的平衡,改善脑缺血炎症损伤[97]。此外,MCAO发病后应用白藜芦醇治疗3 d,可促进小肠固有层Th1/Th2平衡向Th2极化方向倾斜,使Th17/Treg平衡向Treg倾斜,通过调肠道菌群,降低小肠促炎因子的表达及肠道血管通透性,减轻细胞因子介导的血脑屏障破坏和神经炎症[98]。
1.8 抑制内质网应激(endoplasmic reticulum stress,ERS)
ERS是由大量未折叠或错误折叠蛋白积聚在内质网中,引发细胞生理功能紊乱的一种状态[99]。以往的研究表明,适度ERS的激活对机体是有益的,但持续而强烈的ERS可介导组织损伤[45]。葡萄糖调控蛋白78(glucose regulated protein78,GRP78),磷酸化胰腺内质网激酶(phosphorylation-protein kinase RNA like ER kinase,p-PERK),C/EBP同源蛋白(C/EBP homologous protein,Chop)是ERS的标志性蛋白[100]。其中,脑I/R条件下会持续诱导ERS的激活,机体通过上调GRP78蛋白抵抗内质网上未折叠蛋白的负荷,促进内质网损伤修复,而p-PERK和Chop的升高启动细胞损伤途径,导致细胞死亡,白藜芦醇预处理可进一步上调GRP78,促进内质网结构和功能的恢复,下调p-PERK和Chop,减轻ERS对细胞损伤[101]。
综上所述,白藜芦醇可以通过保护血脑屏障、抑制氧化应激、减轻炎症反应、抑制细胞凋亡、调节自噬、促进神经突触的重塑、调节脑肠轴和抑制ERS途径,在脑缺血过程中发挥保护作用。分析相关文献发现,抑制炎症反应和抗氧化应激是白藜芦醇抗脑缺血损伤的主要保护机制。值得注意的是,炎症反应是诱发脑缺血的重要因素之一,容易造成脑血管循环障碍、引发细胞凋亡和氧化应激等一系列级联反应,因此抑制炎症反应能改善神经功能损伤。在白藜芦醇介导炎症反应的调节机制中,通过NF-κB核心通路调节上游靶点及炎性因子的表达,以抑制促炎因子的释放参与炎症反应,但对于调控抑炎因子的释放,白藜芦醇相关的研究较少。在抗氧化应激的调控网络中,以Nrf2/ARE为上游通路,参与调控CAT、SOD、NQO-1、HO-1等多种抗氧化酶的表达,降低胞内活性氧及丙二醛的含量。同时还能激活Gil1/ptch1途径及HSP70的表达,上调SOD含量,进而提高脑组织的抗氧能力。但是,白藜芦醇在保护血脑屏障、调节自噬、促进神经突触的重塑、抑制ERS和调节脑肠轴等方面研究略显不足。脑肠轴是神经系统与肠道沟通的桥梁。脑卒中会迅速引发肠道菌群紊乱,肠道菌群失调可以通过调节免疫系统进一步加重脑损伤。因此,介导脑肠轴的双向调节作用改善脑缺血损伤,不乏是一条有效的治疗途径。见图1。
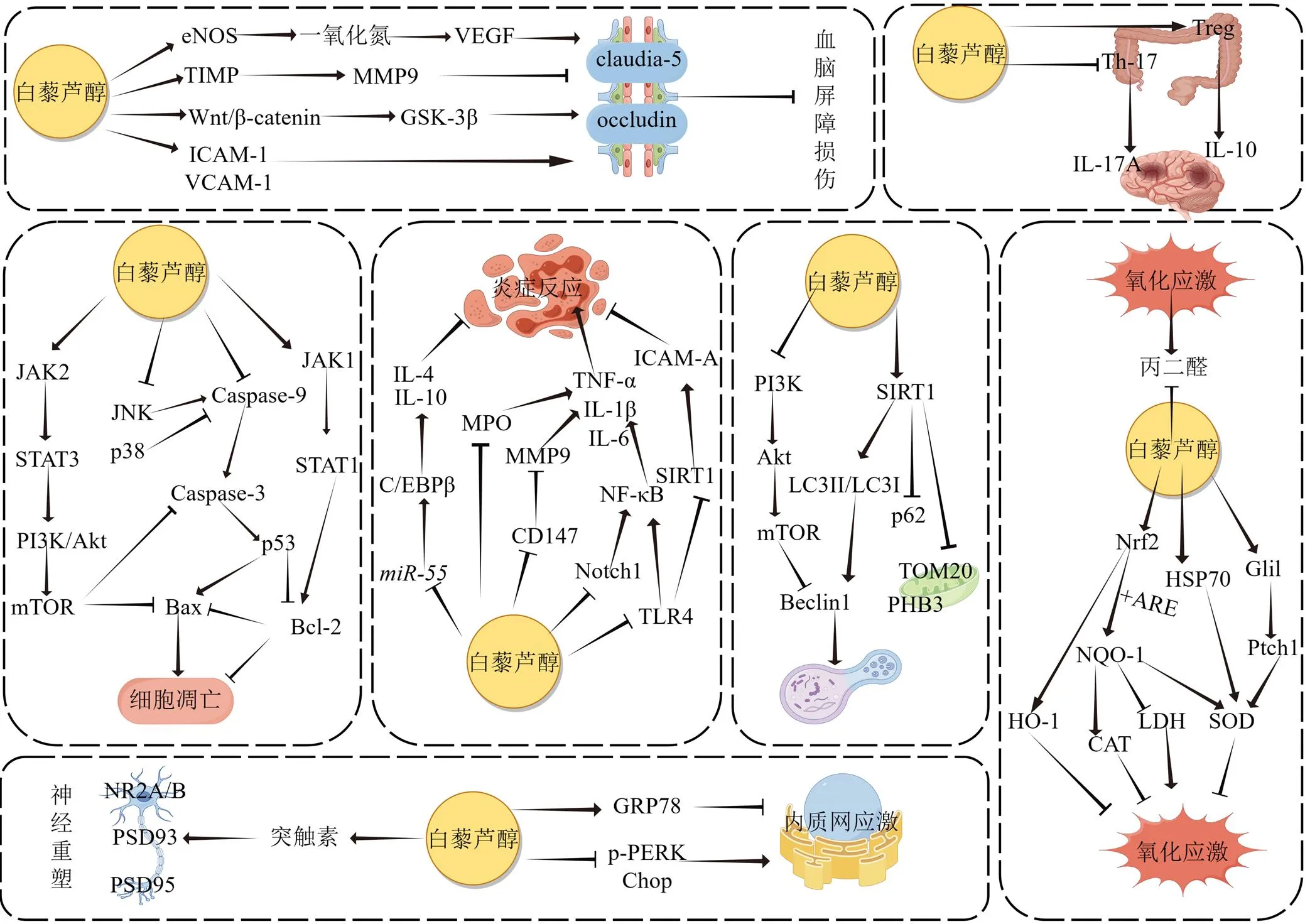
图1 白藜芦醇抗脑缺血损伤的作用机制
2 白藜芦醇药动学及药物递送系统研究
白藜芦醇在水中溶解度小,对光、温度不稳定,易发生异构化,半衰期短,在体内吸收、代谢迅速且生物利用度低,限制了其在临床上的应用[102]。在人体口服代谢实验中,白藜芦醇主要以葡萄糖醛酸苷和硫酸酯类结合物的形式存在,血液中只能检测到微量白藜芦醇原型药物,如单次25 mg时,在0.5~2.0 h的峰值质量浓度小于10 ng/mL,白藜芦醇与总代谢物血浆浓度仅为400 ng/mL[103]。动物体内代谢研究发现,白藜芦醇能在大鼠胃肠道中迅速吸收,ig 2 min后即可在血液中检测到其原型药物,10 min左右到达至峰浓度(2.815±0.246)μg/mL,半衰期为(289.0±20.3)min,药-时曲线下总面积为(475.7±52.9)mg·h/L,其在小肠和肝脏内代谢产物的生物利用度仅为1%[104]。此外,另有多项实验显示,白藜芦醇进入体内后多分布于血流灌注丰富的器官如肝、心、脾、肺及肾,在脑组织中的含量低,且30 min后脑组织中即无法检测出,白藜芦醇虽能够穿过血脑屏障但含量较低,可能与其体内的吸收代谢速率有关[105-106]。因此,如何增加白藜芦醇穿透血脑屏障的含量,提高其生物利用度,成为亟待解决的问题。目前已研发出多种药物转运系统,如固体分散体[107]、凝胶剂[108]、包合物[109]、脂质体[110]及纳米颗粒[111]等,通过改善白藜芦醇生物活性成分分散状态,增加化学稳定性,提高临床应用率。
最新研究发现乳铁蛋白(lactoferrin,Lf)是一种天然的铁结合阳离子糖蛋白,属于转铁蛋白家族,其受体在脑内皮细胞和神经元上高度表达[112]。Li等[113]发现Lf具有神经保护作用,能抑制缺血再灌注诱导炎症因子的表达,预防脑缺血所引起的损伤。因此,研究者将白藜芦醇负载的PLGA纳米颗粒与Lf结合,增强白藜芦醇扩散到大脑中,能显著改善神经炎症,且治疗效果远高于单独使用白藜芦醇组[114]。
另外,不同的给药方式也是影响白藜芦醇生物利用度的因素之一。目前,在白藜芦醇治疗脑缺血损伤中的给药方式主要包括与iv,临床研究显示白藜芦醇25~150 mg 1 h后,即可观察到原型成分的血浆峰浓度(max),其含量仅为2.2~31.1 nmol/L,第2峰在口服6 h后出现,这是由于白藜芦醇代谢产物通过肝肠循环被肠重吸收的结果,但iv 15 mg/kg才存在肝肠循环[115-116]。尽管如此,无论还是高剂量iv,白藜芦醇的广泛代谢造成其生物利用度仍然较低,以至于血药浓度难以达到药理活性水平。其中,一项将载药系统与给药系统结合的新型技术,能显著提高载药量并改善脑组织含量低的现状,同时解决纳米药物无法通过鼻脑途径的弊端。将芳香开窍引经类中药成分β-细辛醚与穿肽膜R8联合使用进入鼻腔,有利于运载白藜芦醇的纳米粒透过鼻腔黏膜和血脑屏障进入中枢神经系统[117]。除上述优点外,还发现该技术使脑内的药物浓度显著高于肝肾中浓度,在持续释放药物的同时对肝肾等其余脏器影响较小,为其治疗脑缺血开发新的剂型及给药途径提供了方向。此外,纳米囊、纳米乳及纳米混悬剂等纳米技术在解决白藜芦醇药动学障碍,提高其生物利用度的同时显示良好的脑靶向性[118]。
但是,对于鼻腔给药的方式也存在弊端,一方面鼻纤维毛的存在导致药物易被清除,如何增加药物在鼻腔内滞留的时间,促进药物吸收;另一方面,鼻腔给药对于药物的理化性质、粒径大小也有所限制。因此,白藜芦醇纳米技术的应用尚待完善,纳米材料的选择及纳米表面电荷和形状均是需要解决的问题,稳定且无毒的纳米材料能够提高载药量;另外,如何将载药系统带入临床治疗也是值得思考的问题。
3 白藜芦醇的安全性评价
随着研究的深入,白藜芦醇的安全性问题也备受关注,其主要涉及毒理学评价、禁忌证、特殊人群用药、注意事项及药物间相互作用。研究表明白藜芦醇的毒性作用的发生率与严重程度主要取决于白藜芦醇的剂量。Hebbar等[119]分别以0.3、1.0和3.0 g/kg受试剂量干预大鼠28 d,结果发现以0.3 g/kg干预的大鼠未见明显不良反应,但1.0和3.0 g/kg干预组雌雄大鼠均出现了不同程度的脱水、呼吸困难及明显的肾毒性,如造成血清血尿素氮和肌酐水平升高,肾脏呈现不同程度的病理变化,甚至影响促红细胞生成素的合成引发贫血。另有研究表明,当口服剂量不超过0.1 g/d时,无论短期或是长期(1年)白藜芦醇均未出现不良反应;在1.0和1.5 g/d的剂量下,偶见胃肠道不适、腹泻和热疹等不良反应;在大于2.5 g/d的剂量下,会发生恶心呕吐和腹痛等严重的不良反应[120],表明高剂量的白藜芦醇具有一定毒性。临床研究表明健康肥胖男性持续30 d白藜芦醇0.15g/kg可显著降低天冬氨酸氨基转移酶(aspartate aminotransferase,AST)含量及肝脏脂肪[121]。非酒精性脂肪肝患者白藜芦醇0.05 g/kg可降低总胆固醇及三酰甘油含量,改善脂质代谢异常,而白藜芦醇3.0 g/d干预8周后,会增加非酒精性脂肪肝患者的丙氨酸氨基转移酶与AST含量[122]。综上,低剂量白藜芦醇的使用相对安全,无明显肝肾毒性,但对于非酒精性脂肪肝患者而言,高剂量白藜芦醇的治疗显然是不明智的选择。
多项实验发现,低剂量的白藜芦醇可以显著降低卵母细胞内活性氧水平,提高谷胱甘肽水平,促进卵母细胞成熟,提高体外受精的囊胚率[123-125]。此外,通过补充白藜芦醇可以改善妊娠期及哺乳期小鼠的抗氧化能力,增加子宫动脉的血流量,减少胎盘炎症和肝三酰甘油沉积,但报道也称白藜芦醇会导致胎儿胰腺发育肿大甚至异常[126],提示孕妇服用白藜芦醇可能存在安全问题。另有研究表明白藜芦醇作为植物雌激素,具有雌激素类似功效,长期使用会刺激女性乳腺、卵巢及子宫等部位癌细胞的快速生长[127-128]。因此,对于具有以上癌症风险及患者应当避免使用白藜芦醇。
此外,白藜芦醇可通过抑制细胞色素P450(cytochrome P450,CYP450)同工酶活性改变联合给药药物的药动学(即吸收和代谢)导致的安全问题,研究显示白藜芦醇可显著抑制CYP1A2、CYP2C9的活性,影响药物代谢速率,造成药效降低甚至增加毒性风险[129]。因此临床对白藜芦醇与经由CYP1A2和CYP2C9代谢的药物联合使用时,需定期检测血药浓度以调整白藜芦醇剂量,或避免联合用药。
虽然低剂量白藜芦醇被认定为是安全的,且具有良好耐受性,尤其对于健康肥胖及肝病患者,即使在疾病治疗中长期使用,也极少出现不良反应;但仍不建议孕期使用,乳腺癌、卵巢癌及子宫癌患者应避免长时间服用;考虑到其药物间相互作用,白藜芦醇与CYP所代谢药物的联合使用也应尽量减少。
4 结语与展望
脑缺血及再灌注损伤严重危害人类健康,其复杂的病理机制影响脑卒中患者神经功能。白藜芦醇作为一种天然中草药成分,已被多项实验证实能通过保护血脑屏障、抑制氧化应激、减轻炎症反应、抑制细胞凋亡、调节自噬、促进神经突触的重塑、调节脑肠轴和抑制ERS等途径,能够有效保护大脑免受缺血、缺氧损伤。动物实验研究表明,低剂量的白藜芦醇具有良好的耐受性及安全性,适合长期治疗服用,但有限的临床研究并不能完全揭示其可能发生的不良反应。另外,白藜芦醇在动物模型中的治疗时间窗口相对较长,给药时间从缺血发作前30 d到缺血发作后3 d不等,但所包含的研究几乎完全基于健康的成年动物,白藜芦醇能否在老年动物模型中达到同样的效果需要进一步验证。综上,在未来的研究中需要大规模的临床试验,以确保其安全有效性。
尽管白藜芦醇药物递送系统研究十分广泛,研究者致力于开发各种安全低毒且高效的载药方式与给药方式,但对于新型技术是否影响药物代谢过程、中间产物类型及组织分布的报道仍不完善。另外,如何让药物尽可能的滞留在病灶区,以发挥最大药效的同时降低其他不良反应。脑缺血引起血脑屏障通透性的改变是否影响药物吸收,如何将白藜芦醇理化性质与临床实际需要相结合研制出集保护、靶向和控释于一体的新型智能递送系统,藉以更好地发挥白藜芦醇疗效而服务于临床。
利益冲突 所有作者均声明不存在利益冲突
[1] Qin C, Yang S, Chu Y H,. Signaling pathways involved in ischemic stroke: Molecular mechanisms and therapeutic interventions [J]., 2022, 7(1): 215.
[2] Berretta M, Bignucolo A, Di Francia R,. Resveratrol in cancer patients: From bench to bedside [J]., 2020, 21(8): 2945.
[3] Bai H, Ding Y Q, Li X,. Polydatin protects SH-SY5Y in models of Parkinson’s disease by promoting Atg5-mediated but parkin-independent autophagy [J]., 2020, 134: 104671.
[4] Katila N, Duwa R, Bhurtel S,. Enhancement of blood-brain barrier penetration and the neuroprotective effect of resveratrol [J]., 2022, 346: 1-19.
[5] Simpson J E. Potential mechanisms underlying the dysfunction of the blood-brain barrier [J]., 2023, 24(9): 8184.
[6] Liu G L, Liang Y, Xu M,. Protective mechanism ofinjection on blood-brain barrier injury induced by cerebral ischemia in rats [J]., 2021, 11(1): 18451.
[7] Jiang X Y, Andjelkovic A V, Zhu L,. Blood-brain barrier dysfunction and recovery after ischemic stroke [J]., 2018, 163/164: 144-171.
[8] Guo Y Z, Dong L D, Gong A,. Damage to the blood‑brain barrier and activation of neuroinflammation by focal cerebral ischemia under hyperglycemic condition [J]., 2021, 48: 142.
[9] 石锋, 张其兵, 胡圣阳, 等. 白藜芦醇调控Wnt/ β-catenin/GSK-3β通路保护局灶性脑缺血血脑屏障损伤 [J]. 广西医科大学学报, 2020, 37(9): 1617-1622.
[10] 张晋霞, 张志勇, 张蕊, 等. 白藜芦醇后处理对脑缺血再灌注大鼠血脑屏障和ICAM-1、VCAM-1的影响 [J]. 湖南师范大学学报: 医学版, 2021, 18(6): 39-41.
[11] Yu J Y, Liu Q Q, Li X,. Oxymatrine improves blood-brain barrier integrity after cerebral ischemia- reperfusion injury by downregulating CAV1 and MMP9 expression [J]., 2021, 84: 153505.
[12] 孙玉洁, 姚岚, 赵萌, 等. 白藜芦醇对大鼠脑梗死模型缺血再灌注中炎症及炎性坏死的影响研究 [J]. 中国医学装备, 2020, 17(10): 200-205.
[13] 郭斌, 刘瑞鹏, 东青野, 等. 白藜芦醇对MCAO大鼠的血脑屏障的保护作用 [J]. 临床合理用药杂志, 2018, 11(10): 16-17.
[14] 张跃奇, 王媛, 张志强, 等. 白藜芦醇对大鼠脑缺血再灌注海马损伤的保护作用及对MMP-9表达的影响 [J]. 重庆医学, 2019, 48(3): 386-389.
[15] 樊金宇, 闫海润, 路遥, 等. MMP-9/TIMP-1平衡在急性缺血性脑卒中rt-PA溶栓后出血性转化中的临床应用研究 [J]. 中国现代医药杂志, 2023, 25(3): 18-22.
[16] Zielińska-Turek J, Dorobek M, Turek G,. MMP-9, TIMP-1 and S100B protein as markers of ischemic stroke in patients after carotid artery endarterectomy [J]., 2022, 50(297): 177-182.
[17] 张跃奇, 王媛, 张志强, 等. 白藜芦醇对慢性脑缺血大鼠认知损伤和海马MMP-9和TIMP-1表达的影响研究 [J]. 重庆医学, 2019, 48(5): 742-747.
[18] Huang C, Huang W H, Wang R,. Ulinastatin inhibits the proliferation, invasion and phenotypic switching of PDGF-BB-induced VSMCs via Akt/eNOS/NO/cGMP signaling pathway [J]., 2020, 14: 5505-5514.
[19] 李雯洁, 巩子汉, 黄颖, 等. 三化汤对脑缺血再灌注损伤大鼠血脑屏障的保护作用 [J]. 中国中医基础医学杂志, 2022, 28(7): 1072-1076.
[20] 李杏芮, 陈清, 盛华均. 白藜芦醇通过介导eNOS表达促进局灶脑缺血/再灌注大鼠脑内血管再生 [J]. 中国组织化学与细胞化学杂志, 2016, 25(6): 506-511.
[21] Song S S, Huang H C, Guan X D,. Activation of endothelial Wnt/β-catenin signaling by protective astrocytes repairs BBB damage in ischemic stroke [J]., 2021, 199: 101963.
[22] Jin Z, Ke J J, Guo P P,. Quercetin improves blood-brain barrier dysfunction in rats with cerebral ischemia reperfusion via Wnt signaling pathway [J]., 2019, 11(8): 4683-4695.
[23] Forman H J, Zhang H Q. Targeting oxidative stress in disease: Promise and limitations of antioxidant therapy [J]., 2021, 20(9): 689-709.
[24] 周密, 陆瑶, 鲁婷婷, 等. 葛花异黄酮对大鼠缺血性脑卒中的保护作用 [J]. 中国临床药理学杂志, 2023, 39(10): 1441-1445.
[25] Adelusi T I, Du L, Hao M,. Keap1/Nrf2/ARE signaling unfolds therapeutic targets for redox imbalanced-mediated diseases and diabetic nephropathy [J]., 2020, 123: 109732.
[26] 刘军舰, 陈帅, 袁红霞, 等. 基于Nrf2信号通路探讨茵陈蒿汤对阻塞性黄疸大鼠肾氧化应激损伤的影响及其作用机制 [J]. 临床肝胆病杂志, 2023, 39(5): 1126-1133.
[27] 乔会敏, 董梅, 陈林玉, 等. 白藜芦醇对脑梗死大鼠的脑保护作用及抗氧化机制研究 [J]. 脑与神经疾病杂志, 2022, 30(6): 352-357.
[28] 张黎黎, 黄家贵, 沈长波, 等. 白藜芦醇预处理对缺糖缺氧再灌注大鼠原代皮质神经元的保护作用 [J]. 中成药, 2014, 36(5): 897-903.
[29] Narayanan S V, Dave K R, Saul I,. Resveratrol preconditioning protects against cerebral ischemic injury via nuclear erythroid 2-related factor 2 [J]., 2015, 46(6): 1626-1632.
[30] 左天睿, 胡晴雯, 刘京东, 等. β-石竹烯通过激活HSF1/HSP70通路减轻大鼠脑缺血再灌注损伤 [J]. 中国新药杂志, 2023, 32(5): 513-521.
[31] 张小良, 高赛红, 杨迎春, 等. 大鼠局灶性脑缺血再灌注损伤白藜芦醇与HSP70蛋白表达的关系 [J]. 解剖学研究, 2018, 40(3): 185-188.
[32] Li X Y, Li Y X, Li S Q,. The role of Shh signalling pathway in central nervous system development and related diseases [J]., 2021, 39(2): 180-189.
[33] Zhang B, Liu H, Li M,. Penetrative needling of scalp-points improves neurological function by promoting stem cell proli-feration and activating Shh/Gil1 signaling in intracerebral hemorrhage rats [J]., 2020, 45(2): 93-98.
[34] Cheng W, Yu P P, Wang L,. Sonic hedgehog signaling mediates resveratrol to increase proliferation of neural stem cells after oxygen-glucose deprivation/ reoxygenation injury[J]., 2015, 35(5): 2019-2032.
[35] 赵麓, 张行行, 孙欠欠, 等. 基于NLRP3炎症小体研究黄芩苷联合栀子苷防治缺血性脑卒中及并发心肌损伤的作用机制 [J]. 中草药, 2023, 54(6): 1833-1841.
[36] Xu S B, Lu J N, Shao A W,. Glial cells: Role of the immune response in ischemic stroke [J]., 2020, 11: 294.
[37] 徐小雯, 李哲明, 应夏丽. 马钱苷在脑缺血再灌注损伤中的作用及机制 [J]. 浙江医学, 2022, 44(23): 2490-2498.
[38] Lambertsen K L, Finsen B, Clausen B H. Post-stroke inflammation—Target or tool for therapy? [J]., 2019, 137(5): 693-714.
[39] 王瑜, 梁超, 王宝爱, 等. 白藜芦醇激活PI3K/Akt信号通路与老年缺血性脑卒中大鼠血清IL-6、IL-1β含量的分子机制 [J]. 中国老年学杂志, 2023, 43(3): 656-660.
[40] 汤海波. 白藜芦醇减轻脑缺血再灌注损伤与激活Wnt/ β-catenin相关 [J]. 天然产物研究与开发, 2017, 29(2): 212-216.
[41] 张莉峰, 滕军放, 袁学谦, 等. 白藜芦醇通过抑制TNF-α表达保护大鼠脑缺血再灌注损伤 [J]. 中国动脉硬化杂志, 2017, 25(1): 32-36.
[42] 刘菁, 刘杰, 廖鸿雁, 等. 白藜芦醇预处理对星形胶质细胞氧糖剥夺/再复氧损伤后活化及炎症反应的影响 [J]. 解剖学报, 2020, 51(3): 313-319.
[43] Orion D, von Landenberg P, Itsekson-Hayosh Z,. Plasma myeloperoxidase levels in acute brain ischaemia and high grade carotid stenosis [J]., 2020, 27(8): 1604-1611.
[44] 文锟, 徐平, 胡兴国, 等. 缺血性脑卒中患者血清内脂素和髓过氧化物酶水平与颈动脉粥样硬化关系的研究 [J]. 实用预防医学, 2018, 25(1): 62-65.
[45] Han Y, Yuan M, Guo Y S,. Mechanism of endoplasmic reticulum stress in cerebral ischemia [J]., 2021, 15: 704334.
[46] Fang L Q, Gao H M, Zhang W N,. Resveratrol alleviates nerve injury after cerebral ischemia and reperfusion in mice by inhibiting inflammation and apoptosis [J]., 2015, 8(3): 3219-3226.
[47] Wang H L, Ye J, Liu R T,. Clinical significance of CD147 in children with inflammatory bowel disease [J]., 2020, 2020: 1-7.
[48] 刘璐, 张文彦, 李世英. 亲环素A和白细胞分化抗原147与动脉粥样硬化及缺血性心脑血管病的研究进展 [J]. 心脑血管病防治, 2021, 21(5): 488-491.
[49] Zhang H F, Zhao W J. Resveratrol alleviates ischemic brain injury by inhibiting the activation of pro- inflammatory microglia via the CD147/MMP-9 pathway [J]., 2022, 31(4): 106307.
[50] Liu Y, Wang M, Deng T,. Exosomalfrom gastric cancer induces cancer-associated cachexia by suppressing adipogenesis and promoting brown adipose differentiation via C/EPBβ [J]., 2022: 1-14.
[51] Ma S, Fan L L, Li J C,. Resveratrol promoted the M2polarization of microglia and reduced neuroinflammation after cerebral ischemia by inhibiting[J]., 2020, 130(8): 817-825.
[52] Jover-Mengual T, Hwang J Y, Byun H R,. The role of NF-κB triggered inflammation in cerebral ischemia [J]., 2021, 15: 633610.
[53] 刘梦, 刘成志, 方敬献.通过TLR4/NF-κB通路调节小胶质细胞/巨噬细胞极化对缺血性脑卒中的保护作用 [J]. 卒中与神经疾病, 2022, 29(6): 511-518.
[54] Zhou P T, Li Q Q, Su S W,. Interleukin 37 suppresses M1macrophage polarization through inhibition of the Notch1 and nuclear factor kappaB pathways [J]., 2020, 8: 56.
[55] 江海洋, 陈浩, 顾中华. 白藜芦醇保护缺血性脑卒中大鼠神经功能的作用机制研究 [J]. 云南中医学院学报, 2018, 41(3): 23-26.
[56] Li M, Li S C, Dou B K,. Cycloastragenol upregulates SIRT1 expression, attenuates apoptosis and suppresses neuroinflammation after brain ischemia [J]., 2020, 41(8): 1025-1032.
[57] 李传文, 张嵘, 侯亮, 等. SIRT1/NF-κB通路参与白藜芦醇改善大鼠脑缺血再灌注损伤炎性反应 [J]. 安徽医科大学学报, 2018, 53(1): 6-9.
[58] 陈妮娜, 牛迪. 白藜芦醇对新生大鼠缺血缺氧性脑损伤的保护作用研究 [J]. 中西医结合心脑血管病杂志, 2020, 18(21): 3574-3577.
[59] 毛诗慧, 李琳, 孙逸梅, 等. 川芎嗪预处理增强骨髓间充质干细胞外泌体对脑缺血大鼠的神经保护和抗神经元凋亡作用 [J]. 浙江中医药大学学报, 2023, 47(5): 455-462.
[60] 应夏丽, 王晓玲, 陈妍月, 等. 马钱苷对小鼠脑缺血再灌注损伤保护作用的实验研究 [J]. 中国中医药科技, 2021, 28(6): 888-893.
[61] 王月静, 张萌, 张海燕, 等. 人参皂苷Re对APP/PS转基因痴呆小鼠学习记忆力及海马Caspase-3、P53蛋白的影响 [J]. 中国老年学杂志, 2022, 42(5): 1186-1189.
[62] Hao Q, Chen J X, Lu H,. The ARTS of p53- dependent mitochondrial apoptosis [J]., 2023, 14(10): mjac074.
[63] 张萌, 张志勇, 张蕊, 等. 白藜芦醇后处理对大鼠脑缺血再灌注损伤海马CA1区Bax、Bcl-2的影响 [J]. 现代生物医学进展, 2020, 20(19): 3644-3648.
[64] Zhang X S, Wu Q, Zhang Q R,. Resveratrol attenuates early brain injury after experimental subarachnoid hemorrhage via inhibition of NLRP3 inflammasome activation [J]., 2017, 11: 611.
[65] 罗国君. 白藜芦醇通过P53途径抑制H2O2诱导PC-12细胞凋亡 [J]. 中华全科医学, 2014, 12(12): 1945-1947.
[66] Maik-Rachline G, Wortzel I, Seger R. Alternative splicing of MAPKs in the regulation of signaling specificity [J]., 2021, 10(12): 3466.
[67] Younis N S, Mohamed M E. Anethole pretreatment modulates cerebral ischemia/reperfusion: The role of JNK, p38, MMP-2 and MMP-9 pathways [J]., 2023, 16(3): 442.
[68] Liu C, Zhang D, Lu Z F,. Metformin protects against pericyte apoptosis and promotes neurogenesis through suppressing JNK p38 MAPK signalling activation in ischemia/reperfusion injury [J]., 2022, 783: 136708.
[69] 李世英, 张晋霞, 张志勇, 等. 白藜芦醇对脑缺血再灌注大鼠JNK、P38和神经元凋亡的影响 [J]. 中国中医急症, 2022, 31(2): 228-232.
[70] Nakka V P, Mohammed A Q. A critical role for ISGylation, ubiquitination and, SUMOylation in brain damage: Implications for neuroprotection [J]., 2020, 45(9): 1975-1985.
[71] 麻瑞娟, 朱海生, 李晓蕾, 等. 基于JAK2/STAT3通路探讨藏红花素对大鼠局灶性脑缺血再灌注损伤的影响 [J]. 解剖学研究, 2022, 44(6): 577-584.
[72] 吕明义, 邓淑玲, 郭文晏, 等. 木犀草素抑制JAK2/ STAT3信号通路减轻大鼠脑缺血再灌注损伤作用的研究 [J]. 天津医药, 2022, 50(4): 363-368.
[73] 黎玉环, 熊光润, 郑永强, 等. 侧脑室注射microRNA- 200c经PI3K/Akt/mTOR通路保护脑缺血再灌注损伤大鼠的机制 [J]. 解剖学杂志, 2022, 45(6): 515-520.
[74] Hou Y Y, Wang K, Wan W J,. Resveratrol provides neuroprotection by regulating the JAK2/STAT3/PI3K/ Akt/mTOR pathway after stroke in rats [J]., 2018, 5(3): 245-255.
[75] 宋光捷, 方毅, 陈黎, 等. JAK1/STAT1信号通路在白藜芦醇减轻大鼠局灶性脑缺血再灌注损伤中的作用机制 [J]. 中国老年学杂志, 2023, 43(3): 700-704.
[76] Gao X, Yu M, Sun W C,. Lanthanum chloride induces autophagy in primary cultured rat cortical neurons through Akt/mTOR and AMPK/mTOR signaling pathways [J]., 2021, 158: 112632.
[77] Klionsky D J, Abdalla F C, Abeliovich H,. Guidelines for the use and interpretation of assays for monitoring autophagy [J]., 2012, 8(4): 445-544.
[78] 黄亚光, 欧炳金, 冯家腾, 等. 竹节参总皂苷调节大鼠海马区自噬减轻脑缺血再灌注损伤 [J]. 中成药, 2020, 42(7): 1721-1726.
[79] 胡跃强, 唐农, 秦红玲, 等. P62通过调控自噬与抗氧化通路保护大鼠脑缺血再灌注损伤 [J]. 中华老年心脑血管病杂志, 2019, 21(3): 304-308.
[80] Jardim F R, de Rossi F T, Nascimento M X,. Resveratrol and brain mitochondria: A review [J]., 2018, 55(3): 2085-2101.
[81] 石瑶, 郭倩, 周也涵, 等. 白藜芦醇通过Sirtuins 1通路促进自噬减轻大鼠脑缺血/再灌注损伤 [J]. 基础医学与临床, 2015, 35(4): 496-501.
[82] 汪雷, 胡火军, 马金阳, 等. 白藜芦醇对大鼠脑缺血再灌注损伤的作用 [J]. 中国临床神经外科杂志, 2020, 25(5): 303-307.
[83] 贾冬雪, 杜静, 王书华. 荭草苷对脑缺血再灌注大鼠脑组织线粒体自噬的影响 [J]. 中国老年学杂志, 2023, 43(4): 925-929.
[84] Zhang R, Liu Y, Zhong W H,. SIK2improving mitochondrial autophagy restriction induced by cerebral ischemia-reperfusion in rats [J]., 2022, 13: 683898.
[85] Hira S, Packialakshmi B, Tang E,. Dexamethasone upregulates mitochondrial Tom20, Tom70, and MnSOD through SGK1 in the kidney cells [J]., 2021, 77(1): 1-11.
[86] Shi Y, Li Q, Sun F,. Lamprey PHB2maintains mitochondrial stability by tanslocation to the mitochondria under oxidative stress [J]., 2020, 104: 613-621.
[87] 向菲, 李明航, 徐露, 等. 白藜芦醇通过促进线粒体自噬减轻小鼠脑缺血/再灌注损伤的实验研究 [J]. 中国药理学通报, 2019, 35(6): 815-821.
[88] Shen Z, Zheng Y R, Wu J Y,. PARK2-dependent mitophagy induced by acidic postconditioning protects against focal cerebral ischemia and extends the reperfusion window [J]., 2017, 13(3): 473-485.
[89] 冯鹏, 李玉霞, 尚菁, 等. 自拟菖蒲郁金汤对抽动秽语综合征大鼠突触超微结构及突触素、突触后致密物-95蛋白的影响 [J]. 中国中西医结合杂志, 2022, 42(11): 1376-1382.
[90] 徐惠琴, 杜延茹, 沈晶赞, 等. NMDA受体NR2A、NR2B亚基在戊四氮诱导慢性癫痫大鼠中的作用 [J]. 温州医科大学学报, 2018, 48(12): 866-870.
[91] 李华钢, 饶艳, 聂华. 白藜芦醇对脑缺血大鼠突触可塑性的影响 [J]. 海南医学, 2017, 28(3): 348-352.
[92] 余萍萍, 王莉, 唐凡人, 等. 白藜芦醇对大鼠脑缺血再灌注损伤后突触素表达的影响 [J]. 解剖学报, 2016, 47(1): 12-17.
[93] Niu Z F, Wang L, Kang J,. Regulation of sleep disorders in patients with traumatic brain injury by intestinal flora based on the background of brain-gut axis [J]., 2022, 16: 934822.
[94] Bauché D, Marie J C. Transforming growth factor β: A master regulator of the gut microbiota and immune cell interactions [J]., 2017, 6(4): e136.
[95] 程建华, 黄一睿, 肖美娟, 等. 急性缺血性脑卒中大鼠脑组织中Th17/Treg的变化 [J]. 中国病理生理杂志, 2019, 35(4): 758-763.
[96] 柯莎, 杨飞, 彭舒, 等. Th17/Treg、TGF-β1、IL-17与急性脑卒中的病情严重程度以及预后的相关性研究 [J]. 广州医科大学学报, 2022, 50(6): 9-13.
[97] Yao J, Wei C, Wang J Y,. Effect of resveratrol on Treg/Th17 signaling and ulcerative colitis treatment in mice [J]., 2015, 21(21): 6572-6581.
[98] Dou Z C, Rong X F, Zhao E X,. Neuroprotection of resveratrol against focal cerebral ischemia/reperfusion injury in mice through a mechanism targeting gut-brain axis [J]., 2019, 39(6): 883-898.
[99] 宋洋, 陈瑶, 胡立娟, 等. 脑泰方含药血清对缺氧缺糖/复氧PC12细胞损伤的保护作用 [J]. 湖南中医药大学学报, 2023, 43(5): 814-821.
[100]陈裕琳, 万海同, 周惠芬, 等. 丹参与红花有效成分配伍对大鼠脑缺血再灌注损伤的保护作用 [J]. 中草药, 2018, 49(16): 3875-3881.
[101]高轩, 陈荔枝, 刘振红, 等. 白藜芦醇通过抑制内质网应激减轻大鼠脑缺血/再灌注损伤 [J]. 中国免疫学杂志, 2016, 32(1): 92-96.
[102]Huang X T, Li X, Xie M L,. Resveratrol: Review on its discovery, anti-leukemia effects and pharmacokinetics [J]., 2019, 306: 29-38.
[103]Gambini J, Inglés M, Olaso G,. Properties of resveratrol:andstudies about metabolism, bioavailability, and biological effects in animal models and humans [J]., 2015, 2015: 837042.
[104]梁力, 刘雪英. 乙酰化白藜芦醇和白藜芦醇在大鼠体内的药代动力学比较研究 [J]. 中华中医药杂志, 2019, 34(1): 105-108.
[105]Liang L, Liu X Y, Wang Q W,. Pharmacokinetics, tissue distribution and excretion study of resveratrol and its prodrug 3,5,4′-tri--acetylresveratrol in rats [J]., 2013, 20(6): 558-563.
[106]Menet M C, Baron S, Taghi M,. Distribution of trans-resveratrol and its metabolites after acute or sustained administration in mouse heart, brain, and liver [J]., 2017, 61(8). doi: 10.1002/ mnfr.201600686.
[107]张纯刚, 唐静雅, 于琛琛, 等. 白藜芦醇固体分散体在大鼠体内的药动学和绝对生物利用度研究 [J]. 中草药, 2018, 49(12): 2908-2913.
[108]Salem H F, Kharshoum R M, Abou-Taleb H A,. Nanosized nasal emulgel of resveratrol: Preparation, optimization,evaluation andpharmacokinetic study [J]., 2019, 45(10): 1624-1634.
[109]于琛琛, 张纯刚, 尹丽, 等. 白藜芦醇/羟丙基-β-环糊精/壳聚糖缓释微球的体外释放度及其在大鼠体内药动学的考察 [J]. 中国药房, 2019, 30(19): 2603-2607.
[110]Jhaveri A, Deshpande P, Pattni B,. Transferrin- targeted, resveratrol-loaded liposomes for the treatment of glioblastoma [J]., 2018, 277: 89-101.
[111]Trotta V, Pavan B, Ferraro L,. Brain targeting of resveratrol by nasal administration of chitosan-coated lipid microparticles [J]., 2018, 127: 250-259.
[112]Schirmbeck G H, Sizonenko S, Sanches E F. Neuroprotective role of lactoferrin during early brain development and injury through lifespan [J]., 2022, 14(14): 2923.
[113]Li H Y, Li P, Yang H G,. Investigation and comparison of the protective activities of three functional proteins—Lactoferrin, α-lactalbumin, and β-lactoglobulin—In cerebral ischemia reperfusion injury [J]., 2020, 103(6): 4895-4906.
[114]Katila N, Duwa R, Bhurtel S,. Enhancement of blood-brain barrier penetration and the neuroprotective effect of resveratrol [J]., 2022, 346: 1-19.
[115]Chen F, Li L, Xu F,. Systemic and cerebral exposure to and pharmacokinetics of flavonols and terpene lactones after dosing standardizedleaf extracts to rats via different routes of administration [J]., 2013, 170(2): 440-457.
[116]Smoliga J, Blanchard O. Enhancing the delivery of resveratrol in humans: If low bioavailability is the problem, what is the solution? [J]., 2014, 19(11): 17154-17172.
[117]余双文. 穿膜肽R8-PPTF修饰载白藜芦醇纳米粒经鼻给药的脑内递药研究 [D]. 上海: 上海中医药大学, 2019.
[118]张媚丽, 张梦, 殷淑江, 等. 黑磷纳米片载药体系的制备及其抗缺血性脑损伤的作用 [J]. 药学学报, 2022, 57(12): 3660-3668.
[119]Hebbar V, Shen G X, Hu R,. Toxicogenomics of resveratrol in rat liver [J]., 2005, 76(20): 2299-2314.
[120]Maier-Salamon A, Böhmdorfer M, Riha J,. Interplay between metabolism and transport of resveratrol [J]., 2013, 1290(1): 98-106.
[121]Robertson I, Wai Hau T, Sami F,. The science of resveratrol, formulation, pharmacokinetic barriers and its chemotherapeutic potential [J]., 2022, 618: 121605.
[122]Zhao G S, Yang L, Zhong W S,. Polydatin, A glycoside of resveratrol, is better than resveratrol in alleviating non-alcoholic fatty liver disease in mice fed a high-fructose diet [J]., 2022, 9: 857879.
[123]Zabihi A, Shabankareh H K, Hajarian H,. Resveratrol addition tomaturation andculture media enhances developmental competence of sheep embryos [J]., 2019, 68: 25-31.
[124]Piras A R, Menéndez-Blanco I, Soto-Heras S,. Resveratrol supplementation duringmaturation improves embryo development of prepubertal goat oocytes selected by brilliant cresyl blue staining [J]., 2019, 65(2): 113-120.
[125]Meng Q W, Guo T, Li G Q,. Dietary resveratrol improves antioxidant status of sows and piglets and regulates antioxidant gene expression in placenta by Keap1-Nrf2 pathway and Sirt1 [J]., 2018, 9(1): 1-13.
[126]Ramli I, Posadino A M, Giordo R,. Effect of resveratrol on pregnancy, prenatal complications and pregnancy-associated structure alterations [J]., 2023, 12(2): 341.
[127]Kobylka P, Kucinska M, Kujawski J,. Resveratrol analogues as selective estrogen signaling pathway modulators: Structure-activity relationship [J]., 2022, 27(20): 6973.
[128]Chin Y T, Wei P L, Ho Y,. Thyroxine inhibits resveratrol-caused apoptosis by PD-L1 in ovarian cancer cells [J]., 2018, 25(5): 533-545.
[129]吴俏玉, 袁洪, 陆瑶. 以混合探针药的方法评价白藜芦醇对人体细胞色素酶P450活性的影响 [J]. 中国临床药理学与治疗学, 2020, 25(4): 426-432.
Research progress on protective effect and mechanism of resveratrol on cerebral ischemic injury
ZHANG Wen-jing, XU Hao-qun, LI Chong, HAN Bing-bing, ZHANG Yi-min
Shandong University of Traditional Chinese Medicine, Jinan 250355, China
Cerebral ischemia and reperfusion injury is the leading cause of disability and death worldwide. The development of neuroprotective agents from natural plants or drugs has become a key approach to the treatment of cerebral ischemia injury. Resveratrol, as a natural polyphenolic compound, is widely found in plants and foods. Many studies have shown that resveratrol can improve cerebral ischemia injury by protecting the blood-brain barrier, inhibiting inflammatory response, anti-oxidative stress, inhibiting apoptosis, regulating autophagy and other ways. The great potential of resveratrol in the treatment and prevention of cerebral ischemic injury has been confirmed, but its specific mechanism of action and molecular targets have not been fully elucidated. Therefore, based on the analysis of relevant literature at home and abroad in the past 10 years, the target and mechanism studies, pharmacokinetics, drug delivery system and safety evaluation of resveratrol in the treatment of cerebral ischemic injury were reviewed, in order to provide theoretical basis for the further development and application of resveratrol.
resveratrol; cerebral ischemic injury; mechanism of action; pharmacokinetics; drug delivery; safety evaluation
R285
A
0253 - 2670(2023)22 - 7564 - 13
10.7501/j.issn.0253-2670.2023.22.033
2023-06-05
山东省自然科学基金资助项目(ZR2020KH003);济南市高校院所创新团队项目(2020GXRC012);山东中医药大学青年创新团队项目(2020-54-19)
张文静,女,硕士研究生,研究方向为温病经典理论和中医防治脑卒中活血化瘀类经典名方。E-mail: zhangwenjing202218@163.com
通信作者:张义敏,女,副教授,硕士生导师,从事温病经典理论研究和基于温病理论的感染学应用研究。E-mail:zhang_yimin@163.com
韩冰冰,女,副教授,硕士生导师,从事缺血性脑血管病的中医药防治研究。E-mail: sumusu@163.com
[责任编辑 赵慧亮]