HPTLC 联用像素与光密度法快速定量茶饮料中的EGCG
2023-11-26张延杰胡志高席兴军卫晓刘霭莎李汴生陈益胜
张延杰,胡志高,席兴军,卫晓,刘霭莎,李汴生,陈益胜,5*
(1 咀香园健康食品(中山)有限公司 广东中山528414 2 中国标准化研究院 北京100191 3 江南大学食品学院 江苏无锡214122 4 华南理工大学食品科学与工程学院 广州510641 5 山西农业大学食品科学与工程学院 山西太谷 030801)
茶鲜叶中富含多酚类物质,其含量约占茶鲜叶干质量的18%~36%,其中儿茶素含量最高,约占多酚总量的70%。儿茶素化合物属于黄烷醇类,其基本结构是2-苯基苯并吡喃。从茶叶中分离鉴定的儿茶素多为表型儿茶素,主要有4 种,表儿茶素(EC)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素没食子酸酯(EGCG),其中EGCG 在儿茶素中含量最高[1-4],占儿茶素总量的50%~80%,具有重要的保健功效。
近年来,诸多研究证明绿茶的健康促进作用主要归因于EGCG[5-6]。EGCG 具有抗氧化、杀菌、抑病毒、消炎、减肥等多种功效[7-12]。Azambuja等[13]研究表明,绿茶EGCG 具有抗炎活性,其作用机制为儿茶素可以清除体内活性氧,调节炎症信号通路,抑制炎症发生。茶提取物尤其是绿茶提取物和茶多酚可以抑制动物模型中不同器官肿瘤的形成和发展。有研究表明,茶多酚特别是EGCG,可抑制酶活性和信号转导途径,从而抑制细胞增殖和增强细胞凋亡,并抑制细胞入侵[14]。Suzuki等[15]研究表明,绿茶具有抗癌、抗肥胖、抗动脉粥样硬化、抗糖尿病、抗菌、抗病毒等活性,这些活性与EGCG的功效密切关联。Al-Basher等[16]研究表明,EGCG可以通过抑制肝脏铁蓄积来改善铁超负荷引起的大鼠肝毒性、细胞凋亡和氧化应激,改善肝脏抗氧化能力[17]。此外,通过测定EGCG 含量,可以进行茶叶分级,茶叶处理工艺合理性判断,茶饮料质量辨析等[18],具有重要的应用意义。
目前,已有多种方法用于测定茶叶及茶饮料中的儿茶素,如高效液相色谱-二极管阵列检测(HPLC-DAD)[19]、高效液相色谱-质谱(HPLC-MS)[20],衍生后的气相色谱-质谱(GC-MS)[21]等。最常用的方法始终基于HPLC 分离[22-25],然而,基于HPLC的方法存在分析时间长和溶剂浪费的局限性。需要建立一种通量和性价比高的方法来直观地表征茶产品中的EGCG。
在前期研究中,曾提出以HPTLC 为平台,结合光密度检测对显色结果进行扫描定量分析的方法[26-27]。然而,此方法在实际应用中存在仪器(光密度扫描仪)单价昂贵和通用性差的问题。使用数码相机对HPTLC 色谱结果进行数字化成像,是其它色谱工具不具备的独特优势。这一分析方法不仅为分析者提供了直观的视觉定量结果,而且使得基于像素分析定量替代昂贵的光密度扫描定量成为可能[28-29]。
本文以HPTLC 为分离检测平台,经FeCl3原位衍生显影和薄层成像后将衍生后的色谱板联用光密度扫描定量建立以HPTLC 为分离-分析一体化平台的检测方法,此外再联用数字化处理软件ImageJ 对薄层成像后的图片进行模拟扫描定量,建立一种高效、经济、可视化薄层色谱像素分析筛检方法,并将两种方法进行对比。具体操作:将样品进行点样、展开和分离;使用光密度或成像系统和ImageJ 进行平行定量分析,采用目测检视法进行定性分析;最后使用3 种茶饮料来验证方法的实际应用能力。
1 材料与方法
1.1 材料与试剂
茶饮料样品,无锡欧尚超市。EGCG(纯度98.0%),阿拉丁公司;无水乙醇、氯仿、丙酮、甲酸、甲醇、三氯化铁(均为分析纯),Sigma 公司;薄层色谱板,G60 F254 硅胶板,硅胶层厚0.2 mm,规格10 cm×20 cm,德国Merck 公司。
1.2 仪器与设备
ChromaSpray I 型点样仪;薄层色谱半自动点样仪、薄层色谱全自动展开仪、薄层色谱浸渍器、薄层色谱扫描仪,瑞士CAMAG 公司;ProVidoc System-DD70 薄层成像系统,德国Biostep 公司;电子天平(MB104E 型),瑞士Mettler-Toledo 公司。
1.3 试验方法
1.3.1 标准溶液及衍生溶液制备 EGCG 标准溶液:精确称取10.0 mg(精确至0.1 mg)EGCG 标准品于10 mL 烧杯中,用适量甲醇溶解并转移至10 mL 棕色容量瓶中,用甲醇定容至刻度,混匀,得到1 mg/mL EGCG 标准储备液。在4 ℃冰箱中恒温避光保藏,使用时按比例稀释至所需倍数,有效期为1 周。
FeCl3衍生溶液:准确称取5 g 无水三氯化铁标准品,加入100 mL 无水乙醇,混合均匀后,4 ℃冰箱中避光保存备用。
1.3.2 样品预处理 取3 种茶饮料10 mL 于离心管中,过0.45 μm 水系滤膜后得到样品溶液,所得溶液可直接用于HPTLC 点样,或将其放于4 ℃冰箱中冷藏备用。
1.3.3 硅胶板预洗 试验用所有硅胶板,使用前均需进行预洗前处理。取10 cm×20 cm 的硅胶板置于ADC-2 薄层色谱全自动展开仪中,将10 mL色谱级甲醇从仪器上部两侧槽中注入展开缸,以其作为流动相进行展开预洗,展开至硅胶板顶端后取出,最后用TLC 加热器III 在120 ℃条件下干燥20 min,降至室温后,用锡纸包装,保存于密封袋中。
1.3.4 HPTLC 色谱展开 采用0.5 MPa 氮气为载体,用ChromaSpray I 型点样仪精确点样于10 cm×20 cm 的薄层板上,点样参数为:点样的条带长度6 mm,条带距离底部10 mm,距离左端25 mm,条带间距自动计算。具体操作:将1~25 μL 标准溶液和10 μL 样品溶液,以100 nL/s 速度和0.2 μL 预排体积于硅胶板上喷涂。每次取样前,注射器用甲醇和超纯水手动清洗3 次。点样结束后用薄层色谱全自动展开仪展开,展开前需在仪器的两侧槽内分别注入10 mL 相应的流动相,展开参数为:氯仿/丙酮/甲酸(12.5/7.5/2.2,体积比),预平衡5 min,上行展开距离80 mm,展开完成后系统自动结束。之后将展开完成的硅胶板置于60 ℃TLC 加热器III 上充分干燥5 min,以挥发去除薄层板上残留的有机溶剂,这对获得干净的背景至关重要。
1.3.5 FeCl3变色反应及色谱结果成像 将完成色谱分离的硅胶板通过自动浸渍装置浸入FeCl3衍生液中,移动速度3 mm/s,停留时间3 s。然后,将蘸有FeCl3衍生液的硅胶板置于薄层色谱加热器上50 ℃加热。当硅胶板黄棕色背景出现明显的黑色斑点后,使用配备佳能EOS 700D 相机的成像系统对衍生后的硅胶板进行成像记录,相机参数设定为:白光底部透射光源,自动对焦和校正。
1.3.6 荧光光密度扫描定量分析方法 使用TLC Scanner 3 薄层色谱扫描仪进行光密度扫描定量,检测参数:吸光模式,氘灯和钨灯,激发波长620 nm,光栅4.00 mm×0.30 mm(Micro),扫描速度20 mm/s,分辨率100 μm/step。色谱设备、数据采集和处理均使用WinCATS 软件(1.4.4 版)。
1.3.7 图像数字化处理软件定量分析方法 对色谱分离结果的分析,使用ImageJ 软件(1.52a 版)中像素灰度转化-积分功能对数字化图像进行模拟扫描定量。具体操作是:首先将目标条带区域裁剪并保存为PC 兼容格式(.tif 文件),然后应用ImageJ 软件中的“Image-Color-Split Channels”功能,将原始图片拆分为3 个颜色通道(红色、蓝色、绿色),选出最佳颜色通道后,将该通道下裁剪好的目标区域,使用“Analyze-Gels”功能定义一个覆盖目标条带起始线和结束线的矩形,然后提取这些矩形在垂直方向上的像素灰度值,并用“Plot Lanes”功能进行轮廓分析,然后将图形结果转换为可积分色谱图;最后通过“Straight option”选项绘制基线,使用积分工具“Wand tool”定义色谱图中峰的面积,所获取的数据峰面积可直接用于定量分析。
2 结果与讨论
2.1 HPTLC-光密度检测方法的建立
在HPTLC 分离中,对硅胶板分离效果评估的方法一般是目测检视法。使用0.1 mg/mL EGCG标准溶 液依次点样1.5,2,3,5,8,12,17,25 μL,EGCG 标准溶液经HPTLC 分离,用FeCl3浸渍,FeCl3均匀分布于整块薄层板上,含有EGCG 的区域(图1a 各轨道的变色区域)由黄棕色变为黑色,而其它区域保持黄棕色不变。使用不同流动相进行HPTLC 分离条件优化,结果表明:流动相为氯仿/丙酮/甲酸时,EGCG 的比移值(Rf)为0.21,同一轨道上的目标物质与干扰杂质能够实现良好的分离。将分离浸渍干燥后的结果图用薄层色谱扫描仪扫描8 个轨道,结果见图1b,发现视觉极限值为2 号轨道分离斑点,因此标准曲线的制作舍弃1 号轨道分离斑点,标准曲线见图2 所示,选择2~8 号轨道的7 个点得到标准曲线为y=3.1762x-178.26,R2=0.9974。选择2~6 号轨道的5 个点得到标准曲线为y=3.5009x-358.67,R2=0.9997。最终选择2~6 号轨道5 个点制作的标准曲线,其线性关系好,能够满足定量要求。
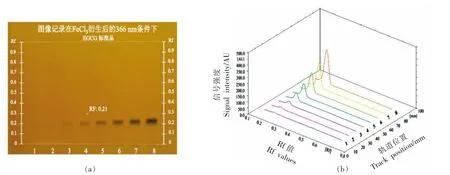
图1 (a)薄层色谱分离衍生(b)光密度扫描结果图Fig.1 (a)Thin layer chromatography separation derivation(b)optical density scan result graph
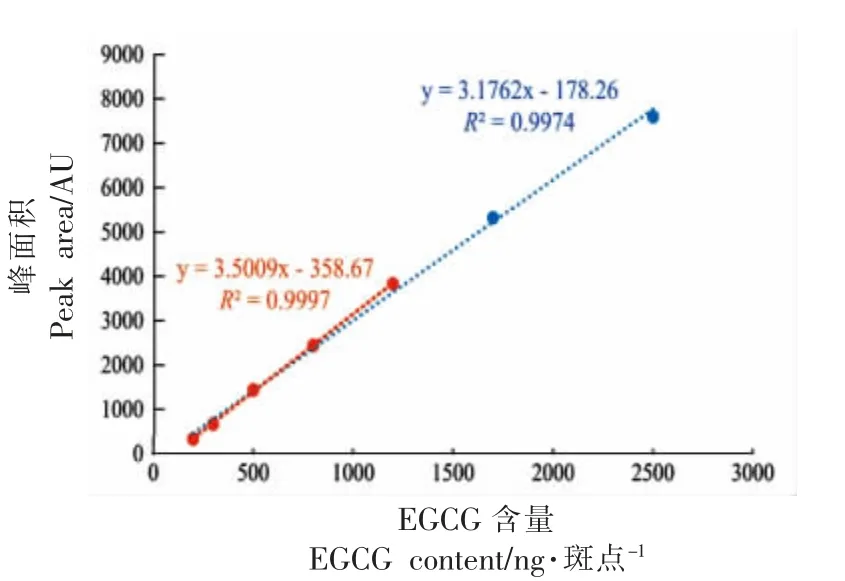
图2 光密度扫描分析所得EGCG 标曲图Fig.2 EGCG reticlegation obtained by optical density scanning analysis
选取优化后的流动相进行色谱分离,得到分离结果见图3a。将样品板分离结果在吸光模式下测量密度。为了确定最佳检测波长,预先分析HPTLC 板上EGCG 的全波长扫描光谱。如图3b所示,显然EGCG 标准品在620 nm 处有最大光吸收,同时样品轨道中的EGCG 条带显示相同的光谱轮廓,表明潜在基质对EGCG 吸光光谱的影响不显著。此外,评估了不同光源的性能,包括氘灯、钨灯、氘灯和钨灯及汞灯。通过比较,选择氘灯和钨灯,因为它不仅提供最高的峰强度,而且有助于色谱图平滑,如图3c 所示。因此,将620 nm 光(氘灯和钨灯)用于定量测定。

图3 没食子儿茶素没食子酸酯标准品(200,400 和800 ng/斑点)和茶饮料样品提取物的HPTLC 分离和密度测定Fig.3 HPTLC separation and density determination of gallocatechin gallate standards(200,400 and 800 ng/zone)and rice flour sample extracts
2.2 HPTLC-光密度方法验证
2.2.1 HPTLC-光密度方法的定量性能 为进一步评估优化后光密度的定量性能,在标准曲线的基础上确定方法的检测限(LOD)和定量限(LOQ)。EGCG 在200~1 200 ng/斑点范围具有良好的线性关系(R2=0.9997)。根据德国DIN32645方法[30],以至少95%的置信区间确定方法的LOD和LOQ。通过计算得出EGCG 的LOD 和LOQ 分别为25 ng/斑点和50 ng/斑点。将样品提取物的上样量固定在10 mL,这相当于茶饮料样品中EGCG的LOD 和LOQ 分别为2.5 mg/kg 和5 mg/kg。如果需要,就可通过使用更大的上样量来增加检测能力。任何情况下,即使在极低水平下,该检测能力应足以定量检测EGCG,因为茶饮料中茶多酚(儿茶素类约占20%)的含量一般50~80 mg/kg[30]。同时该方法也取得非常高的精密度(RSD<8.2%),因此建立的HPTLC-光密度方法用于测定EGCG 含量具有很强的实用性。
2.2.2 HPTLC-光密度方法的准确性 为进一步评估优化后HPTLC-光密度方法的准确性,选取3种茶饮料进行加标回收率试验。在选取的茶饮料1、茶饮料2、茶饮料3 样品中分别添加20,40,80 mg/kg 的EGCG 的标准溶液,结果见表2。添加不同浓度的EGCG 的标准溶液后,茶饮料1、茶饮料2、茶饮料3 的回收率分别在103.5%~110.8%,95.3%~111.2%,99.3%~111.2%之间,表明HPTLC-光密度方法测定样品中的EGCG 具有较高的准确性。因此,以上结果证明所建立的方法可以用于筛检茶饮料中EGCG 的含量,这对一款茶饮料价值的评估起到积极作用。
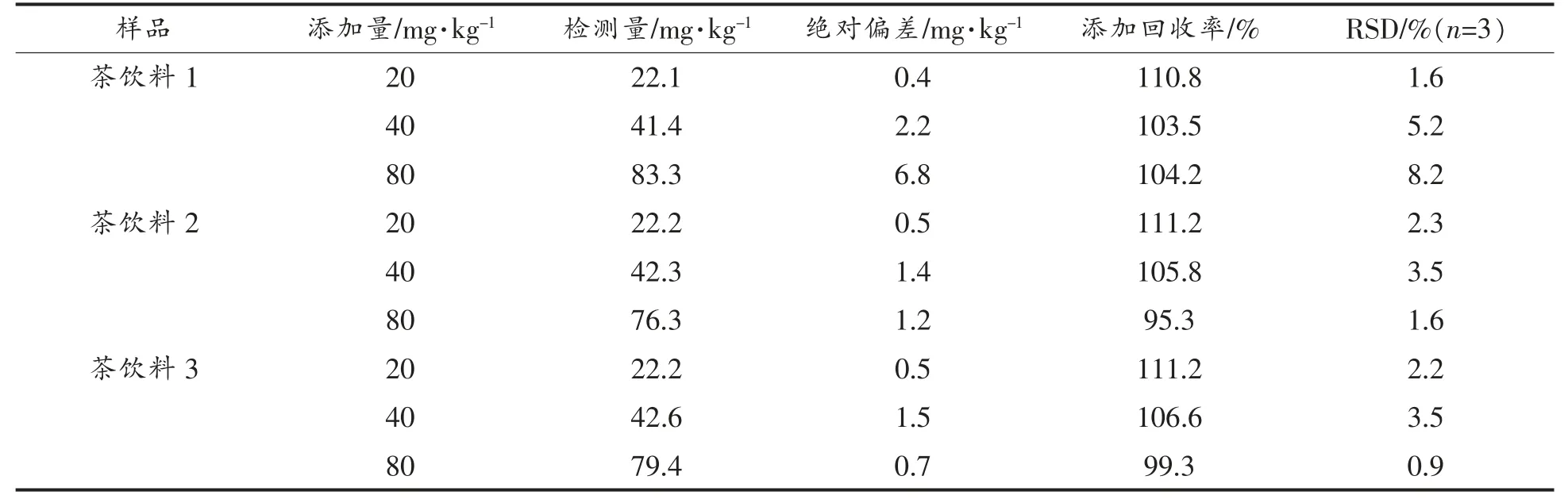
表1 HPTLC-光密度的准确性和精密度评估Table 1 Accuracy and precision evaluation of HPTLC-densitometometric analysis
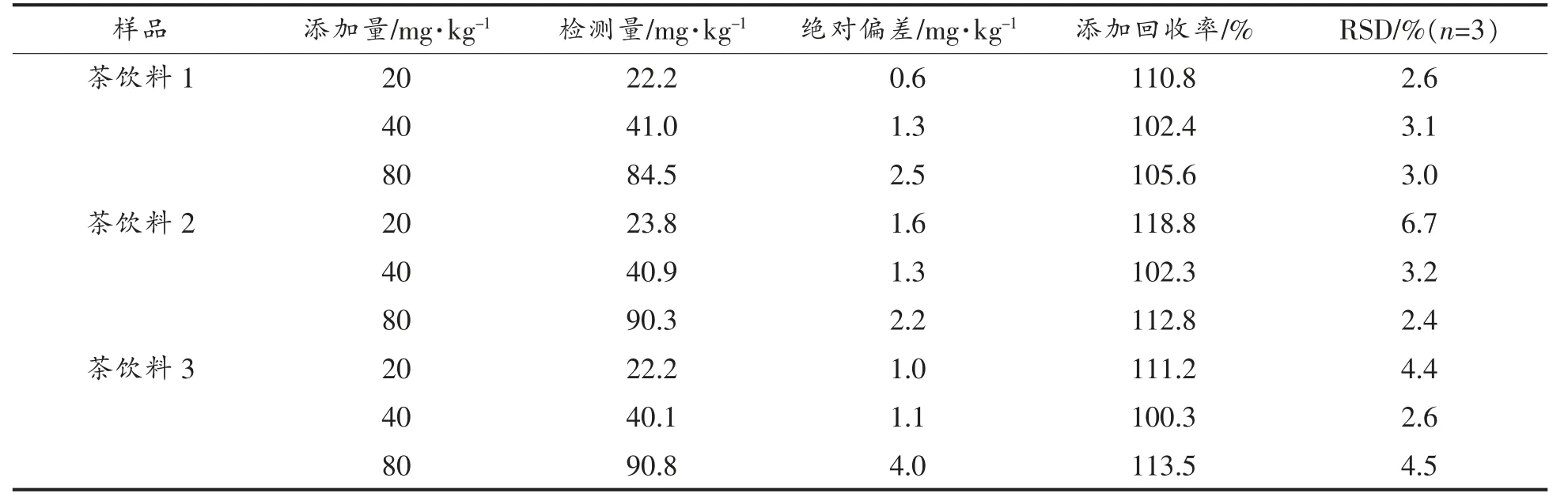
表2 HPTLC-ImageJ 的准确性和精密度评估Table 2 Accuracy and precision evaluation of HPTLC-ImageJ
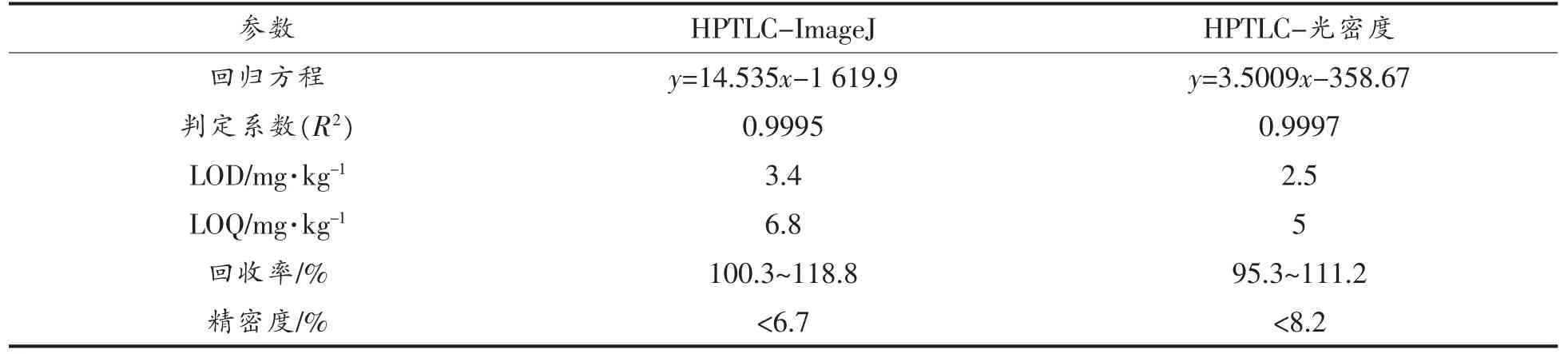
表3 方法对比Table 3 Method comparison
2.3 HPTLC-ImageJ 定量方法的建立
经ImageJ 软件将HPTLC 分离结果图拆分为“蓝、红、绿”3 个颜色通道,如图4 所示,(a)“蓝色”通道下目标斑点不显现,于是,选择“红,绿”两种颜色通道制作标准曲线。如图5 所示,取2~6轨道的5 个点制作标准曲线,在“红色”通道下,200~1 200 ng/斑点范围内标准曲线为y=11.87x-1 961.2,R2=0.9983;在“绿色”通道下,200~1 200 ng/斑点范围内标准曲线为y=14.535x-1 619.9,R2=0.9995,因此选择相关性更高的绿色通道下得到的标准曲线做后续分析。

图4 经ImageJ 拆分成3 个颜色通道Fig.4 Split into three color layers by ImageJ

图5 (a)红色和(b)绿色通道下的EGCG 的标准曲线图Fig.5 Standard curves of EGCG under the red layer(a)and the green layer(b)
2.4 HPTLC-ImageJ 方法验证
2.4.1 HPTLC-ImageJ 定量方法验证 在200~1 200 ng/斑点范围,绿色颜色通道下,EGCG 具有良好的线性关系(R2=0.9995)。根据德国DIN32645方法[31],以至少95%的置信区间确定方法的LOD和LOQ。通过计算得出EGCG 的LOD 和LOQ 分别为34 ng/斑点和68 ng/斑点。将样品提取物的上样量固定在10 mL,这相当于茶饮料样品中EGCG的LOD 和LOQ 分别为3.4 mg/kg 和6.8 mg/kg。如果需要,可使用更大的上样量来增加检测性能。
2.4.2 HPTLC-ImageJ 方法的准确性 在选取的茶饮料1、茶饮料2、茶饮料3 样品中分别添加20,40 mg/kg 和80 mg/kg 的EGCG 的标准溶液,结果见表2。添加不同浓度的EGCG 标准溶液后,茶饮料1、茶饮料2、茶饮料3 的回收率分别在102.4%~110.8%,102.3%~118.8%,100.3%~113.5%之间,表明HPTLC-光密度扫描对样品中EGCG 的测定有较高的准确性。3 次平行分析所得RSD<6.7%,证明所建方法具有良好的精密度。
2.5 两种方法对比
HPTLC-ImageJ 和HPTLC-光密度的线性相关系数相差不大且均在0.999 以上。两种方法的回收率均满足要求,具有良好的准确性。两种方法的精密度相差不大,HPTLC-ImageJ 略优于HPTLC-光密度扫描。综上,HPTLC-ImageJ 可以代替HPTLC-光密度扫描,其准确、经济、高效。
3 结论
本章建立了HPTLC-ImageJ 和HPTLC-光密度两种快速检测茶饮料中活性物质EGCG 含量的方法。HPTLC-ImageJ 方法中“蓝色”通道下像素分析得到的标准曲线相关性系数高于“红色”通道,因此,本试验分析在“绿色”通道下进行。对比两种方法,它们的线性、准确度和精密度非常接近,使用ImageJ 图像数字化处理软件代替光密度扫描仪节省了成本,具有实际应用意义。
