动物双歧杆菌乳亚种V9 连续传代过程中遗传稳定性评价
2023-11-26刘凯龙刘晓晔姚国强
刘凯龙,黄 天,刘晓晔,玉 霞,姚国强
(内蒙古农业大学 乳品生物技术与工程教育部重点实验室 农业农村部奶制品加工重点实验室内蒙古自治区乳品生物技术与工程重点实验室 呼和浩特 010018)
益生菌即活的、被足量摄入后对宿主有益的微生物[1],具有降胆固醇、增强免疫、改善胃肠道功能以及抗病毒等作用[2-5]。益生菌一般分为双歧杆菌属、乳植杆菌属、乳酪杆菌属等[6],其中双歧杆菌属是最早定殖于人体肠道,作为婴幼儿肠道内的核心菌群,对于理想肠道菌群的建立至关重要[7-8]。目前,动物双歧杆菌乳亚种作为益生菌已被深层次研究并广泛应用到食品加工领域及医疗领域等,然而在菌株生产、使用过程中,通常会出现形态突变、碳水化合物利用能力下降、生长周期延长等衰退现象[9],因此对于菌株的遗传稳定性评估尤为重要。目前对益生菌遗传稳定性的研究包括对其连续传代过程中的表型特性、细胞学、分子生物学等方面[10]。随着高通量技术的发展,可在基因层面实现对菌株的遗传稳定性评估,并根据测序结果,推测基因数目、功能及表达机制,揭示菌株的直系同源序列,从而分析其遗传特性和验证表型演化[11-12]。
前期研究表明动物双歧杆菌乳亚种(Bifidobacterium animalis subsp.lactis,B.animalis subsp.lactis)V9 对胃肠的消化液具有良好的耐受性,体外试验表明,该菌株经胃肠道消化后存活率为92.44%,可耐受的胆盐质量浓度为0.3 g/100 mL[13],并对肠道致病菌具有拮抗作用,可显著提高腹泻康复率,调节免疫等益生功能[14-15]。本研究拟评价动物双歧杆菌乳亚种V9 连续传代培养过程中的遗传稳定性,从菌体形态变化、碳水化合物利用能力等表型稳定性方面着手,并结合比较基因组学分析其进化的基本规律,评价其遗传稳定性,为动物双歧杆菌乳亚种V9 的进一步开发及产业化提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株与试剂 动物双歧杆菌乳亚种V9(V9),由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供。
TPY 液体培养基(配方:葡萄糖5.00 g/L,水解酪蛋白10.00 g/L,大豆胨5.00 g/L,酵母粉2.00 g/L,K2HPO42.00 g/L,氯化镁0.50 g/L,硫酸锌0.25 g/L,氯化钙0.15 g/L,氯化铁0.002×10-3g/L,Twain-80 1.00 g/L,MgSO47H2O 0.10 g/L,L-半胱氨酸0.50 g/L),卡迈舒生物科技有限公司;琼脂糖、核酸染料、2 000 DNA Marker 等,大连宝生物技术有限公司。
1.1.2 设备与仪器 离心机,贝克曼库尔特商贸(中国)有限公司;恒温培养箱,恒科技仪器股份有限公司;pH 计,梅特勒(上海)公司;紫外分光光度计,NanoDrop 公司;BX50 光学显微镜,OLYMPUS 公司(日本);Applied biosystems PCR 仪,伯乐公司等。
1.2 试验方法
1.2.1 V9 活化及传代培养
1.2.1.1 生长曲线的测定 将-80 ℃冷冻保藏的供试菌株接种于TPY(表1)液体培养基中,接种量为1%(体积分数),37 ℃严格厌氧培养(24±0.5)h,每隔2 h 取样(N=3),于波长600 nm 处测定其吸光值、pH 值,绘制生长曲线。

表1 TPY 液体培养基Table 1 TPY liquid medium
1.2.1.2 连续传代培养 将-80 ℃冷冻保藏的V9原始菌种活化2 代后划线于固体TPY 培养基上,37 ℃厌氧培养(72±0.5)h,挑取单菌落,接种于新鲜液体培养基中,继续培养24 h,再以体积分数1%的接种量接种于新鲜液体培养基中连续传代培养,将0,25,50,75,100 代分别标记为A0,A25,A50,A75 和A100。
1.2.1.3 菌株代数的计算 通过1.2.1.1 节确定的稳定期时间作为传代培养时间,公式为:
式中:N0——以1%接种量接入新鲜液体培养基的初始活菌数,CFU/mL;Nf——稳定期活菌数,CFU/mL。
1.2.2 V9 连续传代培养过程中表型检测
1.2.2.1 菌体形态观察 连续培养100 代过程中,对不同代时的V9 进行革兰氏染色、镜检、观察菌体形态,并初步确认菌株纯度。
1.2.2.2 碳水化合物代谢能力 按照API 50CHL试剂盒说明书制备。将A0、A25、A50、A75 和A100菌悬液吸至API 50CHL 碳水化合物鉴定试剂条中,用无菌石蜡封口,37 ℃严格厌氧培养(48±0.5)h,查看显色结果。培养液中所含溴甲粉紫指示剂变为黄色(25 号管变为黑色)为阳性反应,表明该菌株可利用对应的碳水化合物;反之为阴性反应,表明该菌株不可利用对应碳水化合物。49 种碳水化合物见表2。
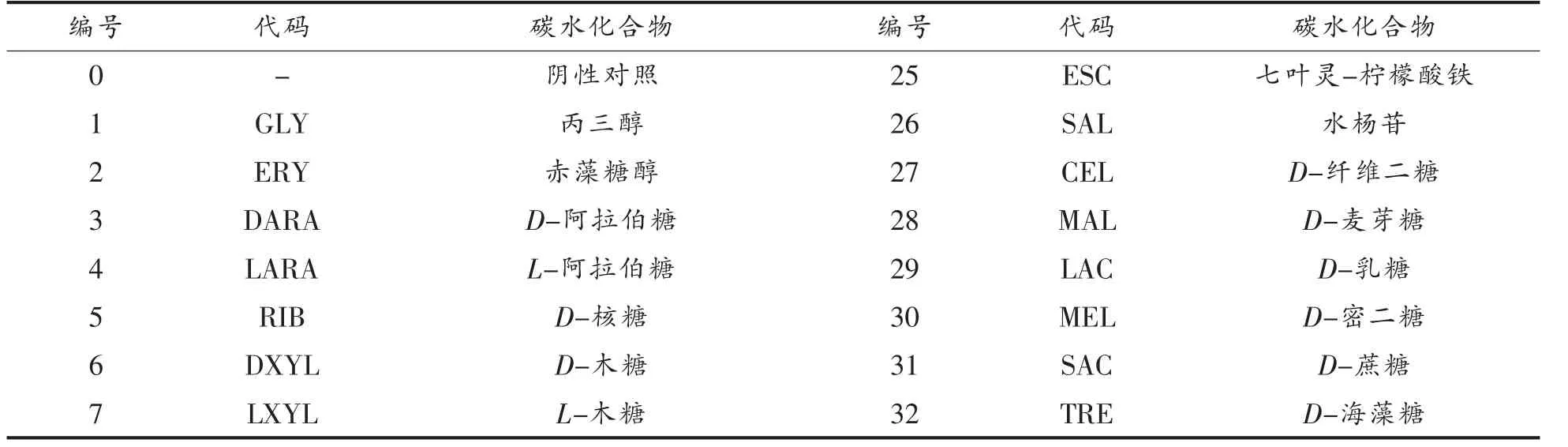
表2 API 50 CHL 乳杆菌鉴定系统各种碳水化合物一览表Table 2 API 50 CHL Lactobacillus identification system list of various carbohydrates
1.2.3 V9 基因组分析
1.2.3.1 基因组DNA 提取及纯度检测 对V9 的A0、A25、A50、A75 和A100 提取DNA,将提取的DNA通过Nanodrop 进行纯 度测定(A260nm/A280nm,A260nm/A230nm),使用琼脂糖凝胶电泳对条带完整度及纯度进行检测。使用STE 传统方法对菌株全基因组进行提取,纯度检测同上,浓度检测使用Qubit,满足要求后通过Nanopore 平台进行全基因组测序。
1.2.3.2 组装及环化 通过NextDenovo 软件组装,然后使用Circlator 软件将二代数据进行环化[17]。通过Pilon 软件使用二代数据对三代数据进行Polish[18-19]。最终获得不同代时的V9 全基因组序列。
1.2.3.3 平均核苷酸一致性计算 参考Goris等[20]的方法,对V9 不同代时菌株基因组与其原始基因组进行平均核苷酸一致性计算,用自制Perl 脚本比较菌株间的平均核苷酸一致性值。
1.2.3.4 SNP 位点分析 以V9 原始序列作为参考基因组,使用Mummer 软件对菌株不同代时的SNP 位点进行识别分析,利用Soapsnp 软件进行SNP 位点检测验证[21]。
1.2.3.5 系统发育树构建 将1.2.2.4 节识别的SNP 位点整理成序列,利用软件ITOL 构建系统发育树,进行可视化。
1.2.3.6 碳水化合物活性酶分析 将V9 不同代时菌株的全基因组与碳水化合物活性酶(CAZymes)数据库进行功能注释,根据注释结果统计菌株中潜在的CAZymes 家族,通过TBtools软件进行可视化。
1.3 数据处理
2 结果与分析
2.1 V9 生长曲线
微生物的不同生长周期,菌种的生理状态有所差异[22]。菌种的传代通常选择对数生长期末期或者稳定期初期为宜。吸入射光(OD600nm)会因细胞的散射作用而呈现对应的变化趋势,当吸光值为600 nm 时,在一定程度上可以反映培养液中V9的生长变化趋势[23],如图1 所示。

图1 动物双歧杆菌乳亚种V9 原始菌株生长曲线Fig.1 The growth curve of the original B.animalis subsp.lactis V9
V9 在37 ℃、厌氧培养24 h 过程中pH 值、OD600nm的变化趋势:0~8 h V9 处于延滞期,OD600nm上升缓慢,8 h 后进入对数生长期,OD600nm迅速上升,pH值大幅度下降,20 h 时OD600nm达到最 大值,之后趋于平缓,进入稳定期。
2.2 V9 菌株代数计算结果
根据上述绘制的V9 生长曲线,对其在生长初始及稳定初期进行活菌计数,计算菌株的代数。具体结果见表3。V9 初始活菌数为(2.70±0.52)×106CFU/mL,对数末期活菌数为(2.79±0.24)×108CFU/mL,参照1.2.1.3 节菌株生长代时计算方法,到达稳定期V9 的生长代数约为6.69 代,且在20 h 进入稳定期,故以24 h 为传代周期,平均每天传1 次,约6.69 代,连续传100 代,约15 d 完成。
表3 动物双歧杆菌乳亚种V9 原始菌株代数结果(n=3,)Table 3 Algebraic results of the starting strain of B.animalis subsp.lactis V9(n=3,)

表3 动物双歧杆菌乳亚种V9 原始菌株代数结果(n=3,)Table 3 Algebraic results of the starting strain of B.animalis subsp.lactis V9(n=3,)
表4 不同代时动物双歧杆菌乳亚种V9 碳水化合物(API 50CHL)利用情况(n=3,)Table 4 Utilization of carbohydrates(API 50CHL)of B.animalis subsp.lactis V9 in different generations(n=3,)
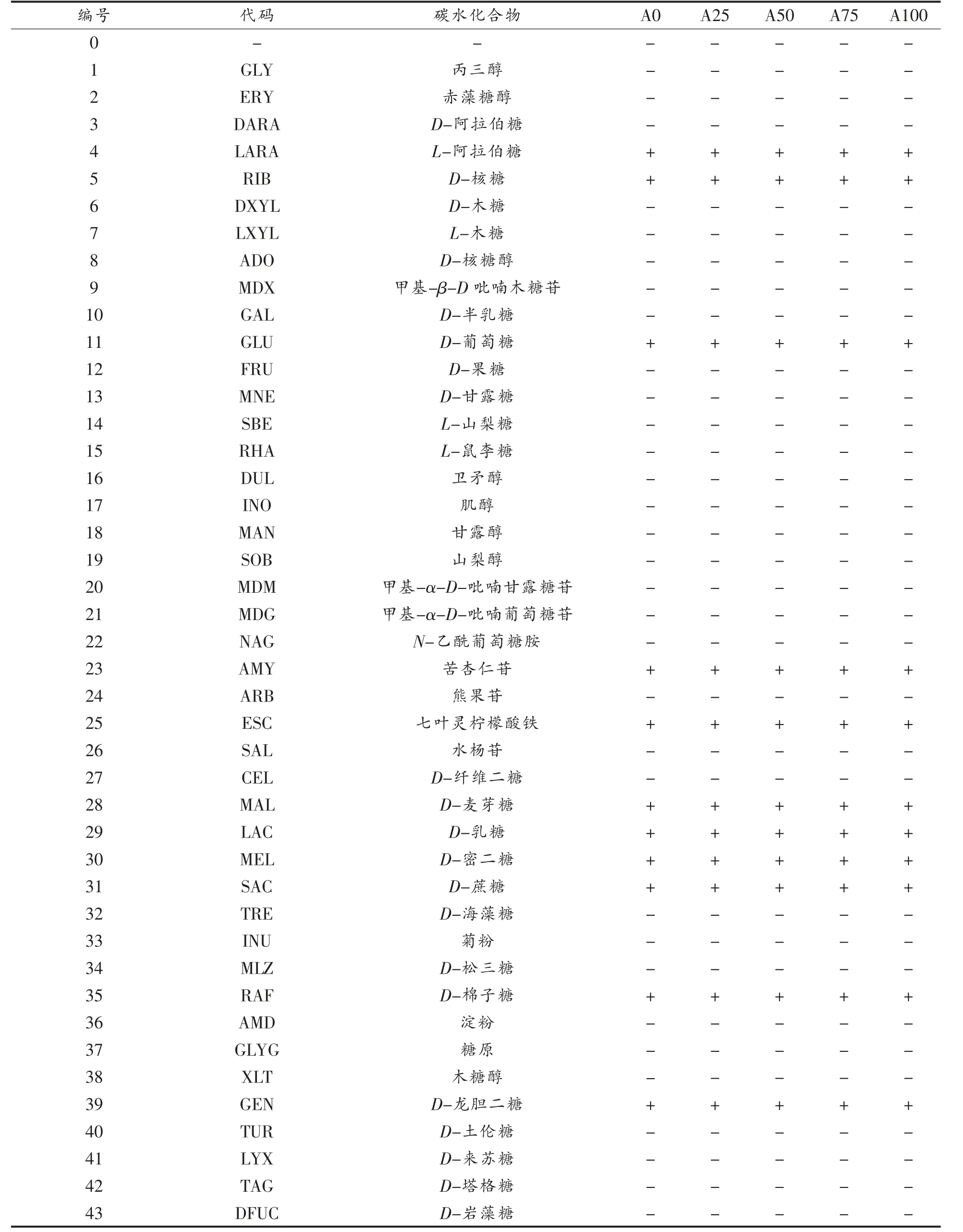
表4 不同代时动物双歧杆菌乳亚种V9 碳水化合物(API 50CHL)利用情况(n=3,)Table 4 Utilization of carbohydrates(API 50CHL)of B.animalis subsp.lactis V9 in different generations(n=3,)
(续表4)
注:“+”表示可利用;“-”表示不可利用。
2.3 V9 连续传代培养过程中表型研究
2.3.1 菌株连续传代过程中的菌体形态观察 对V9 在A0、A25、A50、A75 和A100 菌悬液进行 革兰氏染色,显微镜下观察菌体形态。对比结果见图2。V9 连续传100 代菌体形态均属于动物双歧杆菌典型形态,且不同代时的菌体形态无明显差异。
2.3.2 碳水化合物代谢能力 梅里埃碳水化合物鉴定(API 50CHL)试剂盒可对不同碳水化合物的代谢能力进行分析,并用于菌株鉴定或分型。V9可利用12 种碳水化合物,包括L-阿拉伯糖、D-核糖、D-葡萄糖、苦杏仁苷、七叶灵柠檬酸铁、D-麦芽糖、D-乳糖、D-密二糖、D-蔗糖、D-棉子糖和D-龙胆二糖,且V9 在A0、A25、A50、A75 及A100时碳水化合物代谢能力无显著差异(P>0.05)。
2.4 V9 连续传代中基因组研究结果
2.4.1 GTDB 基因组数据库比对 利用NextDenovo 软件对3 代测序得到的原始Reads 进行组装,组装完成后将5 个代时的V9(N=3)分别与GTDB数据库比对,结果见表5。GTDB 比对结果显示该菌株属于动物双歧杆菌(Bifidobacterium animalis)。

表5 GTDB 比对结果Table 5 GTDB comparison results
2.4.2 基因组信息 利用Circlator 软件将组装后的三代数据进行环化,并使用Pilon 软件对Nanopore 测序数据进行验证[17]。最终得到不同代时V9 的基因组序列。分析其基因组信息,结果显示A0、A25、A50、A75 和A100 的V9 平均基因组大小为1.96 Mb,平均GC 含量为60.48%,且无质粒,结果见表6。参考基因组的大小为1.94 Mb,GC含量为60.50%,传代过程中的不同代时V9 与原始参考菌株基因信息无显著差异(P>0.05)。
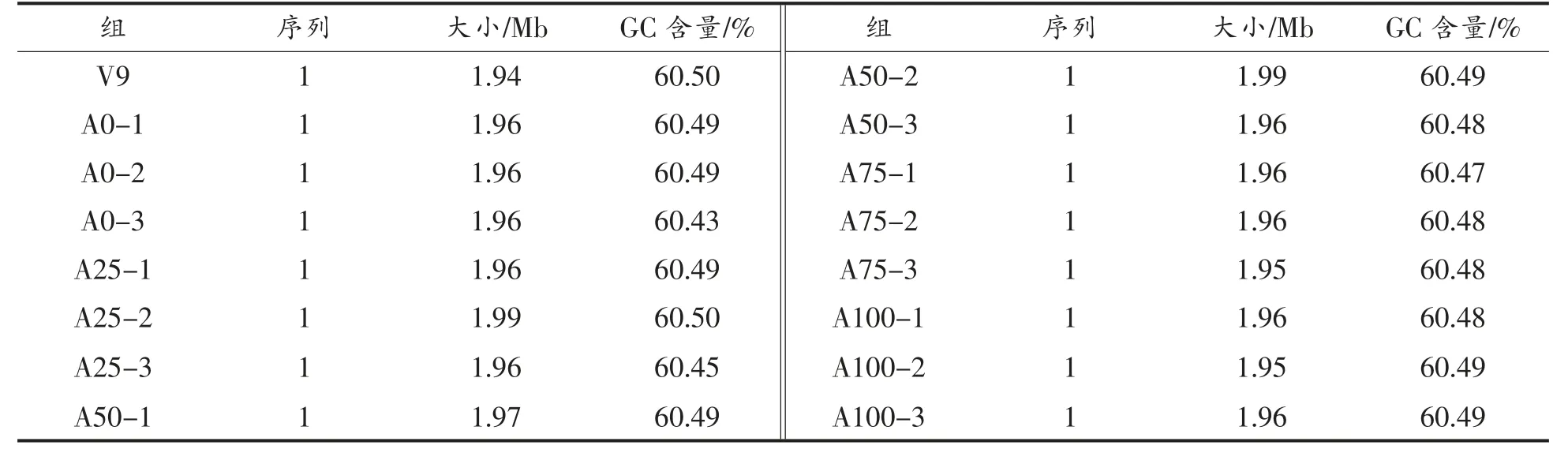
表6 动物双歧杆菌乳亚种V9 基因组信息Table 6 B.animalis subsp.lactis V9 genome information
2.4.3 ANI 计算 平均核苷一致性(ANI)是反映近缘菌株间平均碱基相似度最重要的指标。通常,当ANI 值大于95%时为同一种或亚种[24]。为了在基因组水平上评估V9 连续传代过程中菌株间的遗传关系,计算V9 5 个代时的ANI 值,并用TBtools 软件对ANI 值可视化。如图3 所示,不同代时的V9 间表现出高度相似性,ANI 值均大于99.99%,表明传代过程中菌株均属同一亚种,即动物双歧杆菌乳亚种。
2.4.4 SNP 分析 单核苷酸多态性(SNP)是指在基因组层面上,因单个核苷酸的变异而导致的DNA 序列的多态性[25]。本研究以V9 原始序列作为参考基因组,对不同代时的株菌SNP 位点进行识别分析,结果发现在不同代时株菌中共鉴定到42个SNP 位点,其中包括4 个同义突变,9 个非同义突变,其余29 个位于基因间区。将SNPs 位点结合gff 进行功能注释,得到与SNPs 突变相关的基因及功能,如表7 所示。非同义突变分别位于ISL3样元素IS2001 家族转运酶、ABC 转运蛋白ATP结合蛋白/渗透酶、C69 家族二肽酶、糖苷-戊苷-己酮阳离子同向转运的基因上,同时这些突变均未发生在影响碳水化合物酶功能的基因上。
在连续传代的过程中高频突变数量较少,检测到5 个SNP 发生在第0 代基因组与参考基因组之间,一旦建立将稳定存在。菌株低频突变被检测到的数量均小于21,其鉴定为同一菌株。分析发现0 代的菌株与25 代菌株相比,没有稳定遗传的SNP 位点,A25-3 与A50-3 菌株在同一基因位点仅发现一个SNP;第50 代与75 代不存在相同位点SNP;A75-1 与A100-1 菌株在同一基因位点仅发现一个SNP,并没有稳定遗传。陈霞[25]以动物双歧杆菌乳亚种AD011 全基因组序列作为参考,研究发现动物双歧杆菌乳亚种V9、Bi04 和DSM10140 共存在276 个SNP 位点,其中包括38个同义突变、178 个非同义突变、60 个位于基因间区,平均每株菌拥有92 个SNP,判定为少数突变。相比较V9 不同代时的SNP 多态性极少,遗传异质性较低,因此,V9 在连续传代过程中有较好的遗传稳定性。
2.4.5 系统发育树 系统发育树可直观反映同一群体内不同个体间的遗传距离,通过其判断菌株在连续培养过程中的稳定性[27]。聚集在同一分支,表明菌株之间的多样性较低,遗传距离较近。进一步了解V9 不同代时15 株的遗传距离,以V9 原始基因组序列为参考基因组,基于15 株菌的SNPs 序列,构建系统发育树,如图4 所示。不同代时的V9 与参考基因组聚在同一分支,亲缘性较近,具有高度相似的遗传特性。
2.4.6 碳水化合物活性酶注释 碳水化合物是生物体维持生命活动所需能量的主要来源。碳水化合物活性酶数据库(CAZy)是物质对碳水化合物及其衍生物的合成及分解的酶类数据库[26],其将碳水化合物活性酶分成为六大基因家族,包括糖苷水解酶(GHs)家族、糖基转移酶家族(GTs)家族、多糖裂解酶(PLs)、碳水化合物酯酶(CEs)、辅助氧化还原酶(AAs)和碳水化合物链接模块(CBMs)[27]。其中GH s 家族主要作用是糖苷键的水解和重排,GTs 家族主要作用是糖苷键的形成,PLs 家族主要作用是糖苷键的非水解裂解,CEs 家族主要作用是水解碳水化合物的酯类,AAs 家族主要作用是与CAZymes 协同作用的氧化还原酶,CBMs 家族主要作用是与碳水化合物结合。为在全基因组水平上了解V9 不同代时菌株对碳水化合物的代谢能力,通过碳水化合物活性酶数据库在DBCAN2 网站上对V9 的碳水化合物活性酶功能基因进行分析,结果如图5 所示。
共注释到四大类碳水化合物活性酶的62 个小类基因家族,包括15 个糖苷水解酶家族(GH)、7 个糖基转移酶家族(GT)、6 个碳水化合物结合结构域家族(CBM)和3 个碳水化合物酯酶家族(CE)。不同代时菌株注释到的碳水化合物活性酶类不存在显著差异(P>0.05),碳水化合物代谢相关基因基本一致。由此表明V9 不同代时菌株碳水化合物代谢功能基因高度保守,遗传稳定性良好。
3 结论
对动物双歧杆菌乳亚种V9 连续传100 代过程中的表型特征及基因组稳定性进行评价,结果表明:V9 在连续传100 代过程中具有稳定的表型特征、分子遗传特征,表明其具有良好的遗传稳定性,有利于产业化应用。
