电压门控钾通道亚家族G成员1在肺癌中的表达及生物学作用
2023-11-24程峰彭诗晴曹杨陆益民
程峰, 彭诗晴, 曹杨, 陆益民
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 江苏大学附属昆山医院呼吸与危重症医学, 江苏 苏州 215300)
肺癌以侵袭度高、病情进展快、预后差为主要特征[1]。根据2020年全球癌症研究报告,肺癌约占所有癌症病例11.4%,致死率约占所有癌症病例18.0%[2]。目前,外科手术、免疫治疗和化疗是肺癌主要的治疗手段,但晚期肺癌患者恶性程度高,远处转移风险高,总生存期短,预后差[3-6]。
钾离子通道蛋白是一类跨膜蛋白,在调节神经信号传导,防止神经元过度兴奋和上皮电解质转运等方面起关键作用[7-9]。最新研究表明,由于其结构和功能的多样性,钾离子通道蛋白的异常表达参与多种肿瘤的发生[10-11],包括胃癌[12]、前列腺癌[13]和宫颈癌[14]等。电压门控钾通道亚家族G成员1(potassium voltage-gated channel subfamily G member 1,KCNG1)为钾离子通道家族成员之一,定位于染色体20q 13.13,通过与kv2.1(电压门控钾通道亚家族B成员1,KCNB1)形成功能性四聚体通道调控该离子通道的生物学功能[15]。目前关于KCNG1的研究多集中在房颤[16]和癫痫[17]等,仅Du等[18]证实KCNG1可作为头颈部鳞状细胞癌的一个预后指标。本研究拟基于生物信息学分析,并结合体外细胞功能学实验初步验证KCNG1在肺癌中的表达及生物学功能。
1 材料与方法
1.1 生物信息学分析
1.1.1KCNG1mRNA差异表达分析 基于TCGA泛癌数据集(https://www.cancer.gov/tcga/)下载肺癌样本高通量测序数据(HTSeq),包含1 145份非配对组织样本(癌旁组织108例,肺癌组织1 037例)和212例配对组织样本(癌旁组织106例,肺癌组织106例),采用R软件(第3.6.3版)进行统计分析,并结合ggplot2软件包进行可视化,KCNG1mRNA在两组间表达差异采用Wilcoxon秩和检验进行比较分析。
1.1.2KCNG1mRNA表达与肺癌患者临床病理特征、预后的关系及预测模型的构建 从TCGA泛癌数据集下载肺癌样本高通量测序数据,根据KCNG1mRNA相对表达水平中位数分为KCNG1mRNA高表达组及低表达组,采用χ2检验分析KCNG1mRNA表达水平与肺癌患者临床病理特征的相关性。
采用Kaplan-Meier曲线和log-rank检验比较KCNG1mRNA高表达组和KCNG1mRNA低表达组患者总体生存期;并针对不同病理特征的肺癌患者,比较KCNG1mRNA高表达和低表达者的生存差异。
基于肺癌患者的预后对不同的临床病理特征、KCNG1mRNA表达水平等进行单因素Cox回归分析并将结果绘制成森林图;进一步采用多因素Cox回归分析,并纳入P<0.05的因素,采用R软件中RMS软件包建立列线图模型,预测肺癌患者1年、3年、5年总生存期。预测模型通过校准曲线进行可视化评估,良好列线图预测模型的散点落在45°对角线上[19]。
1.1.3 KCNG1相关差异表达基因分析 采用R软件中DESeq2软件包对KCNG1mRNA高表达组及低表达组间差异表达基因进行分析鉴定。筛选阈值设置为|log2[差异倍数(fold change,FC)]|>1.5,一般默认|log2(FC)|>1为差异基因的筛选标准和校正后P值<0.05,采用火山图可视化筛选后的差异基因,并在热图中显示与KCNG1相关的差异基因。
1.1.4 GO/KEGG富集分析和GSEA 采用clusterProfiler软件包(3.14.3版本)对KCNG1相关差异表达基因进行GO和KEGG富集分析,GO富集分析KCNG1主要参与的生物学过程、细胞分布和分子功能;KEGG富集分析KCNG1相关差异表达基因主要参与的信号通路,并映射成气泡图。GSEA是基于TCGA数据库中肺癌组织的转录本数据,采用clusterProfiler包(3.14.3版本)进行富集分析,设定标准:错误发现率<0.25及校正后P值<0.05。
1.2 细胞实验
1.2.1 细胞系、主要试剂和仪器 人肺癌A549、H1299细胞系及人肺泡上皮细胞购自中国科学院上海生物科学研究所;F-12K培养液、胎牛血清、胰蛋白酶购自美国Gibco公司;KCNG1小干扰试剂盒、KCNG1引物和5-乙炔基-2′-脱氧尿苷(EdU)检测试剂盒购自广州锐博生物技术公司;RNA快速提取试剂盒购自上海奕杉生物有限公司;逆转录试剂盒及SYBR Green染料购自康为世纪生物科技有限公司;实时荧光定量PCR(qRT-PCR)仪购自上海宏石医疗科技有限公司;PVDF膜购自德国Millipore公司;兔抗人KCNG1(Sino Biological公司);GAPDH一抗、羊抗兔IgG(英国Abcam公司);增强化学发光试剂(ECL,德国Millipore公司);Transwell小室、Matrigel基质胶(美国Corning公司);血管生成拟态实验试剂盒(德国Ibidi公司);多功能酶标仪(瑞士Tecan公司);荧光显微镜(日本Olympus公司)。
1.2.2 细胞转染及分组 将处于对数生长期的肺癌A549和H1299细胞以每孔3×104个密度接种于6孔板中,分为KCNG1敲低组1、KCNG1敲低组2以及对照组。待细胞融合率接近50%时,将两个不同小干扰siRNA序列及阴性对照组siRNA序列分别转入A549及H1299细胞中,转染36~48 h;收集各组细胞用于后续实验,采用蛋白质免疫印迹法验证转染效率。siRNA序列如下:KCNG1敲低组1,TCCTCAACGTGTGCGATGA;KCNG1敲低组2,TCAACGTAGGCGGCATCAA。
1.2.3 qRT-PCR检测KCNG1mRNA表达水平 采用RNA快速提取试剂盒提取细胞中总RNA,然后逆转录合成cDNA,最后用SYBR Green PCR Master Mix配置20 μL反应体系行qRT-PCR。具体反应体系:10 μL 2×Ultra SYBR Mixture、0.4 μL上游引物、0.4 μL下游引物、0.8 μL cDNA、8.4 μL双蒸水。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min。β-肌动蛋白为内参。引物序列:KCNG1上游5′-TACTCGCTGCCCTGGACC-3′,KCNG1下游5′-AAGGTCAGGATAGTGCCGAAG-3′;β-肌动蛋白上游5′-TCAAGATCATTGCTCCTCCTGAG-3′,β-肌动蛋白下游5′-ACATCTGCTGGAAGGTGGACA-3′。通过2-ΔΔCt方法计算目的mRNA相对表达水平。
1.2.4 蛋白免疫印迹检测KCNG1蛋白表达水平 将处于对数生长期的细胞接种于6孔板(每孔1×106个),待每孔细胞融合率达90%时,PBS清洗2次;加入蛋白裂解液,并置于冰上裂解15 min;于4 ℃行12 000 r/min离心15 min;取上清液,行BCA蛋白定量;100 ℃变性失活8 min。10% SDS-PAGE 80 V电泳120 min至不同分子量的蛋白完全分离;300 mA转膜90 min,将蛋白转至PVDF膜;10%脱脂牛奶封闭2 h;加入兔抗人KCNG1抗体(1 ∶2 000稀释)及兔抗人GAPDH抗体(1 ∶3 000稀释),4 ℃孵育过夜;TBST洗膜3次,每次6 min;加入二抗羊抗兔IgG(1 ∶4 000稀释)室温孵育2 h;TBST洗膜3次;添加ECL于凝胶成像仪曝光,用Image J软件进行灰度值量化分析。
1.2.5 EdU细胞增殖实验检测细胞增殖能力 将转染siRNA后的A549、H1299细胞及其对照组细胞分别接种至24孔板中(每孔2×104个细胞),孵育24 h;采用EdU细胞增殖试剂盒对细胞进行染色。在荧光显微镜下随机选择3个细胞视野并拍照,计算平均EdU阳性核比率。
1.2.6 Transwell及Matrigel Transwell实验检测细胞迁移和侵袭能力 Transwell及Matrigel Transwell实验均采用8 μm孔径的嵌入小室。分别将转染siRNA后的A549和H1299及其对照组细胞以空白培养液重悬,以每孔3.5×104个细胞密度接种于上室中(Matrigel Transwell实验需要在小室上侧预先包被基质胶),下室加入0.6 mL含20%胎牛血清的F-12K培养液,置于细胞培养箱内孵育24 h;用棉签刮取小室上表面细胞,而小室下侧细胞用4%多聚甲醛固定15 min;2.5%结晶紫染色30 min;倒置显微镜观察,随机选择3个区域拍照并进行细胞计数。
1.2.7 划痕愈合实验检测细胞迁移能力 分别将转染siRNA后的A549和H1299及其对照组细胞接种于6孔板中(每孔约4×105个细胞),当每孔细胞融合度达90%左右时,用相同规格(20 μL)的移液枪枪头在孔内划直线;PBS清洗2遍;加入空白培养液继续培养24 h;显微镜下观察并拍照,通过计算0 h及24 h的划痕面积,比较不同组划痕愈合情况。
1.2.8 血管生成拟态实验检测细胞成管能力 采用血管生成拟态实验试剂盒,在下室中加入10 μL Matrigel基质胶,分别将转染siRNA后的A549及其对照组细胞接种于上室(每室含2×104个细胞),于37 ℃含5% CO2的细胞培养箱中孵育18 h;显微镜下观察并拍照,比较不同组细胞成管的数量。
1.3 统计分析
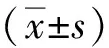
2 结果
2.1 KCNG1 mRNA在肺癌组织中的相对表达水平
基于TCGA数据库共获得1 145份未配对组织样本(108例癌旁组织,1 037例肺癌组织)和212例配对样本(106例癌旁组织,106例肺癌组织),如图1所示,KCNG1mRNA在肺癌组织中的相对表达水平显著高于癌旁组织(P均<0.001)。
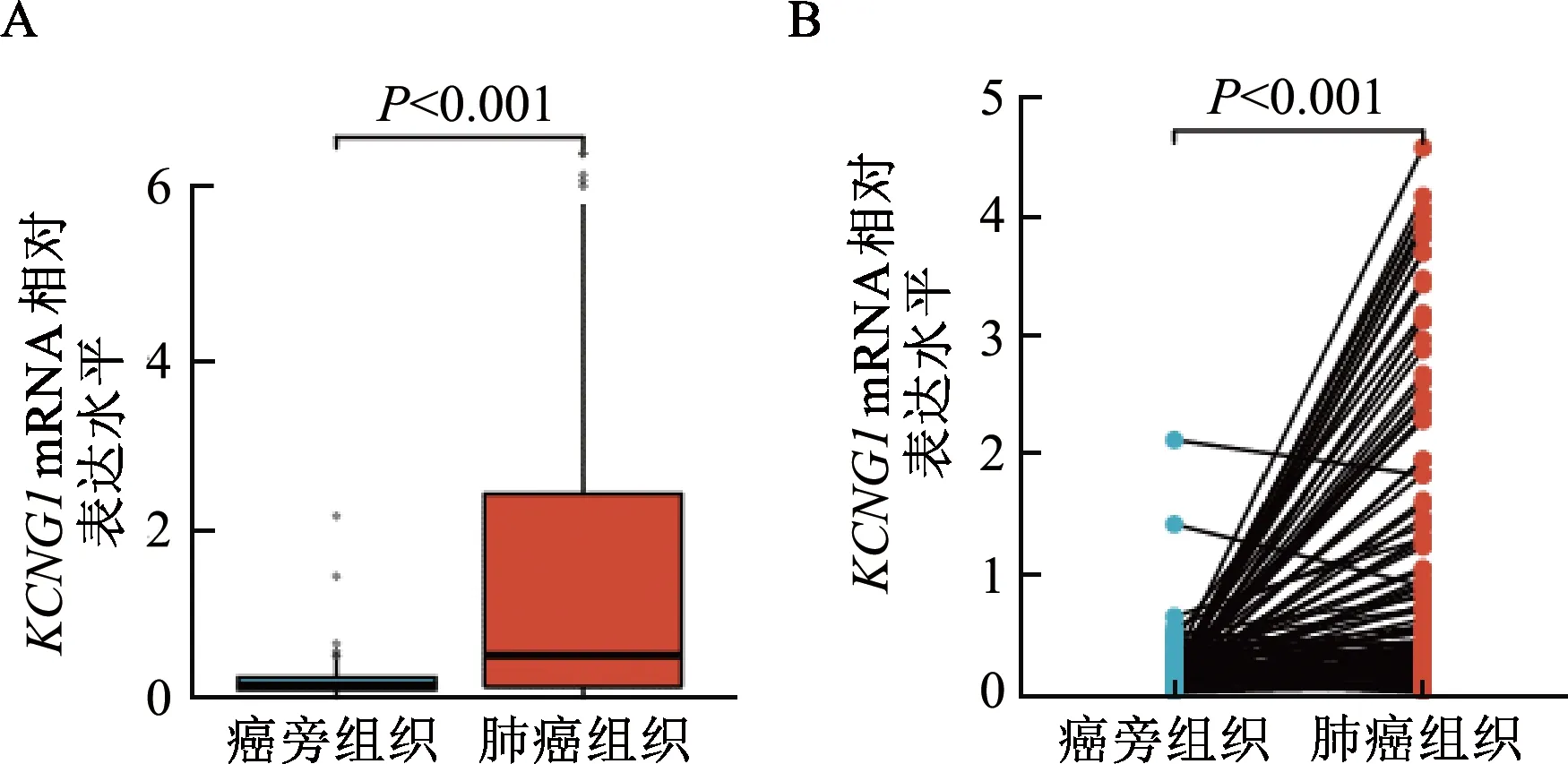
A:非配对样本;B:配对样本
2.2 KCNG1 mRNA相对表达水平与肺癌患者临床病理特征之间的相关性
基于TCGA数据库分析KCNG1mRNA高表达和低表达患者之间临床特征的差异,剔除重复样本后,共纳入609例肺癌患者,如表1所示。结果显示KCNG1mRNA相对表达水平与肺癌患者N和M分期、病理学分级、性别、年龄及吸烟史临床特征相关(P均<0.05)。

表1 KCNG1 mRNA相对表达水平与肺癌患者一般临床特征间的关系
2.3 KCNG1 mRNA过表达与肺癌患者预后相关
如图2所示,与KCNG1mRNA低表达肺癌患者相比,KCNG1mRNA高表达肺癌患者总生存期明显缩短(图3A,HR=1.23,95%CI:1.01~1.50,P=0.037)。此外在T1期、M1期、病理Ⅳ期、疾病进展(PD)和疾病稳定(SD)期、部分缓解(PR)和疾病完全缓解(CR)期、女性、吸烟史>40年的肺癌患者中,与KCNG1mRNA低表达肺癌患者相比,KCNG1mRNA高表达患者总生存期明显缩短(P均<0.05),提示KCNG1mRNA高表达与肺癌患者不良预后相关。

图2 KCNG1 mRNA高表达与低表达肺癌患者总体生存期比较
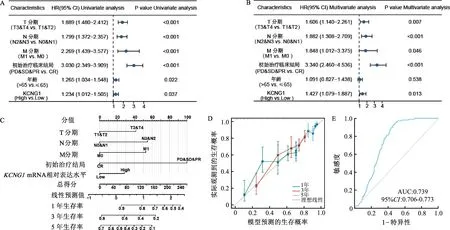
A:肺癌患者不良预后的单因素Cox回归分析;B:肺癌患者不良预后的多因素Cox回归分析;C:预测肺癌患者生存率的列线图模型;D:列线图模型的校准曲线;E:受试者工作特征(ROC)曲线评价KCNG1在肺癌中的预测价值
2.4 基于KCNG1 mRNA表达水平构建肺癌患者列线图模型
单因素Cox回归分析显示,T分期、N分期、M分期、初始治疗临床结局、年龄以及KCNG1mRNA相对表达水平与肺癌患者的不良预后相关(图3A,P均<0.05);进一步Cox多因素回归分析结果显示,KCNG1mRNA相对表达水平是影响肺癌患者预后的独立因素(图3B,HR=1.427,95%CI:1.079~1.887,P=0.013)。据此,纳入影响肺癌患者预后的独立变量并构建预测肺癌患者预后的列线图模型(图3C)。对预测模型进行校正曲线的验证,结果显示校正曲线接近理论的45°对角线,证实预测模型具有良好的预测效能(图3D);同时诊断性ROC曲线也提示KCNG1mRNA相对表达水平在肺癌患者中具有良好的预后评估价值(图3E)。
2.5 KCNG1相关差异表达基因及共表达基因的分析
差异基因分析共得到3 906个KCNG1相关差异表达基因,其中包括1 692个上调基因和2 214个下调基因,如火山图4A所示。热图4B显示与KCNG1表达密切相关的基因,其中包含10个正相关基因和10个负相关基因。见图4。

FPKM:每千个碱基的转录每百万次映射读取的片段数;A:火山图显示与KCNG1相关的差异表达基因;B:热图显示与KCNG1表达正相关的前10个基因;C:热图显示与KCNG1表达负相关的前10个基因
2.6 KCNG1生物学功能分析
GO分析结果表明,与KCNG1相关的差异表达基因主要富集在调节激素分泌、离子转运、神经肽信号和细胞间黏附等生物学过程中(图5A);此外,这些差异表达基因主要富集在突触后膜、细胞外基质、顶端质膜等部分(图5B);在分子功能上,这些差异表达基因主要富集在氧化还原酶活性、神经递质转运体活性、金属离子跨膜转运体活性、丝氨酸型内肽酶抑制剂活性等(图5C);KEGG富集分析提示神经活性配体与受体的相互作用、雌激素信号通路、细胞色素P450代谢、化学致癌和PPAR信号通路与KCNG1相关差异表达基因的表达密切相关(图5D)。
2.7 GSEA预测相关信号通路
GSEA预测结果显示,与KCNG1协同高表达基因主要富集在与肿瘤增殖和凋亡以及免疫反应等相关的通路,包括KRAS、mTORC1、MYC、P53和WNT信号通路(图6)。因此,KCNG1可能在肿瘤增殖、血管生成、凋亡及免疫反应等过程中发挥调控作用,从而促进肺癌的发生发展。
2.8 KCNG1 mRNA和蛋白在肺癌细胞中高表达
qRT-PCR结果提示,肺癌A549及H1299细胞系中KCNG1mRNA相对表达水平明显高于正常肺泡上皮细胞(P<0.01或<0.001);蛋白免疫印迹结果显示,肺癌A549及H1299细胞系中KCNG1蛋白表达水平明显高于正常肺泡上皮细胞(P<0.01)。见图7。由此表明,KCNG1mRNA和蛋白在肺癌细胞中表达上调。

**:P<0.01,***:P<0.001,与肺泡上皮细胞比较;A:qRT-PCR实验检测KCNG1 mRNA相对表达量;B:蛋白免疫印迹实验检测KCNG1蛋白相对表达量
2.9 KCNG1敲低抑制肺癌细胞的增殖能力
蛋白免疫印迹结果显示,与对照组相比,KCNG1敲低组1以及KCNG1敲低组2肺癌A549细胞中KCNG1蛋白表达水平明显降低(P<0.01或<0.001),充分验证了siRNA转染效率。EdU染色结果显示,与对照组相比,肺癌A549及H1299细胞系KCNG1敲低组1和KCNG1敲低组2 EdU阳性核比率明显降低(A549细胞:t=6.554,5.468,P均<0.01;H1299细胞:t=7.057,4.585,P<0.01或<0.05),见图8。由此提示,siRNA干扰KCNG1表达后,肺癌细胞增殖能力下降。

*:P<0.05,**:P<0.01,***:P<0.001,与对照组相比;A:蛋白免疫印迹检测KCNG1蛋白相对表达水平;B:EdU实验检测A549细胞增殖能力(×100);C:EdU实验检测H1299细胞增殖能力(×100)
2.10 KCNG1敲低抑制肺癌细胞的迁移能力
如图9所示,与对照组相比,肺癌A549及H1299细胞系KCNG1敲低组1和KCNG1敲低组2细胞划痕愈合能力明显下降(A549细胞:t=5.397,3.697,P<0.01或<0.05;H1299细胞:t=8.434,5.936,P均<0.01)。Transwell实验结果显示,与对照组相比,肺癌A549及H1299细胞系KCNG1敲低组1和KCNG1敲低组2迁移细胞数明显减少(A549细胞:t=7.387,4.364,P<0.01或<0.05;H1299细胞:t=9.849,7.603,P<0.01或<0.001)。由此提示,下调KCNG1表达水平可抑制肺癌细胞的迁移能力。
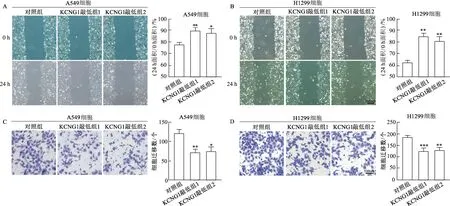
*:P<0.05,**:P<0.01,***:P<0.001,与对照组相比;A:划痕愈合实验检测A549细胞迁移能力(×40);B:划痕愈合实验检测H1299细胞迁移能力(×40);C:Transwell实验检测A549细胞迁移能力(×100);D:Transwell实验检测H1299细胞迁移能力(×100)
2.11 KCNG1敲低抑制肺癌细胞的侵袭能力
Matrigel Transwell结果显示,与对照组相比,肺癌A549及H1299细胞系KCNG1敲低组1和KCNG1敲低组2侵袭细胞数目均明显减少(A549细胞:t=2.903,3.778,P均<0.05;H1299细胞:t=5.126,4.982,P均<0.01)。见图10。由此表明,KCNG1表达水平下调抑制肺癌细胞的侵袭能力。
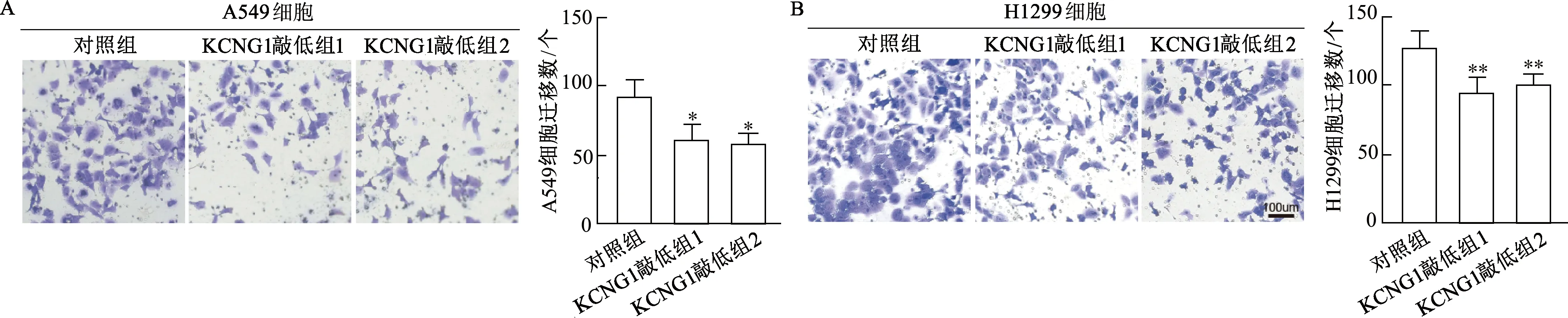
P<0.05,**:P<0.01,与对照组相比;A:Matrigel Transwell实验检测A549细胞侵袭能力;B:Matrigel Transwell实验检测H1299细胞侵袭能力
2.12 KCNG1敲低抑制肺癌细胞的拟态成管能力
如图11所示,与对照组相比,KCNG1敲低组1和KCNG1敲低组2肺癌A549细胞成管数量明显减少(t=2.982,3.693,P均<0.05)。由此表明,KCNG1敲低可抑制肺癌细胞的拟态成管能力。

*:P<0.05,与对照组相比
3 讨论
目前肺癌仍是全世界癌症相关死亡的主要原因[20],由于分子靶向治疗的进展,目前肺癌治疗效果有所提高[21]。生物信息学分析为基因在肿瘤学研究过程中提供了具体的方向[22],本文通过生物信息学获取并分析了1 145例肺癌及癌旁组织的高通量测序数据,结果发现KCNG1mRNA在肺癌组织中表达水平显著增高,且KCNG1mRNA高表达与肺癌患者的N和M分期等临床病理特征密切相关。在此基础上通过回归分析进一步证实KCNG1可作为预测肺癌患者预后的独立因素。初步证实KCNG1在肺癌发生发展中具有潜在的生物学功能。
有研究证实,多种钾通道蛋白的异常表达参与肺癌的发生发展,Song等[23]发现kv3.1和kv3.4的异常高表达参与调控细胞的侵袭和转移。Liu等[24]发现敲低KCNJ2表达后可通过miR-7和Ras/MAPK信号通路减弱非小细胞肺癌的耐药性。本研究通过体外转染siRNA肺癌A549细胞以及H1299细胞,干扰KCNG1表达水平后,显著抑制其增殖、迁移、侵袭能力。基于已有研究,本研究未在H1299细胞中检测成管能力,只在肺癌A549细胞中转染siRNA,其成管能力明显下降。由此表明,KCNG1在肺癌的恶性进展中发挥重要作用。多种促癌分子信号的异常表达和活化是肺癌发生、浸润、转移和耐药的主要原因[25],其中包括Wnt,mTOR,MAPK以及P53等信号通路[26-29]。本研究基于TCGA数据库,通过富集分析发现KCNG1相关的差异表达基因可能参与调控KRAS通路、MTORC1通路、MYC通路和WNT通路等。其中,KRAS位点突变是肿瘤发生发展的最重要的驱动因素之一,有1/3肺癌患者存在KRAS位点突变[30-32]。既往研究报道,KRAS主要通过参与调控MAPK,RAF和MEK等下游信号分子促进肺癌的进展[33-35]。因此,KCNG1高表达可能通过促进KRAS等相关促癌信号通路的活化,进而促进肺癌的恶性进展。然而,KCNG1在肺癌中高表达的主要分子机制以及其高表达与下游促癌信号活化之间的联系有待进一步探究。
综上所述,KCNG1在肺癌中显著高表达并与患者不良预后密切相关,干扰其表达水平可抑制肺癌细胞的恶性生长,初步提示KCNG1异常高表达参与肺癌的进展,这可能与KCNG1调控多种促癌信号通路的活化密切相关。本研究目前只通过生物信息学分析及体外细胞学实验探讨了KCNG1对肺癌进展的作用机制,也仅在A549细胞中检测了成管能力的变化,未能在更多的肺癌细胞中检测增殖、迁移、成管等行为学的变化,还缺乏动物体内实验的验证,后续有待进一步完善。