基于RNA测序的成纤维样滑膜细胞中类风湿关节炎相关性核心基因分析▲
2023-11-24张明媚张艳艳刘剑桥刘晓闯
张明媚 张艳艳 刘剑桥 刘 睿 黄 荣 程 瑶 刘晓闯
(1 安徽中医药大学第一附属医院药学部,安徽省合肥市 230031;2 安徽中医药大学药学院,安徽省合肥市 230012)
类风湿关节炎(rheumatoid arthritis,RA)为较为常见的慢性自身免疫性疾病,滑膜过度增生、血管翳形成为其主要病理特征,可引起骨骼与软骨损伤,最终造成关节功能障碍[1]。目前RA的发病机制尚未完全明确,可能与遗传、感染及免疫功能紊乱等因素密切相关[2]。研究表明,成纤维样滑膜细胞(fibroblast-like synoviocytes,FLSs)是促进 RA 发生、发展的一个重要因素,其可在滑膜组织和骨组织中大量增殖、侵袭,并分泌炎症因子,加重关节软骨的损伤[3]。因此,进一步探索FLSs中与RA相关的关键靶点,有助于阐明RA的发病机制,为RA的诊断和治疗提供新思路。
转录组学是指从转录水平上对某一特定时段内的细胞或组织进行研究,从整体水平上反映基因转录和转录调控规律的学科,能反映同一基因在既定条件或疾病状态下的表达差异[4]。RNA测序技术即转录组测序技术,目前其已成为研究基因结构、功能及表达的重要方法[5-6]。本研究利用RNA测序技术分析FLSs中与RA相关的差异表达基因,筛选RA的生物标志物,为明确RA发生的分子机制提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:雄性SD大鼠30只,7~8周龄,体重(250±10)g,由济南朋悦实验动物繁育有限公司提供[动物许可证号:SCXK(鲁)20190003]。将大鼠饲养于温度为22 ℃~26 ℃、光照和黑暗12 h交替循环的环境中,给予标准饮食和自来水喂养。本研究动物实验已获得安徽中医药大学动物实验伦理委员会批准(批准文号:AHUCM-Rats-2021005)。
1.1.2 实验试剂:弗氏完全佐剂购自上海麦克林生化科技股份有限公司(批号:C13083712),苏木素染液、伊红染液(醇溶)、番红固绿染色液购自安徽欣乐生物技术有限公司(批号:09232110、09122109、10212110),DMEM、D-Hank′s缓冲液购自武汉赛维尔生物科技有限公司(批号:20210407、GP2006080873),Ⅱ型胶原酶、3%牛血清白蛋白购自北京索莱宝科技有限公司(批号:130Y023、605U051),DAPI、0.2% Triton X-100溶液、Cy3标记山羊抗兔IgG(H+L)、抗荧光淬灭封片液购自上海碧云天生物技术有限公司(批号:030222220525、050222220721、021622220711、030722220713),波形蛋白抗体购自Affinity Biosciences Ltd.(批号:6619511),TRIzol试剂盒购自Life Technologies公司(批号:391305),反转录试剂盒Prime ScriptTMRT reagent Kit with gDNA Eraser购自TaKaRa公司(批号:ALG2080A),实时荧光定量PCR试剂盒购自苏州近岸蛋白质科技股份有限公司(批号:05246001),VAHTS Universal V6 RNA-seq Library Prep Kit(南京诺唯赞生物科技股份有限公司,批号:NR604)。
1.1.3 实验仪器:细胞培养箱购自Thermo Fisher Scientific公司(型号:3111),光学显微镜、正置荧光显微镜购自OLYMPUS公司(型号:CX41、CX43),生物组织包埋机购自孝感市亚光医用电子技术有限公司(型号:YB-7LF),紫外分光光度计购自Thermo Fisher Scientific公司(型号:NanoDrop 2000),生物分析仪购自Agilent Technologies公司(型号:Agilent 2100),NovaSeq 6000测序系统购自Illumina公司,PCR仪购自杭州晶格科学仪器有限公司(型号:K960)。
1.2 动物模型建立 经过1周的适应性饲养,将30只大鼠按照随机数字表法分为正常组和模型组,每组15只。于模型组大鼠右后足趾皮内注射0.1 mL弗氏完全佐剂,构建佐剂性关节炎大鼠模型(经典RA模型)。于正常组大鼠相同位置注射等量无菌生理盐水。以造模当日为第0日,于第20日处死大鼠,每组各取3只大鼠的膝关节组织用于病理组织学检测,各取9只大鼠的滑膜组织用于原代FLSs的获取,各取3只大鼠的滑膜组织用于实时荧光定量PCR实验。
1.3 病理组织学检测
1.3.1 HE染色法观察膝关节组织形态学变化:将经4%多聚甲醛固定后的膝关节组织使用脱钙液进行脱钙,依次行酒精梯度脱水、二甲苯透化、浸蜡、包埋后,常规制作切片。经二甲苯脱蜡、酒精脱水后,使用流水冲洗干净。经苏木素染液染色5 min后,使用流水冲洗干净。经1%盐酸酒精分化处理后,使用流水冲洗干净。置于1%伊红染液中染色2 min,使用流水冲洗干净。经酒精脱水、二甲苯透化,使用中性树胶封片。在光学显微镜下观察膝关节组织形态学改变。
1.3.2 番红固绿染色法观察膝关节软骨组织破坏情况:取膝关节组织石蜡切片,用二甲苯脱蜡后行酒精梯度脱水,使用流水冲洗干净。在苏木素染液中浸泡5 min,使用流水冲洗干净。经酸性分化液分化15 s后,流水冲洗干净。在固绿染色液内浸染10 min后,使用流水冲洗干净,再用弱酸溶液洗涤多余染液。用番红染色液染色10 min后,使用流水冲洗干净。经酒精脱水、二甲苯透化后,使用中性树胶封片。在光学显微镜下观察膝关节软骨组织破坏情况。
1.4 原代FLSs的获取
1.4.1 细胞的培养和传代:采用组织块培养法从滑膜组织中分离FLSs。解剖大鼠滑膜组织,去除脂肪、血管和纤维组织,用D-Hank′s缓冲液反复冲洗后切碎,然后在37 ℃培养箱内用Ⅱ型胶原酶消化2 h。用含20%胎牛血清的DMEM润湿培养瓶瓶底后,将小块滑膜组织均匀铺于培养瓶底部,将培养瓶瓶底朝上并置于37 ℃培养箱内培养2 h,使组织块贴壁。然后在培养瓶中加入1~2 mL含20%胎牛血清的DMEM培养基,使组织块浸没于培养基中,将培养瓶瓶底朝下并置于培养箱中继续培养。细胞贴壁24 h后更换培养液,此后每2 d换液1次,直至细胞爬出铺满瓶底。待爬出细胞较多后进行传代培养,选择第3代细胞进行后续实验,并通过倒置显微镜观察FLSs形态,FLSs典型形态为纺锤形或长梭形[7]。
1.4.2 细胞的免疫荧光鉴定:取第3代FLSs,以4%多聚甲醛固定30 min,使用PBS洗涤5 min后,在0.2% Triton X-100溶液中孵育30 min,再使用PBS洗涤5 min。然后用3%牛血清白蛋白室温封闭20 min。加入一抗波形蛋白抗体(稀释比为1∶200),于4 ℃孵育过夜。次日使用PBS洗涤3次,5 min/次,用二抗Cy3标记山羊抗兔IgG(H+L)(稀释比为1∶500)室温孵育30 min,弃二抗,滴加DAPI进行染核,用抗荧光淬灭封片剂封片。在荧光显微镜下观察,红色荧光代表波形蛋白染色阳性,提示染色阳性的细胞为FLSs。
1.5 RNA测序
1.5.1 RNA提取和测序文库建立:采用TRIzol试剂提取正常组和模型组FLSs的总RNA。使用紫外分光光度计测定RNA的纯度及浓度,采用生物分析仪评估RNA完整性。按照VAHTS Universal V6 RNA-seq Library Prep Kit的说明书制备测序文库。
1.5.2 测序和数据处理:使用NovaSeq 6000测序系统对测序文库进行测序,获取测序数据。采用fastp软件对测序数据进行预处理[8],对原始读段进行过滤后获得洁净读段。使用HISAT2软件将洁净读段与大鼠参考基因组进行比对[9],获得正常组和模型组FLSs的基因表达情况,用于后续数据分析。
1.6 差异表达基因的筛选及富集分析
1.6.1 差异表达基因的筛选:利用R软件(3.2.0版本)的DESeq2包对正常组和模型组FLSs的基因表达数据进行分析[10],得到P值与差异倍数(fold change,FC)。以P<0.05和|log2FC|>0.585的基因作为差异表达基因[11]。
1.6.2 差异表达基因的功能和通路富集分析:在oebiotech云平台(https://cloud.oebiotech.com/)采用超几何分布算法对差异表达基因进行基因本体论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析,其中GO功能富集分析包括生物过程、细胞组分及分子功能。以P<0.05且错误检出率(false discovery rate,FDR)<0.05认为具有统计学意义。
1.6.3 差异表达基因的基因集富集分析:本研究使用GSEA_MSigDB数据库(https://www.gsea-msigdb.org)的基因集“c5:geneontology(GO)genesets(c5.all.v7.4.symbols.gmt)”作为预定义基因集[12],通过GSEA软件(4.0.2版本)进行基因集富集分析(Gene Set Enrichment Analysis,GSEA)检测差异表达基因富集的基因集的GO功能富集情况。以|NES|>1(NES为规范化富集分数)、P<0.05及FDR<0.25认为具有统计学意义。
1.7 核心基因的筛选 将差异表达基因导入 STRING数据库(https://string-db.org/),设定最低交互分数为0.4,建立蛋白-蛋白相互作用(protein-protein interaction,PPI)网络。然后利用 Cytoscape软件进行可视化处理,并使用 cytoHubba 插件计算节点的连接度,选择连接度排名前 10 的基因为核心基因。
1.8 差异表达基因的实时荧光定量PCR验证 采用TRIzol试剂提取正常组及模型组滑膜组织中的总RNA样本,根据反转录试剂盒说明书将RNA反转录为cDNA,然后进行实时荧光定量PCR反应。反应体系总体积为10 μL,包括cDNA模版1 μL、2×SYBR Green Mixture 5 μL、正反向引物(10 μmol/L)各1 μL、RNase Free Water 2 μL。反应条件:95 ℃预变性1 min;95 ℃变性20 s,60 ℃退火/延伸1 min,共40次循环。以β-actin为内参基因,采用2-ΔΔCt法计算部分差异表达基因的mRNA相对表达量,包括基质金属蛋白酶(matrix metalloproteinase,MMP)9、Src家族酪氨酸激酶(Src family tyrosine kinase,FGR)、载脂蛋白B(apolipoprotein B,APOB)。设置3个复孔,实验重复3次。引物序列见表1。

表2 两组大鼠滑膜组织MMP9、FGR、APOB的mRNA相对表达量比较(x±s)
1.9 统计学分析 采用GraphPad Prism 7.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用两独立样本t检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组大鼠膝关节组织形态学变化 HE染色结果显示,正常组大鼠膝关节滑膜组织结构完整且无破坏,细胞排列均匀整齐,未见FLSs过度增殖和血管翳形成的现象;模型组大鼠膝关节滑膜组织呈栅栏样,FLSs明显增殖,可见血管翳形成,见图1。

图1 两组大鼠膝关节组织HE染色结果(×100)
2.2 两组大鼠膝关节软骨组织破坏情况 正常组大鼠膝关节软骨组织表面平滑完整,软骨基质及软骨细胞均匀红染,且软骨细胞数量较多,潮线较整齐;模型组大鼠膝关节软骨组织表面缺损严重,软骨基质及软骨细胞红染明显减少,软骨细胞数量减少,潮线不完整且模糊,见图2。综合HE染色结果和番红固绿染色结果可知,观察组大鼠膝关节组织发生病理性改变,且膝关节软骨组织破坏严重,表明造模成功,可用于后续实验。

图2 大鼠膝关节组织番红固绿染色结果(×100)
2.3 FLSs分离培养及鉴定结果 传代培养至第3代,FLSs增殖迅速,呈长梭状。正常组FLSs与模型组FLSs形态大致相同,但模型组FLSs增殖速度明显快于正常组,见图3。免疫荧光检测结果显示大部分细胞呈红色荧光,波形蛋白染色阳性,证明分离的细胞为FLSs,可以用于后续实验,见图4。

图3 FLSs的传代培养情况(×200)
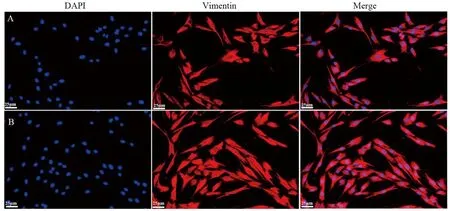
图4 两组FLSs的免疫荧光鉴定结果(×400)
2.4 差异表达基因的筛选结果 共筛选出227个差异表达基因,包括133个上调基因和94个下调基因,见图5。

图5 差异表达基因的火山图
2.5 差异表达基因的富集分析 (1)GO功能富集分析结果显示,差异表达基因主要富集在平滑肌细胞增殖负向调控、巨噬细胞源性泡沫分化的正向调控、缺氧反应等生物过程,以及脂肪颗粒、线粒体内膜和抑制性突触等细胞组分,主要涉及钙离子结合、蛋白质酪氨酸激酶活性及激素受体结合等分子功能,见图6。(2)KEGG通路富集分析显示,差异表达基因共富集在19条信号通路中,主要包括脂肪细胞中脂肪分解的调节、中性粒细胞胞外陷阱形成、血管平滑肌收缩等信号通路,见图7。(3)GSEA结果显示,差异表达基因富集的基因集主要涉及防卫反应、G蛋白偶联受体信号通路、活动分子传感器,见图8。
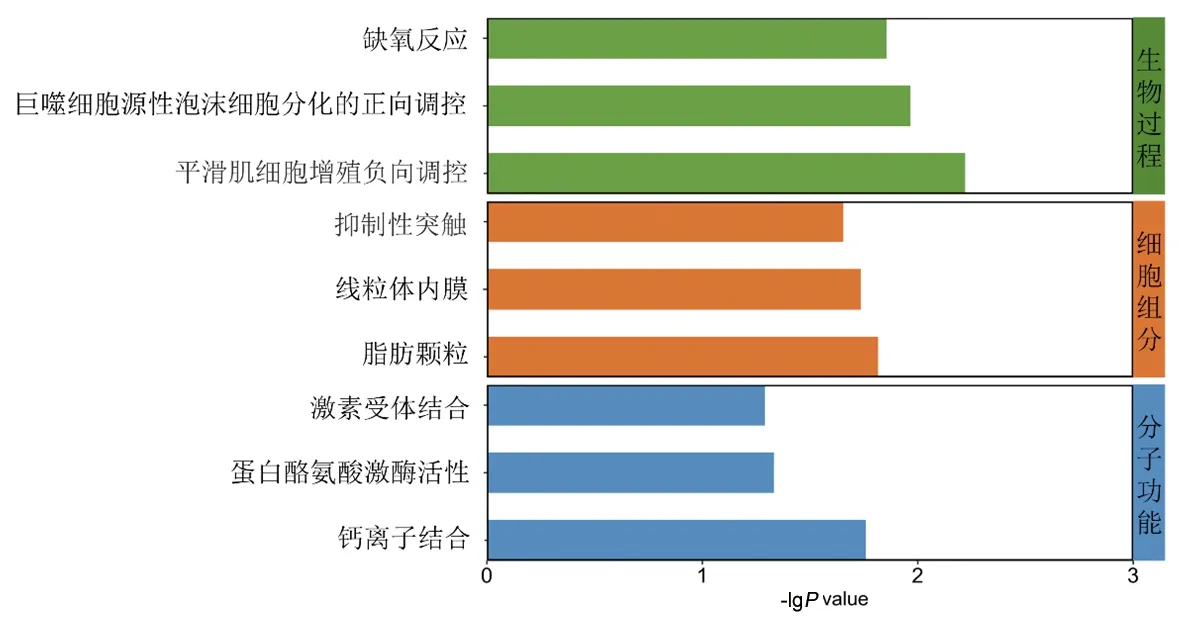
图6 差异表达基因的GO功能富集分析柱状图

图7 差异表达基因的KEGG通路富集分析气泡图
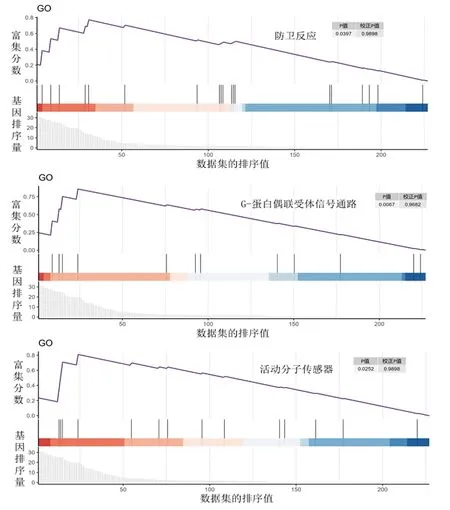
图8 差异表达基因的GSEA结果
2.6 核心基因的筛选结果 将差异表达基因导入STRING数据库构建PPI网络,该网络共有196个节点和969条边,见图9。将该PPI网络数据导入Cytoscape软件,去除游离基因后获得包含62个基因的可视化PPI网络图,见图10。使用 cytoHubba 插件计算节点的连接度,按连接度由大到小排序,排名前10的差异表达基因为MMP9、血管紧张素原(angiotensinogen,AGT)、组蛋白乙酰赖氨酸阅读器(histone acetyl-lysine reader,CECR2)、FGR、组蛋白簇1 H3家族成员C(histone cluster 1 H3 family member C,Hist1h3c)、APOB、钙黏着蛋白3(cadherin 3,CDH3)、MMP15、组蛋白簇2 H4(histone cluster 2 H4,Hist2h4)、B型利钠肽(natriuretic peptide B,NPPB),即为核心基因,见图11。
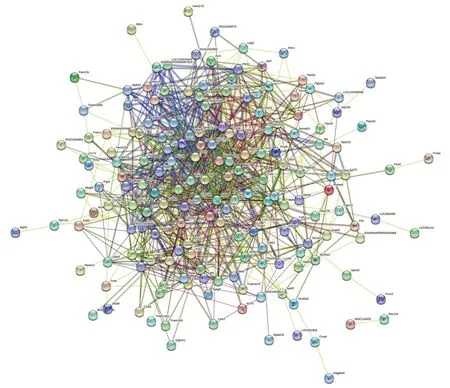
图9 差异表达基因的PPI网络图

图10 除游离基因后的可视化PPI网络图

图11 PPI网络中的核心基因
2.7 差异表达基因的实时荧光定量PCR验证结果 模型组大鼠滑膜组织中MMP9、FGR、APOB的mRNA表达量高于正常组(P<0.05),与RNA测序结果一致。
3 讨 论
RA是一种慢性炎症性关节疾病,可对患者身心造成不良影响,深入研究其分子机制具有重要意义。本研究利用RNA测序技术在FLSs中筛选出与RA相关的差异表达基因共227个,包括133个上调基因和94个下调基因,并对这些差异表达基因进行GO功能富集分析,结果显示其主要富集于平滑肌细胞增殖负向调控、巨噬细胞源性泡沫分化的正向调控、缺氧反应等生物过程,这可能与RA患者关节腔内FLSs大量增殖,释放大量炎症因子,造成关节腔缺氧有关[13-14]。在分子功能方面,差异表达基因主要涉及钙离子结合、蛋白质酪氨酸激酶活性及激素受体结合等,这可能与RA患者骨质破坏所致骨代谢失衡,或FLSs细胞转化及信号传导有关[15-16]。而差异表达基因主要涉及脂肪颗粒、线粒体内膜和抑制性突触等细胞组分,这可能与RA患者机体代谢失调,或炎症因子的释放有关[17-18]。此外,KEGG通路富集分析结果显示,差异表达基因主要富集在脂肪细胞中脂肪分解的调节、中性粒细胞胞外陷阱形成、血管平滑肌收缩等信号通路中。有学者发现,FLSs的脂肪分解与RA滑膜增生和炎症相关,说明调节FLSs的脂肪分解对RA具有潜在的治疗作用[19]。中性粒细胞胞外陷阱形成信号通路是调控炎症的关键信号通路,其可释放一系列炎症介质以驱动RA的进展[20]。有研究表明,在RA患者中,炎症可影响血管平滑肌的收缩,且RA与心血管疾病的发展密切相关[21]。本研究的GSEA结果表明,差异表达基因富集的基因集主要涉及防卫反应、G蛋白偶联受体信号通路、活动分子传感器。有学者发现,炎症小体可激活对宿主防卫反应至关重要的炎症相关信号通路,进而导致自身炎症和自身免疫性疾病[22]。鞘氨醇1-磷酸(sphingosine-1-phosphate,S1P)是一种生物活性脂质分子,与G蛋白偶联鞘氨醇1-磷酸受体(sphingosine-1-phosphate receptor,S1PR)结合后可以介导炎症反应,而靶向干预S1P-S1PR轴可以减轻RA患者的病理性炎症[23]。由此可见,差异表达基因从不同途径调控炎症反应,从而参与RA的发生、发展。
本研究共筛选出10个核心基因,分别为MMP9、AGT、CECR2、FGR、Hist1h3c、APOB、CDH3、MMP15、Hist2h4、NPPB。MMP9是一种明胶酶,在细胞的增殖及迁移、免疫炎症等生理和病理过程中起着重要的作用。透明质酸是关节滑液的主要成分,在关节中起着重要的润滑作用。有学者发现,RA患者与滑液中的透明质酸浓度降低,MMP9活性增加,说明滑液中透明质酸浓度的降低可能与MMP9活性的升高有关[24]。研究显示,在RA中,MMP9参与FLSs的增殖,并促进FLSs的介导炎症反应和软骨降解[25]。以上研究表明MMP9基因表达上调与机体的炎症反应过程密切相关,MMP9基因可能是治疗RA的重要靶点。FGR是一种酪氨酸激酶,参与调控多种生物学过程,如细胞增殖、细胞迁移、抗凋亡等。近年有研究表明,FGR可能与炎症性免疫性疾病的发展密切相关[26]。还有研究显示,在造血系统中缺乏Src家族激酶(FGR、HCK和LYN)的小鼠完全免受炎症作用的影响,说明Src家族激酶可以诱发体内炎症反应[27]。因此FGR可能为RA的治疗靶点之一,这或可为开发RA的新治疗策略提供了新思路。APOB是由一种由肝脏合成的载脂蛋白,能够将乳糜颗粒、低密度脂蛋白、极低密度脂蛋白运载转移到血管中。APOB基因或其调控区域发生突变,可导致低β脂蛋白血症和高胆固醇血症等疾病[28]。研究表明,APOB通过与表达于免疫细胞表面的烯醇酶1相互作用来增强炎症反应,从而加重关节炎[29]。因此,靶向干预APOB及其与烯醇酶1的相互作用或许可以作为治疗RA等炎症性疾病的新策略。尽管目前极少或尚未有研究表明AGT、CECR2、CDH3、Hist1h3c、Hist2h4、MMP15和NPPB这7个核心基因与RA相关,但其可能是RA发病机制研究的新靶点,今后尚需进一步行动物实验研究和临床研究加以证实。
综上所述,MMP9、FGR、APOB等核心基因可能通过参与调控免疫炎症反应来参与RA的发生和发展,这些靶点或许可为RA的临床治疗提供新思路。
