高强度聚焦超声治疗子宫肌瘤中水囊耦合的影响评估*
2023-11-23陈燕华王永领周小伟
陈燕华 冯 炼 周 芳 王永领 周小伟
(1 超声医学工程国家重点实验室 重庆医科大学生物医学工程学院 重庆 400016)
(2 超声医疗国家工程研究中心 重庆 401121)
0 引言
子宫肌瘤(又称平滑肌瘤或肌瘤)是最常见的子宫良性肿瘤[1-2]。高强度聚焦超声(High intensity focused ultrasound,HIFU)已经被证明对治疗子宫肌瘤十分有效[3],且2020年被纳入子宫肌瘤治疗的临床指南。作为一种无创的热消融技术,HIFU通过将能量聚焦在局部位置[4],在不损伤周围正常组织的情况下使肌瘤组织发生热凝固性坏死。为了精准高效地对子宫肌瘤进行消融,HIFU 治疗模块一般需要与超声影像引导模块相结合[5],组成具有引导功能的治疗平台(如图1 所示)。在治疗子宫肌瘤的过程中,病人处于俯卧状态,超声治疗头从下往上发射能量进行治疗,临床医生会依据肿瘤的位置、大小、声通道的环境来制定最佳的热消融治疗方案。除了脱气水作为HIFU 治疗的耦合剂外[6],水囊也作为一种额外的辅助器件在子宫肌瘤的治疗过程中发挥着重要作用(图1)。具体而言,医生可以通过升降超声影像探头,挤压水囊以推开声通道中的障碍(如膀胱或直肠等),并能够减小病灶离皮肤表面的距离(当病灶较深时,此举可以降低治疗难度),以此来寻找最佳的治疗窗口。但是,水囊的引入在某种程度上也使得声通道变得复杂,会影响治疗效率和监控影像质量,特别是当水囊的材料选择不当时。

图1 HIFU 治疗系统与超声影像引导相结合的系统平台Fig.1 HIFU treatment system combined with ultrasound image guidance system platform
超声波由超声换能器发出再到达靶组织的过程会出现超声吸收、超声散射和超声折射等物理现象[7],从而影响声能量焦点在靶组织上的聚焦性。在HIFU 治疗子宫肌瘤中,超声波的耦合机制要为超声换能器和组织之间的能量传输过程提供最佳的声阻抗匹配。因此有效的耦合剂必须具有与人体组织相近的声学系数[8](如声阻抗、声速,并具有较低的衰减系数),以保证能量的穿透率并降低声波传播的偏移。一般情况下,脱气水是一种临床较为接受的耦合方式。加入水囊后,如果水囊不满足以上声学属性要求,将会造成耦合问题。从治疗层面来说,这不仅会造成超声能量的损失,还会破坏声波传播过程中的声通道环境使得声波无法聚焦;从监控影像层面来说,由水囊造成的复杂声通道也会使成像质量恶化。
理论表明,一列平面波垂直入射中间层介质时,若中间层介质的厚度远小于超声波波长,中间层介质不影响超声波的传播,超声波能完全透射过去[9]。但本文在实验中发现,当声波处于1~3 MHz 范围时,即使水囊的厚度只有50 μm,也会对超声波的传播造成不容忽视的影响。为了评估这种影响,本文基于k-Wave 声学仿真软件,一方面建立超声在生物介质中的非线性传播模型,在有无水囊条件下对比焦域处的温度变化,以此分析水囊对治疗效率的影响;另一方面建立超声成像过程的仿真模型,通过分析超声图像的质量来评估水囊对监控影像质量的影响。
1 材料与方法
1.1 声波透过3层介质理论模型
水囊(原材料为热塑性聚氨酯弹性体又称热塑性聚氨酯橡胶,简称TPU)的材质是透明的TPU 薄膜,其厚度为50 μm。在治疗过程中,水囊装着适量的脱气水作为一种中间层介质放置在换能器和皮肤组织之间。如图2 所示,在一种介质中插入一中间层介质时,声波垂直入射中间层介质的声强透射系数[9]为
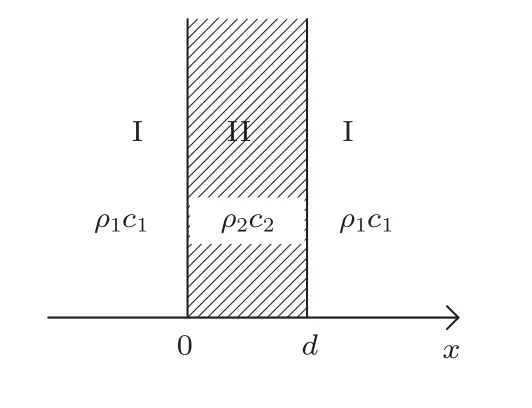
图2 声波透过中间层及坐标系Fig.2 Sound waves pass through the mesosphere and the coordinate system
式(1)中,R1=ρ1c1,R2=ρ2c2,k2=ω/c2;当k2d ≪1时,有ti ≈1,即当中间层介质的厚度远小于其超声波波长时,声波几乎能全部透射,该中间层对声波的传播没有影响。
然而,该理论模型是建立在理想条件下,在实际场合下,这模型的适用范畴有待验证。本研究在海扶刀®聚焦超声肿瘤治疗系统(JC200 型,重庆海扶医疗科技股份有限公司,以下简称“海扶刀®设备(JC200型)”)上,使用Vantage系统采集同一超声脉冲经过有无水囊情况下的反射回波信号,对比不同机械指数(Mechanical index,MI)下两种情况在B超图像上包含水面区域(ROI)的平均幅值大小,得到的幅值见表1。其中,MI 值是按照ICE 标准测量得出,该值可以作为判断超声波机械效应(如微气泡破坏)潜在风险的相对参数,是超声诊断设备的重要参数之一[10]。

表1 ROI 处平均幅值Table 1 Average amplitude at ROI
通过统计比较多次实验得到的平均幅值可知,有水囊时,ROI 的幅值在不同MI 下均减小18.1%~37.1%,说明水囊的透声性能比脱气水差,即水囊改变了声通道的环境,增加了声波在传播过程中的能量损耗。因此,本文将对水囊造成声波传播的影响进行分析评估。
1.2 Westervelt非线性传播方程
介质为黏性流体时,超声波在介质中非线性传播的压力分布由Westervelt方程来获得[11-12]:
式(2)中,p为声压;ρ0和c0为介质的声速和密度;β=1+B/2A为流体的非线性系数,其中B/2A是非线性参数;δ=α/ω2为声扩散系数,其中α为声传播介质的吸收系数。该理论模型实施由k-Wave声学仿真软件内部实现。
1.3 Pennes生物热传导方程
为确定组织域内的温度分布,将式(2)求解得到的HIFU 治疗过程中的压力分布与Pennes 生物传热方程[13-14]耦合:
式(3)中,ρt为组织的密度;Ct、k分别为组织的比热容和导热系数;Cb为血液比热容;ωb为血液灌注率;T和Tart分别为组织和血动脉温度;Q为超声在组织域内吸收而产生的热沉积,可由式(4)计算:
由于本文主要研究水囊对治疗效率和成像质量的影响,为简化计算并未考虑血流的影响,即ωb=0,因此,式(3)可简化为
基于k-Wave 声学仿真软件,在有无水囊情况下求解式(5)得到HIFU 辐照靶组织后的温度分布,并分析两种情况下的焦域温度差异来评估水囊对治疗效率的影响。
1.4 凸阵探头超声成像及其图像质量
发散波超声成像是一种非聚焦式的超声成像方式[15],它利用全孔径发射和接收。单角度发散波发射、接收一次虽然都能得到一幅超声图像,但其成像质量较差,为了得到图像质量更好的图像,可以对不同角度的超声图像进行复合[16]。本文采用计算线阵探头发射平面波的发射和接收延时的方式来近似得到腹部凸阵探头每个阵元发射脉冲信号的延时[17],使其波阵面可以向左或向右偏转。
利用k-Wave 声学仿真软件模拟腹部凸阵探头(C5-2c)在[-10°,10°]之间偏转11 个角度发射发散波,将仿真得到的反射回波数据处理成射频(Radio frequency,RF)信号用于波束合成以得到超声图像。在有无水囊的情况下分析超声图像的分辨率,并计算其对比度(Contrast radio,CR)、噪声对比度(Contrast-to-noise,CNR)和背景信噪比(Speckle SNR,SSNR)来评估水囊对成像质量的影响。其中超声图像的分辨率越大,表明其图像质量越差;而CR、CNR 以及SSNR 值越大,说明超声图像质量越好。具体计算方式如式(6)、式(7)和式(8)[18-19]所示:
其中,μbg是背景散射体的平均强度,μcyst是暗斑内部的平均强度,σbg是背景散射体的成像强度的标准差,σcyst是暗斑内部的强度的标准差。
1.5 仿真模型及参数
如图3 所示,本文以海扶刀®设备(JC200 型)中的HIFU 换能器为模型,基于实际的临床场景,利用k-Wave 工具箱模拟HIFU 换能器发射超声波经水域、水囊后在靶组织聚焦的过程,该仿真域包含HIFU 换能器、水域、水囊以及与肝脏具有相同声学特性和物理特性(包括声速、密度、比热容和导热系数)的生物组织。当声波在介质中传输到达计算域边缘时,它们被一种特殊类型的各项异性吸收边界层吸收,称为完美匹配层(Perfectly matched layer,PML)[20-22]。PML 包围着计算域,均匀添加在计算网格的所有边,且其必须满足两个要求:(1) 该层必须是“透明”的,即声波可以任意穿过而不会引起任何声波反射回介质;(2) 该层的媒质必须有“吸收”行为,以使输出波在到达计算域边缘时显著衰减。本研究建立的二维轴对称模型中,PML设置为2D 默认情况下的模拟值,即PML_size=20(PML_size以网格点为单位定义)。

图3 HIFU 换能器辐照靶组织仿真模型Fig.3 HIFU transducer irradiation target structure simulation model
模型中x轴为超声波的传播方向,y轴为换能器开孔直径方向,网格大小为9200×9200,HIFU辐照靶组织的辐照深度为40 mm。
仿真过程中,水和肝脏组织的参数见表2、表3[23],换能器的参数见表4。

表2 水和肝脏的属性Table 2 Water and liver properties

表3 水和肝脏对应基频和谐波的声吸收系数Table 3 The acoustic absorption coeffi-cients of water and liver corresponding to fundamental and harmonic frequencies(单位:Np·m-1)

表4 HIFU 换能器的参数Table 4 Parameters of HIFU transducer
腹部凸阵探头发射发散波扫描散射体并接收回波信号的仿真模型的二维平面图,如图4 所示,该模型建立在3600×2400×40的三维网格内。模拟的强散射体的声速在1400~1600 m/s 的范围内、密度在933.3~1066.6 kg/m3之间随机波动。5 个散射点的声速均为1600 m/s,密度为1200 kg/m3。在k-Wave声学仿真软件中,因为完整的三维水囊计算模型的计算量巨大,已经超出实验室现有的计算能力,所以在模型建立时用了两个与水囊等厚度的弧形代替完整的水囊。

图4 腹部凸阵探头(C5-2c)扫描成像区域仿真模型Fig.4 Simulation model of abdominal protruding array probe (C5-2c) scanning imaging area
本文使用Ram-5000 系统(声学参数测量系统)对厚度为1 mm、2 mm 的TPU材料样品(该样品与水囊的材料一致)进行声参数测量,根据多次实验结果计算得到水囊声参数(声速、密度以及声吸收系数)见表5。

表5 水囊的声参数Table 5 Acoustic parameters of water bag
在k-Wave 仿真建模过程中,腹部凸阵探头的模型参数见表6。

表6 腹部凸阵探头参数Table 6 Abdominal convex array probe parameters
2 结果
本文基于k-Wave 声学仿真软件,在有无水囊情况下,建立HIFU 辐照靶组织及其超声引导过程的仿真模型,分别分析水囊对治疗效率和成像质量的影响。
2.1 水囊对治疗效率的影响
建立HIFU 辐照靶组织的模型,求解Westervelt非线性传播方程得到基频和各次谐波分量的声压分布,并将求解结果与Pennes传热方程耦合。计算传热方程中的热沉积Q时,除基波外还要考虑各谐波分量的影响,本文最高只考虑四次谐波分量。并以声压下降-6 dB 为标准计算焦域处的几何面积,计算结果表明有水囊和没有水囊时焦域处的几何面积分别为8.62 mm2和8.54 mm2。
当声压分别为100 kPa、130 kPa和160 kPa,辐照时间为1 s、2 s 和3 s 时,探索有无水囊两种情况下在焦域处的最高温度变化。比较分析两种场景下的温度分布,以不同声压辐照靶组织3 s 为例,得到的HIFU 辐照靶组织的温度分布结果如图5 所示。该结果可以得到HIFU 辐照靶组织之后的温度分布情况,通过分析焦域处的温度场数值可以得到在有无水囊情况下,治疗过程中的最高温度变化。

图5 声压分别为100 kPa、130 kPa 和160 kPa 辐照靶组织3 s 后的温度分度Fig.5 Temperature fractions of 3 s after irradiation with sound pressures of 100 kPa,130 kPa and 160 kPa,respectively
不同声压、不同辐照时间下辐照靶组织后的最高温度变化如图6 所示。可见在不同声压、不同辐照时间辐照靶组织的情况下,加入水囊后焦域处的最高温度均减小,且有无水囊场景下的最高温度差异随着声压的增大而增大。声压为160 kPa时,没有水囊时的最高温度比有水囊时高13.08°C。
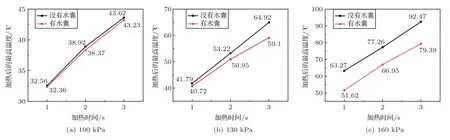
图6 不同声压、不同时间下辐照靶组织后的最高温度变化Fig.6 The maximum temperature changes of irradiated target tissues under different sound pressures and different time
2.2 水囊对监控影像质量的影响
用k-Wave 声学仿真软件建立三维腹部凸阵探头,使其在[-10°,10°]的范围内偏转11个角度发射发散波,将仿真得到的回波数据处理成RF 信号波束合成后得到超声图像,没有水囊和有水囊情况下的超声图像如图7(a)、图7(b)所示,图中的红色圆圈为暗斑的所选区域,绿色圆圈为暗斑区域对应的背景组织的计算区域。成像结果均经过动态压缩后显示,动态范围统一设为60 dB。

图7 没有水囊和有水囊情况下C5-2c 凸阵探头发散波超声成像Fig.7 Ultrasonic imaging of divergent waves of C5-2c convex array probe without water bag and with water bag
分别在有水囊和没有水囊的情况下,计算超声图像5 个强散射点的平均横向分辨率,并分析超声图像的CR、CNR和SSNR,计算值见表7。可见与没有水囊情况下相比,虽然有水囊时超声图像的横向分辨率仅升高了0.01 mm,但其CR 降低了12.67%,CNR降低了15.75%,以及SSNR降低了10.01%。因此,加入水囊后超声图像质量降低。

表7 图像质量参数Table 7 Image quality parameter
3 讨论
由声波垂直穿过中间层介质的理论模型可知,当中间层介质的厚度远小于其超声波长时,声波能够完全透射过去,不受中间层介质的影响。在超声影像引导下HIFU 治疗子宫肌瘤时,换能器和腹部凸阵探头的中心频率约为1 MHz 和3.13 MHz,而水囊50 μm 的厚度可能并不算远小于该频率下的超声波波长,因此水囊仍会对声波的传播造成影响。
预实验中,为了说明水囊在不同场景下均会对声波能量的传播造成影响,多次在有无水囊的条件下测量从水面反射回来的声波能量差异。虽然回波幅值存在10%以上差异,但它们各自在有水囊相对无水囊时回波幅值均有所降低,这正是本文在不同实验场景下为揭示水囊影响而采用的实验手段。另外,为了避免水囊外壁气泡对实验结果的影响,放置完水囊之后都会观察水囊表面是否有小气泡,若水囊表面有小气泡出现,会擦除表面气泡再进行实验,由于实验过程的水域条件是脱气水,实验过程中水囊表面很少出现小气泡。预实验结果表明,与没有水囊相比,有水囊情况下的超声能量被衰减。为了分析水囊对治疗效率和成像质量的影响,进而评估HIFU 治疗子宫肌瘤中水囊的影响,本文基于k-Wave 声学仿真软件建立了HIFU 换能器辐照靶组织和腹部凸阵探头(C5-2c)扫描成像区域的仿真模型。
HIFU 辐照靶组织的声学仿真模型将求解Westervelt 非线性传播方程得到的声场分布与Pennes 生物热传导方程相结合得到HIFU 辐照靶组织的温度场分布。该方法中的仿真模型参数很容易控制,这对定量、定性分析水囊在临床治疗子宫肌瘤场景中的影响十分有帮助。需要注意的是,在Westervelt 非线性传播方程的求解过程中,水囊的真实衰减系数过大,会导致计算结果不收敛,因此本研究中水囊的声吸收系数选为0.8,略微小于真实值。由于水囊的厚度只有50 μm,故该衰减系数的差异不会对本评估过程造成明显影响。
以上工作已经在仿真模型中证明水囊对治疗效率和监控影像质量的影响,可为实验探索水囊的影响及改善水囊等方面的研究提供参考。由于受限于当前的计算资源,本研究中对治疗效率评估的仿真模型是在二维情况下进行的,下一步工作可以采用较大运算能力的设备在三维场景下建立三维仿真模型评估水囊对治疗效率的影响;同时,也希望能够采用一种基于柱坐标的求解器对仿真模型进行求解,这样能缓解模型求解的计算压力,可能允许更加真实的三维仿真。另外,当前的仿真模型还不能完全模拟真实的治疗环境,特别是复杂的组织结构及其声学特性,但该简单模型能够初步帮助理解水囊所造成的影响,并且提供了一种高效的评估手段。
4 结论
本文针对当前临床中HIFU技术治疗子宫肌瘤场景,建立了HIFU 换能器辐照靶组织及其超声影像引导过程的数值仿真模型,定量评估手术辅助器件水囊对治疗效率和成像质量的影响。对比有无水囊情况下焦域面积大小和焦域处的最高温度变化,以及分析超声成像的图像质量。本文研究结果表明:
(1) 加入水囊后,声通道环境的改变影响了声波的传输过程,不仅导致焦域处面积变大,即声波的聚焦性变差,也降低了焦域处的最高温度。这将会增加HIFU 治疗子宫肌瘤时的治疗时间,降低治疗效率。
(2) 对比分析有无水囊场景下腹部凸阵探头发射发散波扫描成像区域复合成像的图像质量可知,加入水囊后超声图像的质量降低。
该评估体系可为进一步实验研究最佳的水囊耦合方式奠定基础。基于当前研究,作者下一步研究工作将设计离体组织和活体实验来分析评估真实情况下水囊对治疗效率和成像质量的影响。
