正常-脑瘫病证双生子印记基因筛选
——功能分析与随机验证研究
2023-11-23朱海燕张春江黄丽莉董小丽尹巧芝张天娥
朱海燕,张春江,黄丽莉,董小丽,尹巧芝,张天娥▲
(1.成都中医药大学 基础医学院,四川 成都 611137;2.成都市第一人民医院,四川 成都 610095;3.成都中医药大学 第二临床医学院,四川 成都 610042)
脑性瘫痪(cerebral palsy,CP)是指胎儿及婴幼儿期发育中脑的非进行性损伤及缺陷所造成的运动障碍及姿势异常,是目前导致小儿残疾的疾病之一[1]。其发病原因十分复杂,包括遗传学因素和非遗传学因素,但具体发病机制尚不明确。流行病学研究表明[2],大多数脑瘫起源于分娩之前,其中新生儿窒息、早产(和或低出生体重)、黄疸或和延迟(包括核黄疸)为脑瘫最常见的高风险因素,部分脑瘫患儿还存在潜在的神经系统遗传疾病或代谢障碍,与笔者团队前期对脑瘫研究结果相一致[3]。近年来,影响脑瘫的遗传性因素逐渐被重视,其中印记基因被认为与大脑及胎儿生长发育密切相关,因此印记基因的异常表达可能和脑瘫具有相关性[4]。有研究[5]显示,印记基因主要活跃在大脑和胎盘中,通过大脑和胎盘的共同作用,使许多相同的印记基因共同表达,以调控胎儿的生长发育,但这也导致对印记基因的变异和表达差异难以掌控,使得胎儿宫内发育迟缓、出生后的生长发育障碍、神经系统疾病、精神障碍等病因难以准确探查[6]。同卵双生子在遗传背景上几乎相同,常被运用于探索抑郁症[7]、阿尔茨海默病[8]、肥胖[9]等复杂疾病的发病机制研究,本研究将以正常-脑瘫双生对及发育落后患儿为研究对象,筛选出外周血中差异性印记基因并进行验证,以期进一步阐明脑瘫的发病机制,为脑瘫的早期诊断提供候选靶点,进而实现早期干预,降低致残几率。
1 资料与方法
1.1 正常-脑瘫双生对的一般资料与数据来源
来自四川的两对正常-脑瘫双生对,具有明确的病因病史诊断且患病不一致的同卵双生子(曾就诊于成都市第一人民医院儿童康复中心),唐姓双生子,女性,10岁,大双患病(重度痉挛型脑瘫),小双正常;胡姓双生子,男性,7岁,小双患病(重度痉挛型脑瘫),大双正常。提取唐、胡两对双生子mRNA,执行全基因组表达谱芯片检测,获取差异表达基因,实验由北京博奥生物芯片有限公司执行[10]。
1.2 印记基因筛选与印记基因相互作用预测
根据两对双生子芯片实验结果,将表达差异基因(Ratio大于2高表达或小于0.5的低表达基因)与印记基因数据库(https://www.geneimprint.com)进行比对,筛选印记基因。应用GeneMANIA数据库对获取的印记基因进行基因间相互作用预测。
1.3 印记基因验证样本来源
随机选取成都市第一人民医院2020年8月至2021年5月期间经临床确诊、有完整病历记录的年龄相当的8例脑瘫患儿与7例发育落后患儿,同时随机选取6例年龄相当的正常儿童作为正常对照组,并签署知情同意书。
1.4 主要仪器与试剂
可调式精密移液器(德国Eppendorf公司,型号:3123000225);低温离心机(长沙湘仪,型号:H1650);医用深低温冰箱(中国Haier公司,型号:BCD-238WK);实时荧光定量PCR仪(耶拿,型号:qTOWER3G)、PCR扩增仪(杭州博日科技有限公司,型号:TC-96/G/H/(b)B);立式压力蒸汽灭菌锅(上海申安医疗器械,型号:LDZF-75L);纯水系统(德国Millipore公司,型号:Milli-Q Century)。
QIAGEN AllPrep DNA/RNA Mini Kit试剂盒(批号:80204,德国QIAGEN公司);红细胞裂解液(批号:BL503A,美国博士德公司);磷酸盐缓冲液(PBS)(批号:AG29574691,美国HyClone公司);DEPC(批号:BL510A,安徽兰杰柯科技有限公司);反转录试剂盒(批号:R223,南京诺唯赞公司);实时荧光定量 PCR 试剂盒(批号:Q712,南京诺唯赞公司);无水乙醇(批号:2021060902,成都科龙化工试剂厂)。
1.5 RT-qPCR实验
选取芯片表达差异较大印记基因7条进行RT-qPCR检测,包括SLC22A1、COPG2、IGF2R、HSPA6、GATA3、BRP44L、FAM50B。采集纳入各组儿童外周血3 mL/人,提取总RNA,样品质量行琼脂糖凝胶电泳检测,采用Nanodrop超微量分光光度计对总RNA浓度及纯度进行检测。将RNA按照试剂盒说明书进行反转录为cDNA,使用特异性引物进行RT-qPCR,检测相应印记基因表达情况,读取CT值,运用2-ΔCT方法计算相对表达量。引物设计合成由上海生工公司完成。本实验引物序列如表1。
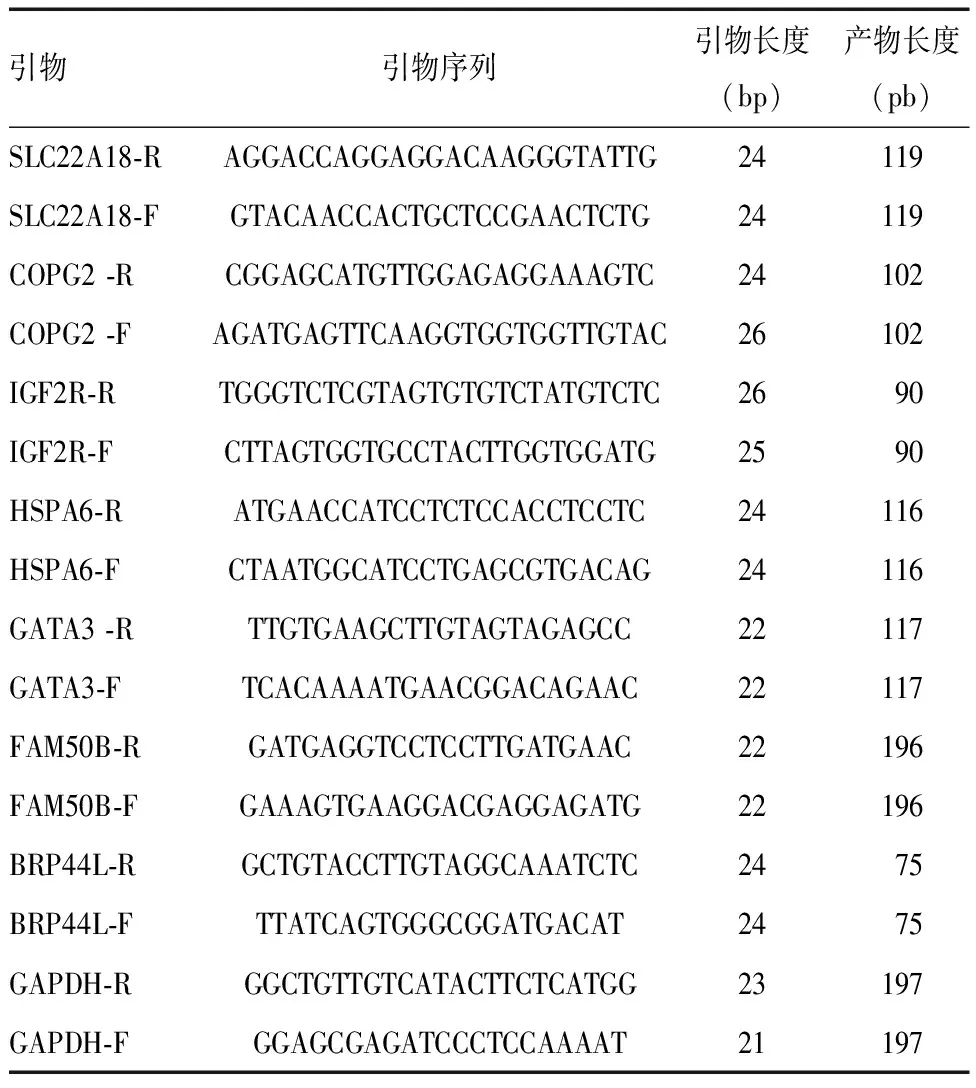
表1 引物序列
1.6 统计学方法
采用SPSS 26.0统计软件和GraphPad软件进行数据分析及绘图,统计数据若符合正态分布则使用t检验计算P值,若不符合正态分布,则运用校正t检验计算P值,P<0.05表示差异具有统计学意义。
2 结果
2.1 印记基因筛选结果
获取唐姓双生对差异印记基因12个,胡姓双生对差异印记基因3个。共15个,详见表2。
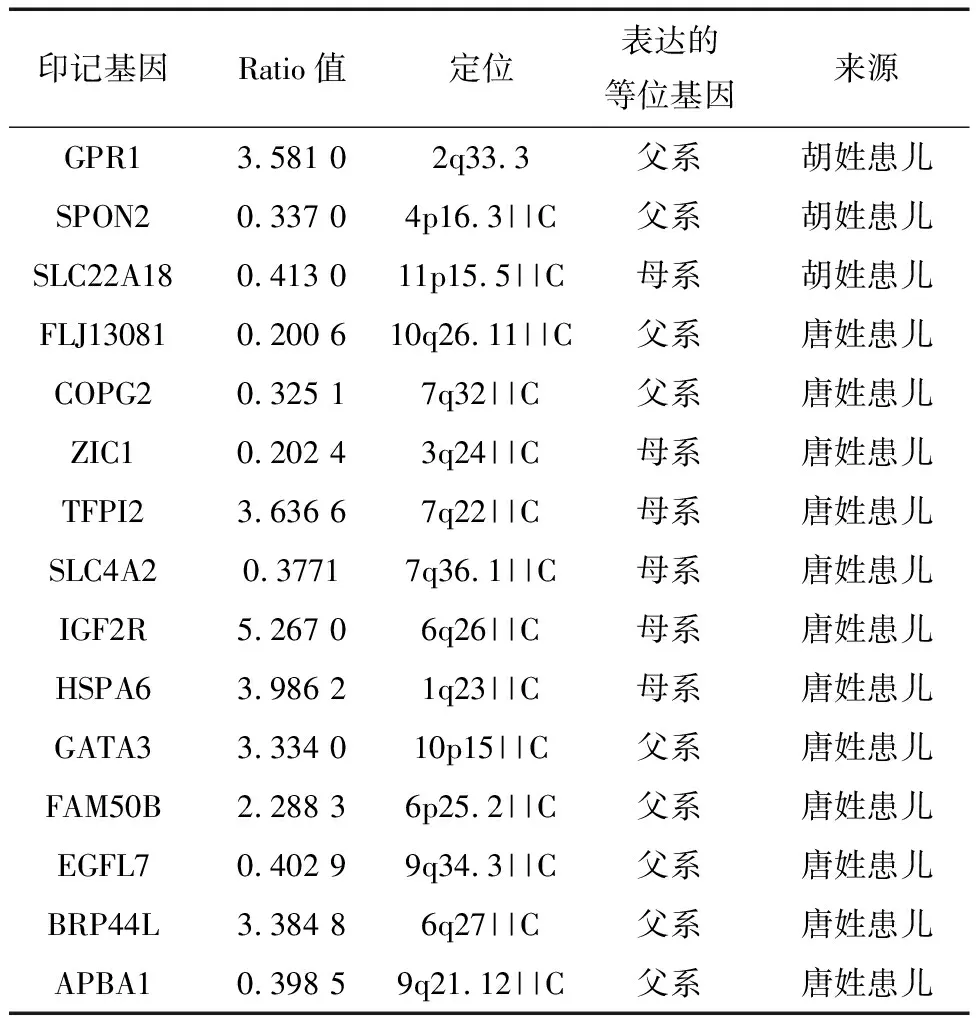
表2 获取的脑瘫相关印记基因
2.2 基因间相互作用预测结果
GeneMANIA数据库预测结果显示,FAM50B与BRP44L、锌指蛋白家族成员1(ZIC1)有直接共表达关系,ZIC1与SLC22A18有共表达关系,G蛋白偶联受体1(GPR1)与淀粉样β前体蛋白结合家族A成员1(APBA1)、溶质载体家族4成员2(SLC4A2)有相同的表达模式,SLC4A2与GATA3有共表达关系,组织因子途径抑制物2(TFPI2)与表皮生长因子结构域成分7(EGFL7)有相同的共表达关系。GATA3-FAM50B、TFPI2-细胞外基质蛋白成员2(SPON2)和FLJ13081-G蛋白偶联受体1(GPR1)三组基因之间存在直接的遗传互作。详见图1(因数据库使用的基因名不同,图中的MPC1为BRP44L,MCMBP为FLJ13081)。
2.3 琼脂糖凝胶电泳检测结果
部分样品总RNA的1.0%琼脂糖凝胶电泳结果呈现清晰且明亮的28S、18S和5S条带,28S的亮度约为18S的两倍,说明总RNA较完整,达到RNA质量要求,详见图2。
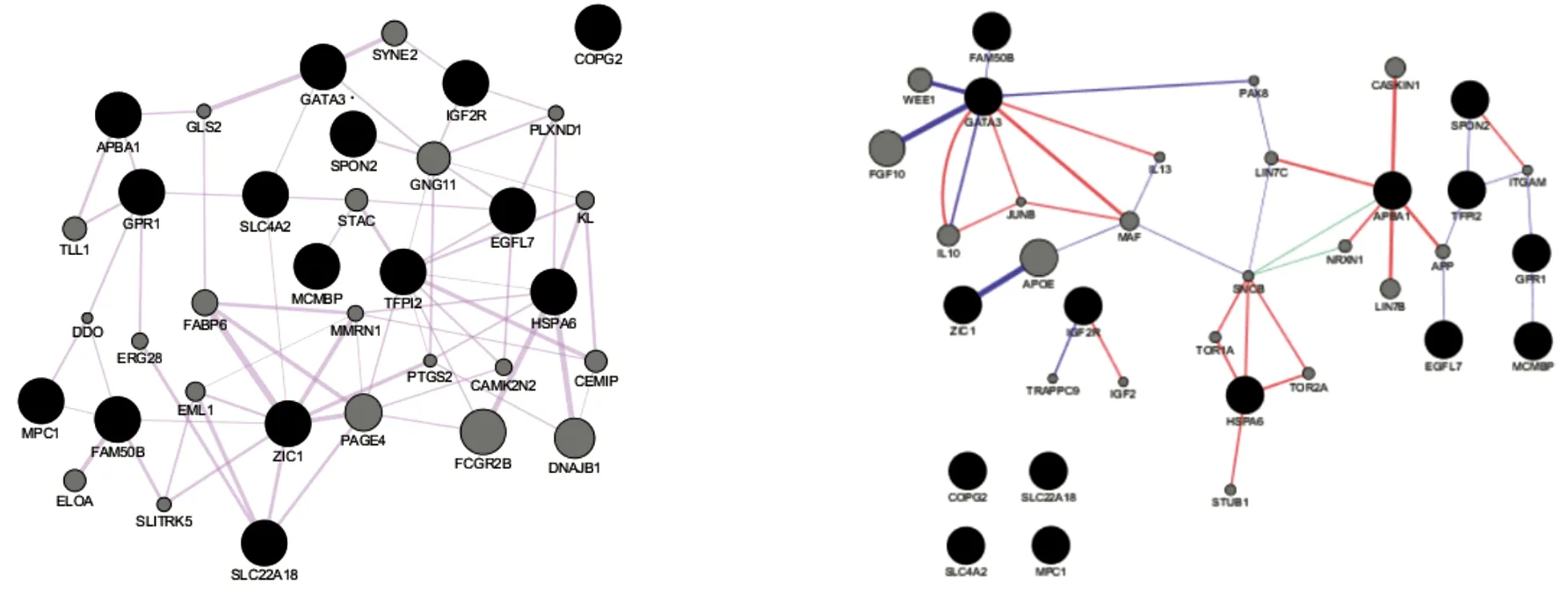
a.脑瘫相关印记基因的共表达关系 b.脑瘫相关印记基因的直接遗传互作和共定位关系
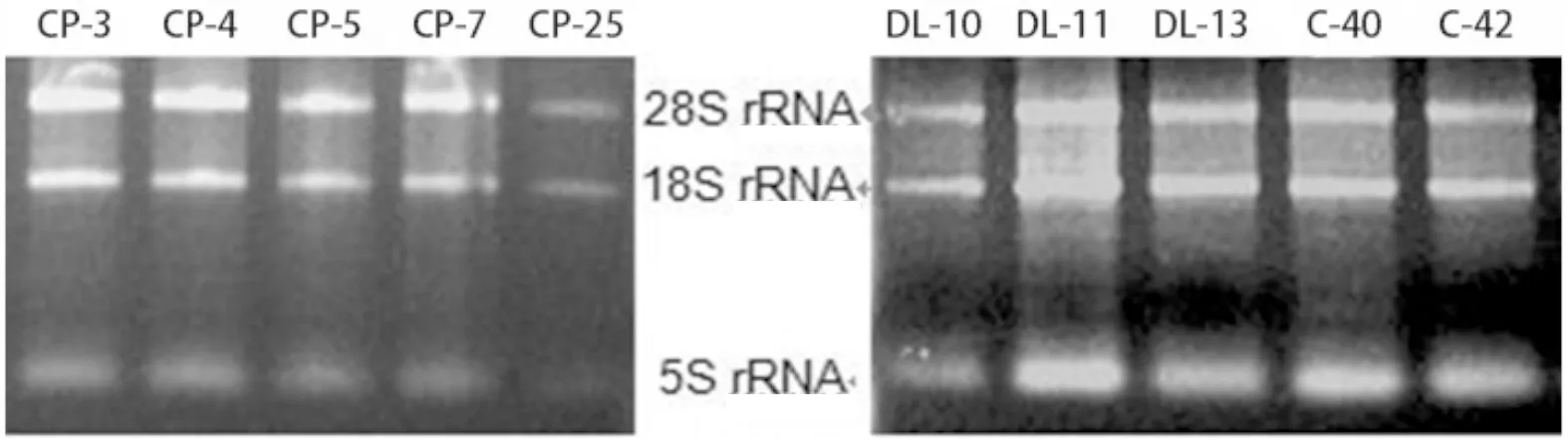
a.部分脑瘫外周血样本 b.部分发育落后、正常外周血样本
2.4 RT-qPCR验证差异印记基因表达结果
RT-qPCR结果显示,COPG2、HSPA6、BRP44L、SLC22A18基因在脑瘫组和发育落后组相对表达量皆低于正常组,其中脑瘫组COPG2相对表达量降低(P<0.01),发育落后组COPG2相对表达量降低(P>0.05),脑瘫组、发育落后组HSPA6表达量降低(P<0.01,P<0.05),脑瘫组、发育落后组SLC22A18、BRP44L相对表达量皆降低(P<0.01),脑瘫组FAM50B相对表达量降低(P<0.05)。GATA3、IGF2R基因在脑瘫组和发育落后组相对表达量皆高于正常组(P>0.05),发育落后组FAM50B亦为高表达(P>0.05)。详见图3。
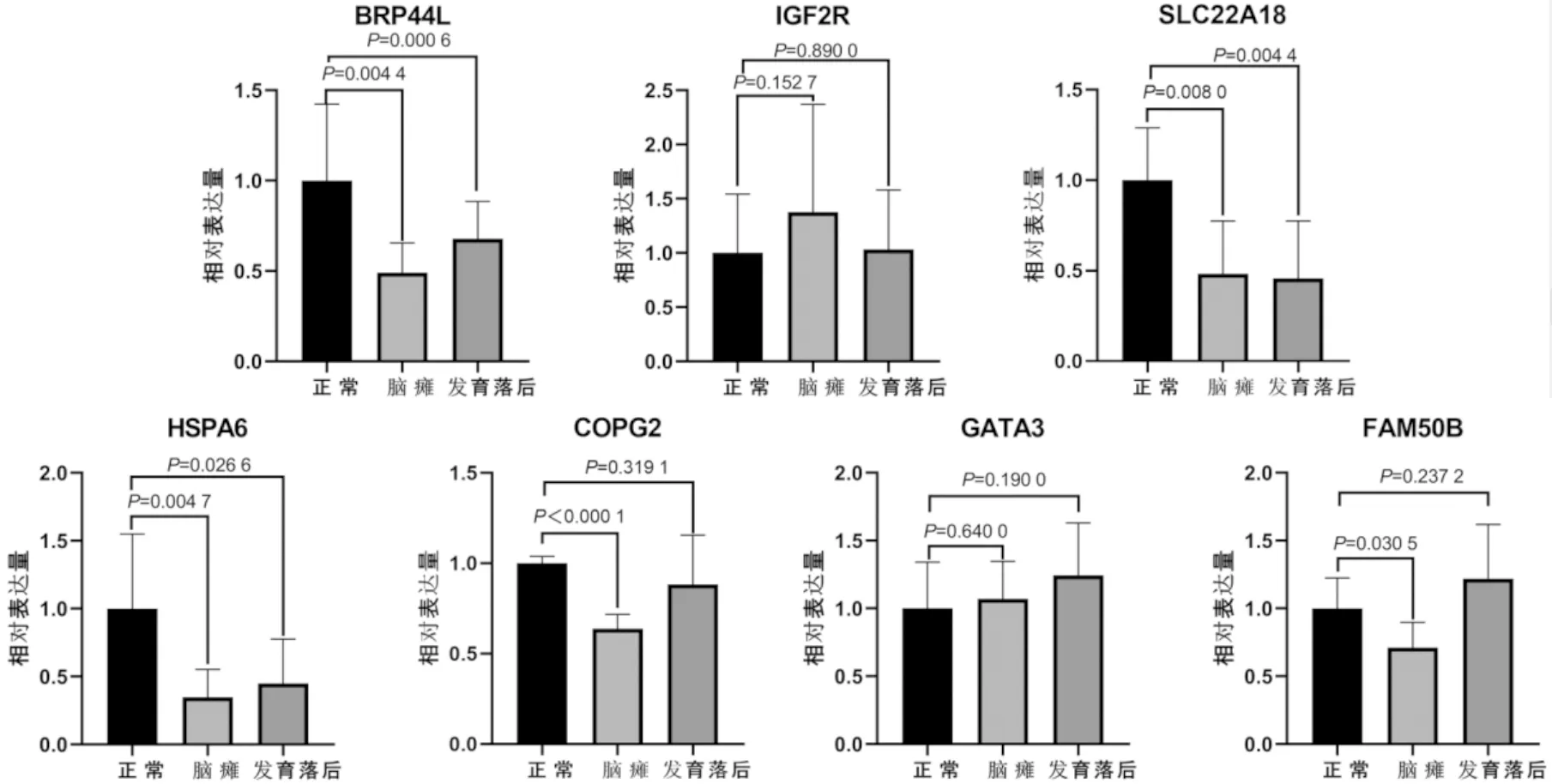
图3 正常组-脑瘫组-发育落后组RT-qPCR结果
3 讨论
通过筛选正常-脑瘫双生对印记基因,共获得芯片差异表达印记基因15个,其中APBA1被认为是大脑中一种假定的囊泡运输蛋白,有可能将突触囊泡胞吐作用和神经元细胞粘附偶联;ZIC1具有编码基因功能的一种转录因子,可编码C2H2,与神经发育密切相关[11]。因此我们认为APBA1与ZIC1的表达可能与大脑功能具有相关性。与此同时,IGF2R具有降解胰岛素生长因子2、激活转化生长因子β和运输细胞内溶酶体酶的功能;BRP44L可编码MPC1/MPC2异二聚体的一部分,且该蛋白存在于线粒体中,因此我们推断IGF2R和BRP44L的表达可能与代谢具有相关性。此外,也有文献记载[12-14],FLJ13081、SPON2、FAM50B和SLC22A18的表达也与大脑功能相关,GPR1和IGF2R的表达与出生体重相关,SLC22A18、GPR1的表达亦和代谢具有相关性。研究表明[15-17],GPR1、SPON2和SLC22A18表达异常或突变可导致胎儿宫内生长受限,从而表现出低体重、缺氧窒息以及胎儿生长发育过程中的代谢异常等问题,该结果与脑瘫患儿的临床表现相一致。在临床上,发育落后患儿症状和脑瘫患儿具有相似性,发育落后常表现出语言、运动、认知和社会交流等2个及以上的神经发育落后,而脑瘫患儿可表现出更为典型的肌张力异常、神经病理反射、发育异常及智力障碍等[18,19]。有学者认为[20],全面性发育落后患儿预后不良可能会进展为脑瘫。结合RT-qPCR结果显示,脑瘫组与发育落后组的COPG2、FAM50B和HSPA6表达有明显差异。COPG2是一种胞质复合体,参与可逆性囊泡介导的运输、细胞内蛋白质转运等。Schneider等认为[21],与黑猩猩、狒狒、恒河猴和狨猴多种灵长类动物相比,COPG2在人类大脑中显示出特有的下调,因此,COPG2表达的下调可能与“社交大脑”的进化有关,而COPG2的异常下调可能是导致自闭症的原因之一。Yamasaki等[22]发现由父系表达的COPG2的印记转录本1(COPG2IT1)位于COPG2内含子20内,该部位是行为障碍Silver-Russell综合征的候选区域。Silver-Russell综合征主要以子宫内发育迟缓、生长迟缓为表现的一组病症,与脑瘫的部分临床表现具有相似性。此外,Kolarova等[23]在智力障碍患者的外周血样中发现FAM50B基因的甲基化改变,考虑智力障碍可能与FAM50B表达异常相关。HSPA6是一种保护性蛋白,在人胎盘低氧条件下,滋养层细胞的存活需要金属蛋白酶调节脱落肝素结合EGF样生长因子(HB-EGF)和下游信号传导。Jain[24]等发现HSPA6不仅在调节基质金属肽酶2(MMP2)的生物合成中起着重要作用,而且在缺氧情况下,HSPA6是HBEGF脱落所必需的。文献研究指出[25],HSPA6对于女性成功受孕也至关重要。由此可知,脑瘫表现的生长发育迟缓及语言障碍可能与COPG2下调有关,智力障碍可能与FAM50B异常表达相关,HSPA6下调导致的缺氧窒息可能导致脑瘫。这些基因表达差异的大小可能与症状轻重有关,与脑瘫和发育落后患儿的临床表现相一致。
营养充足,正常代谢是胚胎发育的基础,胎盘缺陷是导致脑瘫的根本原因。SLC22A18是一种参与肿瘤抑制和脂质积累的印记基因[26,27],与胎儿脂质代谢密切相关。Qiao[28]等通过比较正常小儿与具有可变性过敏、身材矮小和脂肪肝三联征小儿的RT-qPCR、Sanger测序和DNA甲基化测序分析结果发现,具有可变性过敏、身材矮小和脂肪肝三联征小儿的SLC22A18mRNA表达水平较低、SLC22A18核心启动子“A”缺失且甲基化水平较高。因此认为SLC22A18下调可能与小儿身材矮小和(或)肥胖伴儿童过敏病理机制可能具有相关性。同时,SLC22A18也被认为与Silver-Russell综合征和Beckwith-Wiedemann综合征有关[29,30]。丙酮酸盐位于连接碳水化合物,氨基酸和脂肪酸代谢的中心生化节点,因此BRP44L在代谢中具有至关重要的作用。Benoit[31]等发现小鼠MPC1基因的全身敲除,可导致胚胎死亡。Zou[32]等在实验中证实,MPC1敲低的小鼠出现体重低,身体运动少,躯体温度低,运动测试中RER较低等情况。结合RT-qPCR结果可知,SLC22A18与BRP44L下调可能是发育落后患儿和脑瘫患儿低体重、发育异常的病理因素;此外,GeneMANIA数据库预测结果显示,ZIC1与SLC22A18有共表达关系,FAM50B、BRP44L和ZIC1有直接共表达关系,故脑瘫低体重、发育异常的病理机制可能和ZIC1表达亦具有相关性。与SLC22A18和BRP44L相反的是,在RT-qPCR结果中,IGF2R与GATA3在脑瘫组和发育落后组中皆有上调趋势(P>0.05)。哺乳动物早期胚胎需要通过调节转录因子、细胞因子、粘附受体及其配体来产生绒毛膜滋养外胚层前体,随后是胎盘的胎儿部分,而滋养层细胞的凋亡过程中的缺陷和分化异常与妊娠相关疾病有关。在滋养层祖细胞中,GATA因子具有直接调节BMP4,节点和Wnt信号成分,促进胚胎-胚胎外信号传导[33,34]。Lu[35]等发现GATA3在hESC中过表达可导致自发分化成滋养层谱系和非滋养层谱系,同时,GATA3下调会影响滋养外胚层的规格,从而影响胚胎的发育。Lynda[36]等实验发现IGF2与IGF2R相互作用可调节绒毛滋养层存活和凋亡,且其认为IGF2R的异常表达会使滋养层功能异常,从而导致胎儿生长受限。但由于胎盘植入和发育过程复杂且模型有限,GATA3与IGF2R对人类滋养层细胞的具体影响尚不明确。因此,脑瘫形成可能与滋养层细胞功能异常有关,但GATA3和IGF2R对脑瘫的病理影响还有待进一步实验验证。
4 结论
综上所述,脑瘫表现的生长发育迟缓、语言障碍及智力障碍可能与COPG2、FAM50B和HSPA6下调有关,这些基因表达差异的大小可能与症状轻重有关;发育落后患儿和脑瘫患儿低体重、发育异常可能与SLC22A18与BRP44L下调有关,因此,SLC22A18、BRP44L、COPG2、FAM50B和HSPA6可作为脑瘫早期诊断的候选靶点,以期为脑瘫生物学早期诊断提供依据。GATA3与IGF2R可能与滋养层细胞功能异常有关,但与脑瘫的具体影响尚不明确,还需进一步实验验证,本研究尚存在一些不足之处,仅对部分芯片表达差异明显的印记基因进行验证,未对这些印记基因功能进行进一步的验证分析,今后将进一步完善。
