联合双能量CT定量参数和形态学特征在鉴别良恶性肺实性结节的应用价值
2023-11-23林礼波何长久刘杰克李勇解超莲周鹏
林礼波,何长久,刘杰克,李勇,解超莲,周鹏
肺癌是我国及世界范围内发病率和死亡率最高的恶性肿瘤之一,严重危害人类健康[1,2]。随着肺癌筛查的推广,肺结节的检出率越来越高[3]。目前肺部影像报告和数据系统(lung imaging reporting and data system,Lung-RADS)被广泛用于肺结节的鉴别和管理[4]。然而,Lung-RADS对实性结节的良恶性鉴别有一定困难,其相对低的特异性可能会导致良性肺结节的过度治疗[5]。此外,放射科医生常通过肺结节的形态学特征评估肺结节的恶性程度,但是良恶性肺实性结节的形态学特征有所重叠,例如,非钙化性肉芽肿也常表现为分叶或其他恶性结节的征象[6]。因此,良恶性肺实性结节的鉴别诊断仍面临挑战。
双能量CT(dual-energy computed tomography,DECT)不仅可用于分析肺结节的直径和形态学特征,还可以提供碘含量(iodine concentration,IC)、标准化碘含量(normalized iodine concentration,NIC)、有效原子序数(effective atomic number,Zeff)等多种定量参数。由于不同病灶的衰减系数具有能量依赖性,使得DECT定量参数用于鉴别良恶性肺结节成为可能[7,8]。Wang等[9]发现IC在恶性肿瘤和非特异性炎症的组间差异有统计学意义。Hou等[10]的研究指出,NIC能够鉴别恶性肿瘤和非特异性炎症,其受试者操作特征(receiver operating characteristic,ROC)曲线下面积(area under curve,AUC)为0.960。此外,Zhang等[11]及Reiter等[12]发现IC能够鉴别恶性肿瘤和良性病变,其AUC分别为0.890和0.790。然而,这些研究的样本量均较小(最多者仅纳入77个)[9-12]、未区分肺结节类型[9,11]、未限定病灶大小(部分纳入肺肿块)[9,11]、仅纳入单一DECT定量特征分析[12]或仅比较良恶性肺实性结节的组间差异[9],存在一定的局限性。此外,这些研究均未评估DECT定量参数,与临床常用的Lung-RADS分级系统或传统形态学特征(如分叶、毛刺)之间诊断效能的差异。同样,这些研究均未评估DECT定量参数与形态学特征相结合,是否能进一步提高良恶性肺实性结节的鉴别诊断效能。
因此,本研究拟基于既往研究的不足,进一步探讨DECT定量参数在鉴别肺实性结节良恶性中的应用价值。此外,基于DECT定量参数与传统形态学特征,构建组合模型,并评估其与Lung-RADS、单一DECT定量参数及形态学特征之间诊断效能的差异。
材料与方法
1.一般资料
回顾性连续收集2020年5月-2021年11月在四川省肿瘤医院进行DECT扫描的患者。纳入标准如下:①患者术前1个月内进行了DECT扫描;②肺实性结节;③患者行肺叶或肺段切除术切除肺结节;④术后病理资料完整。排除标准为:①结节直径>3 cm;②近5年有癌症病史;③术前行放疗、化疗或靶向治疗等肿瘤相关治疗;④图像有严重的呼吸或运动伪影。
2.检查方法
本研究采用Siemens双源CT扫描仪(Somatom Definition Flash)对患者行肺部双期DECT增强扫描。扫描范围从肺尖到肋膈角(包括全部肺)。扫描时患者取仰卧位,双手上举,采用单次屏气扫描,呼吸时相为深吸气末。增强扫描使用高压注射器以3.0 mL/s的流率将90 mL非离子型碘对比剂(碘普罗胺,370 mg I/mL)注入肘前静脉,随后以相同的流率注入生理盐水30 mL。采用对比剂追踪技术(bolus tracking),感兴趣区(region of interest,ROI)置于肺动脉干层面升主动脉处,阈值达到100 HU后延迟5 s行动脉期扫描,动脉期完成后延迟30 s行静脉期扫描。动静脉期扫描参数和重建参数一致:管电压80/Sn 140 kV,参考管电流205/87 mAs,螺距0.55,机架旋转时间0.28 s,准直器宽度64×0.6 mm,视野350 mm×350 mm,矩阵512×512,层厚0.5 mm,层间距0.5 mm。图像重建采用SAFIRE迭代重建算法(level 4),卷积核Q30f。开启自动管电流调制技术(CARE Dose 4D)。
3.图像分析
直径和体积测量:首先在图像后处理工作站(SyngoVia VB20)上使用动脉期的数据获得虚拟平扫图像(virtual non-enhanced image,VNI)。既往研究显示,基于人工智能的联影uAI平台(united imaging intelligence,uAI)测量的肺结节平均直径和体积与人工测量值有较高的一致性[13]。因此,本研究为避免观察者之间和观察者内部的差异。将纳入患者的VNI图像以DICOM格式导入联影uAI平台,由人工智能模型在三维层面上(three-dimensional,3D)进行肺结节的自动识别及分割。采集肺结节的平均直径及体积。其中:
(1)
体积=体素的数量×单个体素的体积
(2)
随后,基于直径或体积的Lung-RADS 1.1分级系统,由两名具有6年和11年胸部影像诊断经验的初级和中级职称医师对所有肺结节进行分类,并将147个结节分为Lung-RADS 2、3、4A、4B、4X类。由于4X类需要主观评估,两位放射科医生之间若有争议,则协商讨论解决,如仍未达成一致,则由1名具有26年胸部影像诊断经验的高级职称医师判定。
传统形态学特征评估:本研究纳入的形态学特征包括形状(圆形/椭圆形或不规则)、边缘(平滑或粗糙)、分叶、毛刺、胸膜牵拉征、空泡征及血管集束征。同样,由上述两名医师在标准重建(窗位-500 HU,窗宽1500 HU)的轴位及多平面重组(multi-planar reformation,MPR)上完成所有肺结节形态学特征的评估。若有争议,则协商讨论解决,如仍未达成一致,则由高级职称医师判定。在评估图像前,所有医师均不知相应的病理组织学结果。
DECT定量参数测量:在相同图像后处理工作站上测量DECT定量参数。在横轴面肺实性结节最大层面测量结节的Zeff值、IC值和主动脉的IC值。测量时ROI尽可能大,并注意避开坏死和邻近正常组织,并计算肺实性结节的NIC。其中:
(3)
本研究共记录了6个DECT定量参数,包括动脉期Zeff(Zeff_A)、动脉期IC(IC_A)、动脉期NIC(NIC_A)、静脉期Zeff(Zeff_V)、静脉期IC(IC_V)和静脉期NIC(NIC_V)。
4.模型构建
形态学特征评价:形态学特征均为计数资料,故使用 2检验或Fisher精确检验比较组间差异。随后,将组间差异有统计学意义的特征放入单因素Logistic回归分析中,以评估各特征对良恶性肺实性结节的鉴别能力。最后,将P<0.05的形态学特征放入多因素Logistic回归分析,采用反向逐步回归法进行特征选择,以确定形态学特征中鉴别良恶性肺实性结节的独立预测因子,并计算其比值比(odds ratio,OR)及95%置信区间(95% confidence interval,95% CI)。
DECT定量参数评价:DECT定量参数为计量资料,故首先使用Kolmogorov-Smirnov检验计量资料是否符合正态分布:服从正态分布的计量资料组间比较采用独立样本t检验;不服从正态分布的计量资料组间比较采用Mann-WhitneyU检验。随后同上分别使用单因素和多因素Logistic回归分析,评估各特征对良恶性肺实性结节的鉴别能力,并计算其OR值及95% CI。
组合模型:本研究基于上述多因素Logistic回归分析结果,使用差异有统计学意义(P<0.05)的形态学特征及DECT定量参数构建组合模型。
5.统计学分析
采用SPSS(版本 25.0)、Medcalc(版本 18.2.1)和 R(版本 4.0.3)统计软件分析数据。计数资料以例(%)表示;计量资料以均值±标准差表示。使用ROC曲线的AUC、敏感度、特异度评估形态学特征、DECT定量参数及组合模型的诊断效能。此外,为进一步评估各模型在临床中的应用价值,将组合模型与基于直径或体积的Lung-RADS 1.1分级系统进行对比,并使用DeLong检验比较各AUC间的差异。以双侧P<0.05为差异有统计学意义。
结 果
1.基线特征
本研究一共纳入144名患者的147例肺实性结节。其中肺癌76例,包括67例腺癌(其中1名患者同时存在2个腺癌结节),6例鳞癌和3例小细胞肺癌;良性病变71例,包括31例非特异性炎症(其中1名患者同时存在2个病灶),24例由结核分枝杆菌、新生隐球菌和其他不明原因引起的肉芽肿(其中1名患者同时存在2个病灶),10例良性肿瘤(硬化性肺细胞瘤、错构瘤和支气管腺瘤)和6例肺内淋巴结和纤维增生。良性肺结节和恶性肺结节的临床及形态学特征详见表1。

表1 良恶性肺实性结节的临床及形态学特征
性别和年龄在良恶性肺结节之间差异均无统计学意义(P>0.05)。对于传统形态学特征,形状和毛刺在两组之间的差异均无统计学意义(P>0.05);而边缘、分叶、胸膜反应、空气支气管征及血管集束征在两组之间差异均有统计学意义(P<0.05)。此外,结节的直径在两组之间差异有统计学意义(P=0.022),而两组之间的体积差异无统计学意义(P=0.050)。基于直径的Lung-RADS分类在两组之间差异有统计学意义(P=0.014),而基于体积的Lung-RADS分类在两组之间差异无统计学意义(P=0.095)。
恶性肺结节的Zeff_A、IC_A、NIC_A、Zeff_V、IC_V、NIC_V均显著高于良性肺结节,差异均有统计学意义(P<0.05,表2),见图1、2。
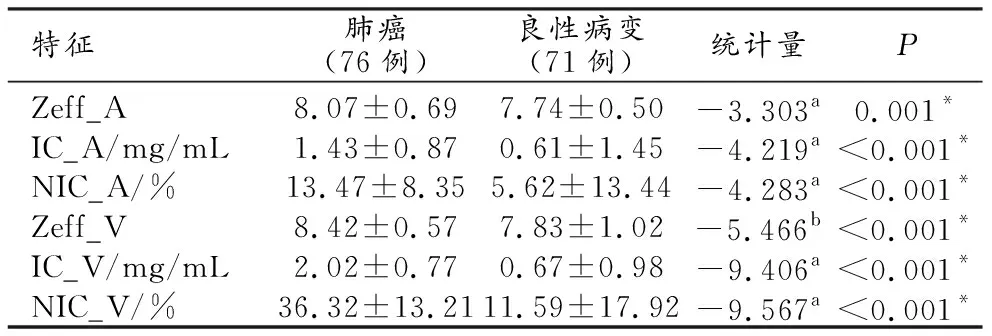
表2 良恶性肺实性结节的DECT定量参数
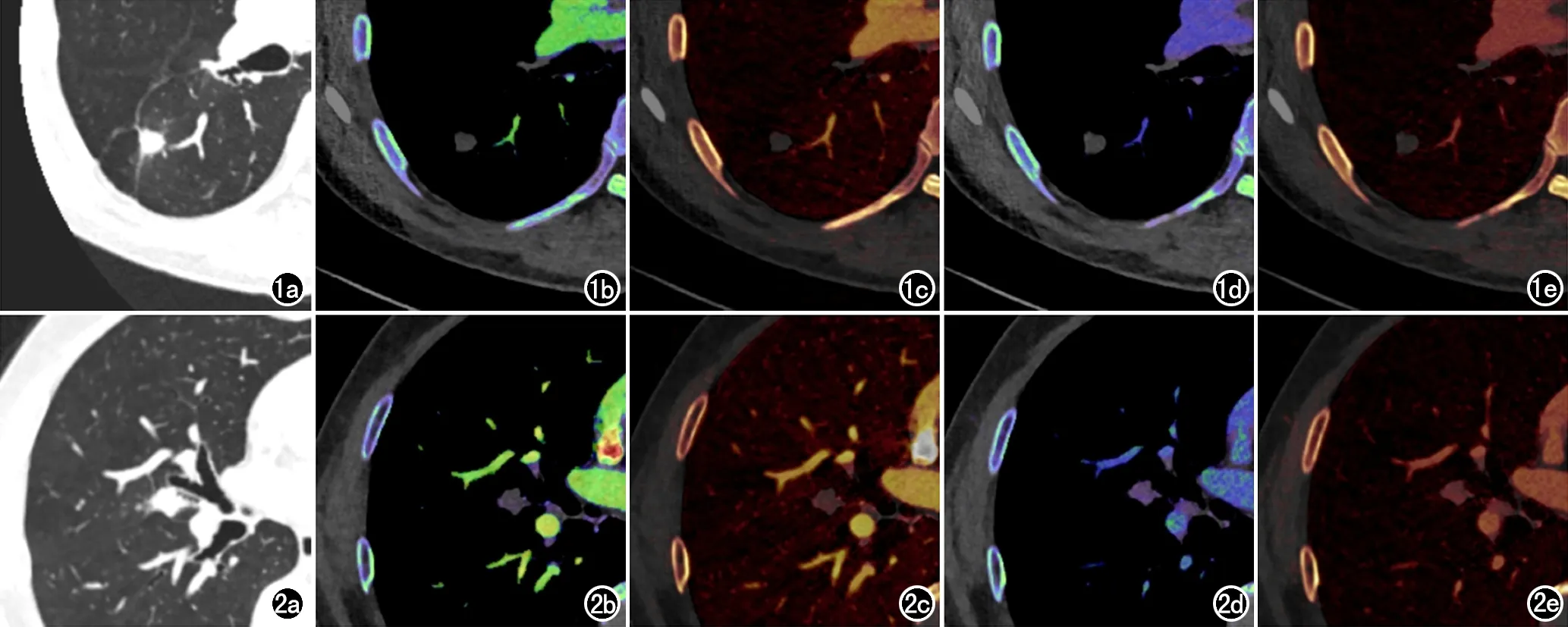
图1 男,49岁,肺部肉芽肿非特异性炎症。a)VNI;b)Zeff_A=7.3;c)IC_A=0.1 mg/mL;d)Zeff_V=7.4;e)IC_V=0.3 mg/mL。VNI,虚拟平扫图像;Zeff_A,动脉期有效原子序数;IC_A,动脉期碘含量;Zeff_V,静脉期有效原子序数;IC_V,静脉期碘含量。 图2 男,66岁,肺腺癌。a)VNI;b)Zeff_A=8.2;c)IC_A=1.3 mg/mL;d)Zeff_V=8.7;e)IC_V=2.4 mg/mL。VNI,虚拟平扫图像;Zeff_A,动脉期有效原子序数;IC_A,动脉期碘含量;Zeff_V,静脉期有效原子序数;IC_V,静脉期碘含量。
2.模型建立
形态学特征评价:单因素Logistic回归分析显示,边缘、分叶、胸膜反应、空气支气管征、血管集束征均为鉴别良恶性肺结节的预测因子(P<0.05,表3)。将上述形态学特征进行多因素Logistic回归分析,结果显示,仅分叶是鉴别良恶性肺实性结节的独立预测因子(OR:25.465,95% CI:6.988~92.797)。

表3 单因素及多因素Logistic回归分析结果
DECT定量参数评价:单因素Logistic回归分析显示,Zeff_A、IC_A、NIC_A、Zeff_V、IC_V、NIC_V均为鉴别良恶性肺结节的预测因子(P<0.05,表3)。将上述形态学特征进行多因素Logistic回归分析,结果显示,仅NIC_V是鉴别良恶性肺实性结节的独立预测因子(OR:1.100,95% CI:1.062~1.139)。
组合模型:基于上述结果,使用分叶及NIC_V构建组合模型。组合模型的计算公式为:
ln(P/1-P)=-3.186+3.237×分叶(有)+0.095×NIC_V(%)
(4)
其中P是预测恶性肺实性结节的概率(截断值>0.355)。
3.统计学分析
基于直径的Lung-RADS鉴别良恶性肺实性结节的AUC仅为0.640(0.556~0.717)。在形态学特征中,分叶的AUC最高,为0.794(0.720~0.856),但其敏感度较低,仅为64.5%。在DECT定量参数中,IC_V和NIC_V的AUC较高,分别为0.889(0.827~0.935)及0.888(0.826~0.934),但二者的特异度均较低,仅为76.1%及78.9%。组合模型在各方面均显示出较高的诊断效能,其AUC、敏感度、特异度分别为0.942(0.890~0.974)、90.8%及81.7%。
Delong检验显示,组合模型的诊断效能均优于基于直径的Lung-RADS分级、单一形态学特征及DECT定量参数(P<0.05),见表4和图3。

图3 组合模型和单一形态学特征、DECT定性参数的ROC曲线。
讨 论
本研究探讨了DECT定量参数及形态学特征在鉴别良恶性肺实性结节中的应用价值。结果显示,NIC_V和分叶是鉴别良恶性肺实性结节的独立预测因子。基于二者构建的组合模型,其AUC为0.942,显著高于Lung-RADS、单一形态学和DECT定量参数(均P<0.05)。
随着目前肺结节的检出率的升高,良恶性肺结节的判定对患者诊疗决策至关重要。对于怀疑良性肺结节,应定期随诊,避免早期手术并发症对患者的影响。而对于怀疑恶性肺结节,应早期手术干预并制定相应的治疗方案,从而提高患者的预后。在临床工作中,放射医师常根据Lung-RADS分级鉴别肺实性结节的良恶性。Lung-RADS(版本1.1)引入了体积对肺结节的恶性风险进行分类[15]。因此本研究同时使用基于直径和体积的Lung-RADS对肺实性结节进行分类。结果显示,仅基于直径的Lung-RADS分类在良恶性肺实性结节的组间差异有统计学意义(P=0.014),其AUC仅为0.640、61.8%、63.4%,显著低于分叶、NIC_V及组合模型。这表面基于直径的Lung-RADS分类在鉴别良恶性肺实性结节的应用价值有限。
本研究纳入传统形态学特征鉴别良恶性肺实性结节。单因素Logistic回归结果显示,结节的边缘、分叶、胸膜反应、空气支气管征、血管集束征是鉴别良恶性肺实性结节的预测因子,这与既往研究一致[16-20],但这些特征的敏感度均较低(27.6%~67.1%),说明单独形态学特征在良恶性肺结节之间有较大重叠。经过多因素Logistic回归特征选择,仅分叶是鉴别良恶性肺实性结节的独立预测因子,其AUC为0.796。肺部恶性肿瘤分叶形成机制主要包括:一是肿瘤边缘细胞分化程度不一、生长速度不一;二是或受周围结构(如血管或结缔组织)阻挡产生凹陷。然而,肺部良性病变也可出现类似分叶的改变,主要因为肺部增值病变融合形成。这也可能是分叶的特异度较高(94.4%)、敏感性较低(64.5%)的原因。因此,单独的形态学在鉴别良恶性肺实性结节的价值有限,需要联合其他定量参数,以提高鉴别良恶性肺实性结节的诊断效能。
本研究基于既往研究的不足,综合分析了DECT定量参数在鉴别良恶性肺结节的应用价值。在DECT定量参数中,IC能提供病灶对比剂的定量信息,可在一定程度上反映病灶的微血管密度和血供情况[21],其与CT灌注参数也存在明显的相关性[22]。Zeff能反映不同物质的原子构成情况,可用于反映肺结节的组织密度[14]。既往的研究显示,IC能有效鉴别磨玻璃密度结节腺癌的浸润性[23],而Zeff能有效鉴别肺部转移病变和良性病变、鉴别肺癌和肺转移瘤[14,24]。本文研究结果显示,恶性肺实性结节动脉期和静脉期的IC、NIC和Zeff均高于良性肺实性结节,差异有统计学意义。这与以往的研究结果相似[9,10,12,25],这可能是由于恶性肺结节的毛细血管内皮细胞疏松和基底膜不完整,碘造影剂容易渗入细胞间隙。本研究还对比了DECT定量参数在鉴别良恶性肺实性结节中的诊断效能。研究结果显示,IC_V和NIC_V的AUC(0.889、0.888)均明显高于Zeff_A(0.716)、IC_A(0.817)和Zeff_V(0.761),而IC_V和NIC_V的敏感性(0.987、0.974)均明显高于NIC_A(0.684),这些结果提示IC_V和NIC_V或许在鉴别良恶性肺实性结节方面具有重要的应用价值。这可能是由于恶性肺结节微血管走行曲折,造影剂流动缓慢,动脉期微血管不能充满造影剂,静脉期造影剂可充盈微血管并进入细胞间隙[26]。既往研究也显示,NIC_V在鉴别肺癌和炎症病灶中的诊断效能高于NIC_A或IC_A[10,22],其研究结果与本研究类似。多因素Logistic回归结果显示,仅NIC_V是鉴别良恶性肺结节的独立预测因子,这可能是由于IC_V和NIC_V之间的相关性较高。
本研究创新性地纳入有意义的DECT定量参数(NIC_V)及形态学特征(分叶)构建组合模型,并评估了其在鉴别良恶性肺实性结节的诊断价值。研究显示,组合模型的AUC明显高于单一分叶或NIC_V,差异有统计学意义(均P<0.05)。这表明联合DECT定量参数及形态学特征,能进一步提高良恶性肺实性结节的鉴别诊断效能。此外,组合模型的诊断效能明显优于临床常用的Lung-RADS分级(AUC:0.942 vs. 0.640)。表明合理使用组合模型,能够在临床工作中,为患者提供更准确的肺实性结节的良恶性信息,从而改善患者的预后。
本研究的局限性。首先,回顾性研究设计存在不可避免的选择偏移。其次,本研究为单中心研究,需要进一步的外部验证数据来检验结果的可重复性。最后,本研究用VNI图像而不是真正的平扫图像来评估结节大小。但一项有关肺肿瘤模型的体模研究表明,在体积测量中,VNI可以替代真正的平扫图像[27]。
综上所述,基于NIC_V及分叶构建的组合模型,在鉴别良恶性肺实性结节方面具有较高的诊断效能,在临床工作中有良好的应用价值。
