甲泼尼龙治疗HBV相关慢加急性肝衰竭的疗效及安全性的Meta分析*
2023-11-23杨蕊西寇国先
尹 恒 杨蕊西 寇国先 阮 军△
电子科技大学医学院附属绵阳医院绵阳市中心医院 1.肾病科 2.感染科(四川 绵阳, 621000)
慢加急性肝衰竭(ACLF)是指由各种诱因导致的在慢性肝病基础上发生的综合征,临床主要表现为急性黄疸加深和凝血功能障碍,同时可能合并腹水、肝性脑病、感染和肝肾综合征等并发症及多器官功能衰竭[1]。ACLF是肝衰竭中最常见的类型,具有发病率高、病理机制复杂、治疗难度大及病死率高等特点[2]。在我国,引起ACLF的病因主要是肝炎病毒[3,4],特别是乙型肝炎病毒(HBV)感染。目前,HBV相关慢加急性肝衰竭(HBV-ACLF)是一种严重疾病状态,尚缺乏有效的治疗方法,而免疫治疗正成为当前国内外研究者关注的焦点与热点[5]。
近年来,糖皮质激素作为免疫抑制剂已广泛应用于HBV-ACLF的早期临床治疗,其主要通过抑制多种炎症递质的释放及增强单核细胞的吞噬能力,进而发挥抗炎和保护细胞膜的作用[6]。迄今为止,甲泼尼龙在HBV-ACLF的临床应用仍存在争议,且临床研究尚缺乏足够的循证医学证据。因此,本研究旨在通过对甲泼尼龙治疗HBV-ACLF的疗效及及安全性进行Meta分析,以期为临床决策提供新证据。
1 资料与方法
1.1 研究设计 纳入有关甲泼尼龙治疗HBV-ACLF患者的随机对照试验(RCTs),排除重复、数据缺失或无法获取全文的文献,并进行数据处理与质量评价等,语种限定为中文和英文。
1.2 研究对象 纳入标准:①符合《肝衰竭诊治指南》中有关HBV-ACLF的诊断标准[7];②血清HBsAg阳性大于6个月的成人;③无糖皮质激素应用禁忌证;④性别、种族和国籍不限。排除标准:①合并其他肝炎病毒感染;②合并脓毒症等严重感染;③合并重要脏器的严重病变;④合并肝癌等实质肿瘤患者;⑤妊娠或哺乳期妇女。干预措施:对照组采用保肝、退黄、抗病毒等综合内科标准治疗;试验组采用甲泼尼龙联合综合标准内科标准治疗。结局指标包括血清总胆红素(TBil)、丙氨酸氨基转移酶(ALT)、凝血酶原活动度(PTA)、病死率、HBV脱氧核糖核酸(HBV DNA)、有效率和并发症发生率。有效率=(显效+好转)/总例数×100%。显效:临床症状和体征显著缓解,TBil降低>50%,且PTA>60%;好转:临床症状和体征有所减轻,TBil降低30%~50%,且PTA为40%~60%;无效:临床症状和体征未见减轻或加重恶化,TBil与PTA改善不明显。
1.3 检索方法 以“甲泼尼龙、糖皮质激素、慢加急性肝衰竭、乙型肝炎病毒”为关键词检索中国期刊全文数据库(CNKI)、中国生物医学文献数据库(CBM)、万方数据库;以“methylprednisolone、glucocorticoid、acute-on-chronic liver failure、ACLF、hepatitis B virus、HBV”为关键词检索PubMed、Cochrane Library、EMbase;检索截止日期为2022年2月。
1.4 提取资料和评价质量 依照纳入与排除标准由两位研究者独立筛选研究、提取数据及评价文献质量,并进行相互交叉核对及纳入研究。采用Cochrane手册推荐的简单评估法对纳入的研究进行质量评价。具体评价的指标为随机方法、分配隐藏、实施盲法、报告失访和退出情况、意向性治疗(ITT)分析及基线可比性。

2 结果
2.1 纳入研究情况 共检索出732篇相关文献,经阅读摘要及全文后,排除重复或非随机对照试验的研究等文献,最终纳入9项研究[8-16],合计727例患者,见表1。
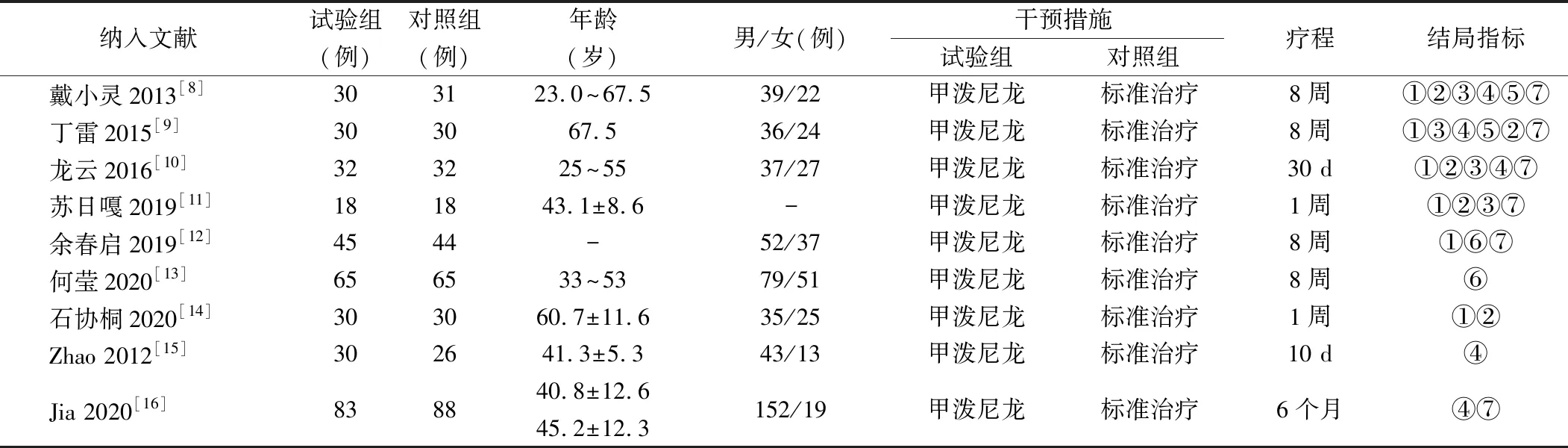
表1 纳入研究基本情况
2.2 文献质量评价 纳入9项研究均为随机化分组[8-16],其中2项研究为随机数字表法分组[11,13],1项研究为随机计算机法分组[16]。所有研究均未具体描述分配隐藏、盲法及ITT分析,其中1项研究提及有病例退出报道[10]。纳入研究的基线资料均具有可比性,见表2。

表2 纳入研究质量评价
2.3 Meta分析结果
2.3.1 血清TBil 6项研究报道了治疗后血清TBil变化情况[8-12,14],各研究间具有统计学异质性(P<0.1,I2=98%);随机效应模型Meta分析显示,试验组的TBil较对照组显著降低[MD=-60.61,95%CI(-90.33~-30.89),P<0.05],见图1。
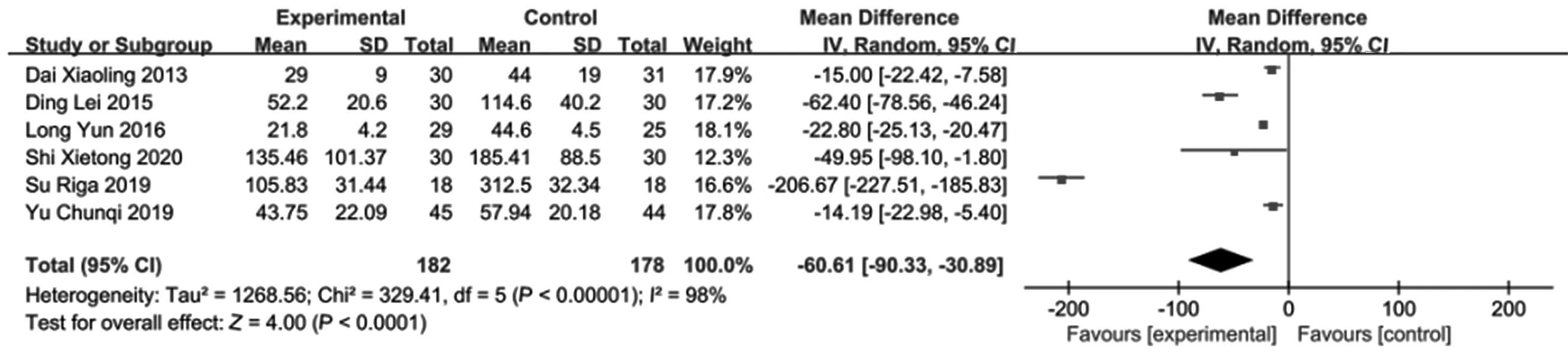
图1 血清TBil森林图
2.3.2 ALT 4项研究报道了治疗后ALT变化情况[8、10,11,14],各研究间具有统计学异质性(P<0.1,I2=100%);随机效应模型Meta分析显示,试验组的ALT较对照组明显降低[MD=-201.49,95%CI(-424.78~-21.79),P<0.05],见图2。
2.3.3 PTA 4项研究报道了治疗后PTA变化情况[8-11],各研究间具有统计学异质性(P<0.1,I2=79%);随机效应模型Meta分析显示,试验组的PTA较对照明显升高[MD=13.59,95%CI(8.15~19.04),P<0.05],见图3。

图3 PTA森林图
2.3.4 病死率 5项研究报道了治疗后病死率变化情况[8-10、15,16],各研究间无统计学异质性(P=0.37.1,I2=7%);固定效应模型Meta分析显示,试验组的病死率较对照组降低,差异有统计学意义[RR=0.79,95%CI(0.63~1.00),P=0.05],但是处在统计学意义的边缘,尚待扩大样本量后行进一步分析,见图4。

图4 病死率森林图
2.3.5 HBV DNA转阴率 2项研究报道了治疗后HBV DNA转阴率变化情况[8,9],各研究间无统计学异质性(P=0.84,I2=0%)。固定效应模型Meta分析显示,两组患者的HBV DNA转阴率差异无统计学意义[RR=1.01,95%CI(0.89~1.14),P>0.05],见图5。
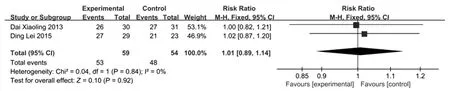
图5 HBV DNA转阴率森林图
2.3.6 有效率 3项研究报道了治疗后有效率情况,各研究间无统计学异质性(P=0.91,I2=0%)[9,12,13]。固定效应模型Meta分析显示,试验组的有效率高于对照组,差异有统计学意义[RR=1.21,95%CI(1.09~1.35),P<0.05],见图6。

图6 有效率森林图
2.3.7 并发症发生率 6项研究报道了治疗后并发症发生情况[8-12,16],各研究间有统计学异质性(P<0.1,I2=77%)。随机效应模型Meta分析显示,试验组和对照组的并发症发生率差异无统计学意义[RR=0.54,95%CI(0.25~1.18),P>0.05],见图7。试验组最常见的并发症有感染、消化道出血、肝性脑病、肝肾综合征等。

图7 并发症发生率森林图
3 讨论
据估算,我国目前有慢性HBV感染者约7 000万,其中慢性乙型肝炎患者2 000万~3 000万[17]。而每年由HBV感染引发的肝衰竭、肝硬化及肝细胞癌的死亡人数约有65万,且呈逐年增加的趋势[18]。HBV相关肝纤维化程度越高,其最终发展成为ACLF的可能性就越大[19]。ACLF是一个多因素共同作用的严重肝病症候群,其通过免疫应答、炎症反应和内毒素血症等引起肝脏缺血缺氧[20],从而导致广泛的肝细胞坏死。
目前,HBV感染占我国ACLF病因80%以上,HBV-ACLF病死率62%~72%,而采用核苷(酸)类似物(NAs)药物控制HBV复制是内科治疗的关键手段[21]。随着NAs药物的临床广泛应用,HBV-ACLF患者的病毒载量迅速下降,但肝功能和肝再生的改善却被推迟,这主要与肝细胞内过度的免疫反应有关。迄今为止,HBV-ACLF的发病机制尚不明确,但我国学者认为其发生发展经历了免疫损伤、缺血缺氧性损伤和内毒素损伤的“三重打击”,而“内毒素-巨噬细胞-细胞因子风暴”为最重要的核心机制。炎症反应和免疫功能紊乱在HBV-ACLF的病程进展中发挥关键作用,而应用于其治疗的具有潜在免疫调节作用的手段有限,包括白蛋白、糖皮质激素、粒细胞集落刺激因子及干细胞移植等[5]。其中以甲泼尼龙为代表的糖皮质激素是当前临床应用常见的抗炎及免疫抑制剂,其主要通过与糖皮质激素受体结合,进而抑制宿主对HBV抗原的免疫应答反应和预防肝细胞溶解来发挥生物学效应[22]。此外,甲泼尼龙通过分子结构的羟基化作用,致使其无需经肝脏转化,从而极大的减轻肝脏负担。一项前瞻性多中心临床试验结果显示甲泼尼龙疗法是治疗HBV-ACLF的有效且安全的临床策略,可提高患者6个月生存率[16]。
本研究显示,与综合内科标准治疗相比,应用甲泼尼龙治疗HBV-ACLF患者试验组的TBil、PTA、病死率和有效率均优于对照组,且未增加并发症发生风险,但并不能改善ALT和HBV DNA转阴率。这表明甲泼尼龙可以应用于HBV-ACLF患者的临床治疗,与杨君等[23]的荟萃分析结果基本一致,提示甲泼尼龙可以作为HBV-ACLF免疫治疗的一种新选择。然而,本研究仍存在一定局限性。首先,纳入研究质量参差不齐,这可能导致研究分析偏差的增大;其次,纳入研究均未描述盲法及分配隐藏,可能引起选择性偏倚和测量偏倚;最后,纳入研究治疗时间和给药剂量不完全一致,且多为小样本量研究,可能存在一定的发表偏倚。
