大黄总蒽醌抑制肝纤维化的作用与机制*
2023-11-23江慧陈晶曾超
江 慧 陈 晶 曾 超
宿迁市第一人民医院药学部 (江苏 宿迁, 223800)
肝纤维化是肝炎向肝硬化发展的重要阶段[1]。在肝硬化发展的过程中,肝功能损害逐渐加重,血清层黏蛋白(LN)、透明质酸(HA)、Ⅳ型胶原(Ⅳ-C)等纤维化指标均升高[2]。此外,该过程中转化生长因子-β1(TGF-β1)/丝裂原活化蛋白激酶(MAPK)、MAPK/细胞外调节蛋白激酶(ERK)通路也有关键作用[3]。有研究指出,调控TGF-β1/MAPK、MAPK/ERK通路通过抑制TGF-β1表达,下调MAPK和ERK的磷酸化水平有助于抗肝纤维化[4,5]。目前临床上仍缺乏高效的抗肝纤维化的药物。大黄总蒽醌是大黄的主要成分,大黄具有保肝利胆的功效,且有研究证实大黄总蒽醌对免疫性肝纤维化大鼠具有肝保护作用[6],但是大黄总蒽醌是否能够调控上述信号通路发挥抗肝纤维化作用仍需要深入探讨。故此,本研究取60只成年SD大鼠开展动物实验,以期为临床患者肝纤维化和肝硬化的防治研究提供新思路。
1 资料与方法
1.1 动物 60只成年SD大鼠,SPF级,雌雄各半,6~8周龄,200~220 g,均购自河南省实验动物中心,合格证号:SCXK(豫)2018-0007。
1.2 药物 大黄总蒽醌干粉(南京普怡生物科技有限公司,纯度≥98%,其中大黄素∶大黄酸∶大黄酚∶芦荟大黄素占比为6∶9∶7∶7,符合《中国药典》质控标准[7]);秋水仙碱(上海吉至生化科技有限公司,纯度≥98%)。
1.3 试剂及仪器 鼠血清天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、LN、HA和IV-C酶联免疫法检测试剂盒(北京万泰生物药业股份有限公司,批号:1802003、1806013、1804025、1805036、1803017);二甲苯溶液、乙醇、盐酸酒精(上海恪敏生物科技有限公司,货号:H2503、H2248、H3067);苏木精-伊红染色法(HE)和Masson染色试剂盒(碧云天生物技术有限公司,批号:20180401、20180936);Trizol试剂盒(美国Invitrogen公司,批号:R18041052);逆转录试剂盒(美国Invitrogen公司,批号:R18060193);ddH2O、2×qPCR Mix(武汉博士德生物工程研究所,货号:A181036、A180714);蛋白定量试剂盒(上海炎熙生物科技有限公司,批号:R20180506);兔抗鼠TGF-β1、p38MAPK、ERK1/2、P-p38MAPK、P-ERK1/2单克隆抗体(一抗),辣根过氧化物酶标记的山羊抗兔TGF-β1、p38MAPK、ERK1/2、P-p38MAPK、P-ERK1/2多克隆抗体(二抗)(福州迈新生物技术开发有限公司,批号:1801106、1802140、1803175、1803112、1806107、1802214、1803149、1804101、1805127、1807135);电化学发光(ECL)试剂(瑞士罗氏公司,货号:E181203)。
FA1204B 型电子天平(上海精密科学仪器有限公司);Varioskan LUX型酶标仪(美国Thermo公司);Allegra X-15R型台式离心机(美国Beckman Coulter公司);EG1150H+C型石蜡包埋机(德国Leica公司);RM2255型组织切片机(德国Leica公司);CKX31型光学显微镜(日本Olympus公司);2720型聚合酶链反应扩增仪(美国ABI公司);TE70XP型转膜仪(美国Bio-Rad公司);JY04S-3E型凝胶分析系统(上海圣科仪器设备有限公司)。
1.4 造模方法 所有大鼠均适应性喂养1周,随机分为正常对照组、模型对照组、阳性药组、低剂量组、中剂量组、高剂量组。除正常对照组外,其余各组均采用四氯化碳、乙醇诱导肝纤维化。造模方法:取10 ml/kg酒精混合物(乙醇∶吡唑∶玉米油=10 ml∶25 mg∶2 ml)灌服,每天1次;同时每周2次腹腔注射四氯化碳橄榄油混合液(四氯化碳∶橄榄油=1∶3),每次剂量0.3 mg/kg,连续造模2个月后参照文献方法[8]鉴定造模是否成功。
1.5 干预方法 确定造模成功后,低、中、高剂量组分别给予大黄总蒽醌干粉0.3、0.6、1.2 g/kg溶于0.01 ml/g大鼠体质量生理盐水中灌胃,阳性药组给予秋水仙碱1 mg/kg溶于0.01 ml/g大鼠体质量生理盐水中灌胃,正常对照组和模型对照组均给予0.01 ml/g大鼠体质量生理盐水灌胃,每天1次,共8周。
1.6 观察指标及方法
1.6.1 观察干预期间大鼠一般情况 包括毛发色泽、二便、体质量变化等,其中体质量采用电子天平检测。
1.6.2 肝功能及肝纤维化指标检测 分别于给药前、4周后、8周后对大鼠经尾静脉采取血液标本,5 ml/只。以2 500 r/min转速对待检测标本以台式离心机离心5 min,对上清液分离后采用酶联免疫法检测试剂盒对血清AST、ALT、LN、HA和IV-C水平进行定量测定,用双对数线性回归曲线拟合方式绘制标准曲线,以空白调零,采用酶标仪测定450 nm波长处各孔OD值。
1.6.3 肝组织病理学变化 以HE染色观察。将大鼠处死后迅速剥离肝脏,取肝组织常规固定处理,包埋后梯度浓度乙醇水化,切片、烤片、脱蜡,梯度浓度乙醇脱苯,苏木精染色5~10 min,冲洗后以盐酸乙醇分化处理,并以伊红复染,脱水、透明、封片、封固。另外采用Masson染色试剂盒进行处理,以光学显微镜观察肝组织病理学变化。计算大鼠肝脏指数,即肝脏质量与体质量比值;参照文献[9]对大鼠肝纤维化进行分级,将无纤维化记为0级;将汇管区扩大纤维化、局限窦周及小叶内纤维化记为1级;将汇管区周围纤维化、纤维间隔形成,小叶结构保留记为2级;将大量纤维间隔形成伴小叶结构紊乱但无肝硬化记为3级;将有早期肝硬化记为4级。
1.6.4 肝组织TGF-β1、p38MAPK、ERK1/2、ERK2 mRNA表达检测 取肝组织研磨后匀浆,以试剂盒提取总RNA,反转录,对互补的DNA链进行qRT-PCR方法检测。PCR扩增反应体系共25 μl,其中ddH2O、 2×qPCR Mix、7.5 μm引物+互补的DNA,分别为8、12.5、2、2.5 μl。TGF-β1上游引物序列:5′-ATCGCTAGAGAGGATCGGAGACTAG-3′,下游引物序列:5′-TGCGTATAGGCGCGATAGGCTAGAC-3′;p38MAPK上游引物序列:5′-AGCTCGAGAGGCTCTAGAGCTAGC-3′,下游引物序列:5′-TCGATAGCTATAGGGCTAGAGCTA-3′;ERK1/2:上游引物序列:5′-ATGCGCTAGAGAGCTAGAGCTAG-3′,下游引物序列:5′-CTGGGGGATAGGGCGGCTAGAGCTAG-3′;ERK2上游引物序列:5′-ATGGCTCGGCGTTTAGAGGCGCGATGC-3′,下游引物序列:5′-TGGAGAGCTATATATTCTGCGATGCTA-3′;β-actin(内参)上游引物序列:5′-TGGTTTCGCGATATGGC-GCGATAG-3′,下游引物序列:5′-ATGCTCTAGAGGAGCTA-GAGAGC-3′,上述引物均委托深圳晶美生物科技工程有限公司设计并合成,预计扩增产物长度分别为:346 bp、320 bp、282 bp、268 bp、240 bp。PCR扩增反应条件:92℃(30 s),45个循环:95℃(60 s)、60℃(40 s)、55℃(120 s),最后50℃(10 min)。绘制熔解曲线,2-ΔΔCT即为目的基因的表达量。
1.6.5 肝组织TGF-β1、p38MAPK、ERK1/2、ERK2、P-p38MAPK、P-ERK1/2、P-ERK2蛋白表达检测 以Western Blotting法检测。取肝组织匀浆后12 000 r/min转速离心10 min,取蛋白并BCA定量。取50 μg样本并加入凝胶,电泳后转膜、过夜。加入一抗,4℃过夜;加入二抗,室温2 h。实施ECL反应,曝光并显色,以GAPDH为内参,以目的蛋白与内参条带光密度的比值记为目的蛋白的相对表达量,并计算P-p38MAPK/p38MAPK、P-ERK1/2/2/ERK1/2/2、P-ERK2/ERK2。

2 结果
正常对照组、模型对照组、阳性药组、低剂量组、中剂量组、高剂量组在实验过程中分别有0、2、1、2、1、1只大鼠死亡,死因主要为灌胃误入肺内、肺部感染、灌胃操作失误误伤脊髓等,各组分别有10、8、9、8、9、9只大鼠存活。
2.1 各组大鼠一般情况 正常对照组干预期间饮食、二便正常,体质量稳定,毛发有光泽且浓密;模型对照组干预期间食欲不佳,大小便频率减少,大小便性状基本正常,体质量下降,毛发暗且稀疏;低剂量组干预期间食欲下降,大小便频率减少且性状基本正常,体质量有所下降,毛发暗且稀疏;中剂量组和阳性药组干预期间食欲尚可,大小便频率及性状基本正常,体质量有轻微下降,毛发暗;高剂量组干预期间食欲良好,二便性状正常,大便频率有所增多,体质量基本稳定,毛发有光泽且浓密。
2.2 各组大鼠肝功能指标变化比较 见表1。
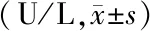
表1 各组大鼠肝功能指标变化比较
2.3 各组大鼠肝纤维化指标变化比较 见表2。

表2 各组大鼠肝纤维化指标变化比较
2.4 各组大鼠肝组织病理学变化观察 图1和图2示,与正常对照组大鼠比较,模型对照组大鼠肝细胞内可见大量空泡,细胞核皱缩甚或消失,汇管区有大量炎性浸润,可见严重纤维化病变;与模型对照组比较,阳性药组和3剂量组脂肪变性、空泡、细胞核皱缩、肝小叶受损、汇管区炎性浸润和纤维化病变程度均减轻;与阳性药组比较,低剂量组上述病理学变化均加重,中剂量组均无明显变化,高剂量组上述病理学变化均减轻。
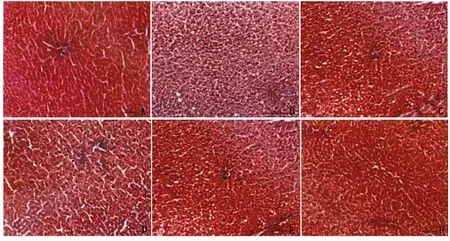
图1 各组大鼠肝组织病理学变化观察(HE染色,×100)
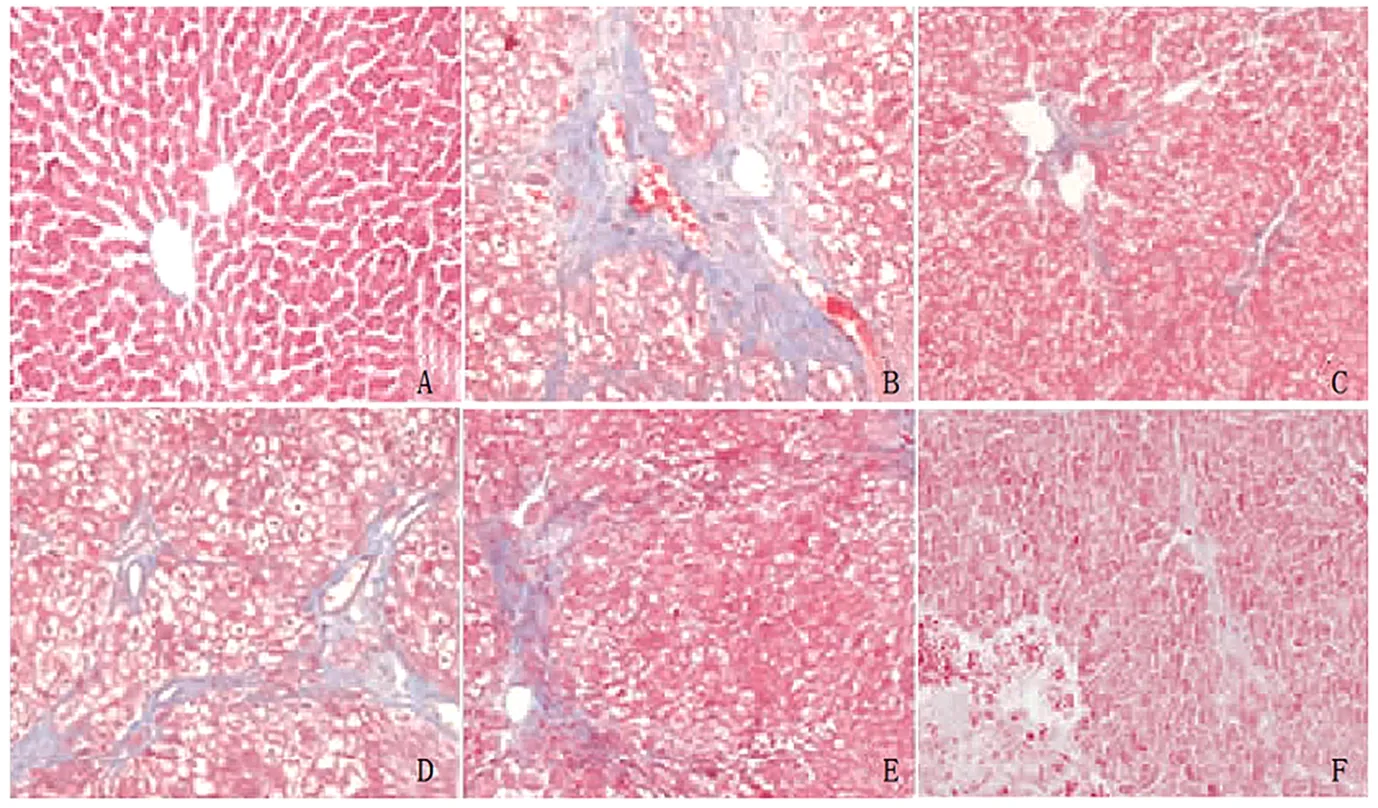
图2 各组大鼠肝组织病理学变化观察(Masson染色,×100)
2.5 各组大鼠肝脏指数和肝纤维化分级 见表3。
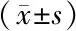
表3 各组大鼠肝脏指数和肝纤维化分级比较
2.6 各组大鼠肝组织TGF-β1、p38MAPK、ERK1/2、ERK2 mRNA表达比较 见表4。
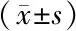
表4 各组大鼠肝组织TGF-β1、p38MAPK、ERK1/2、ERK2 mRNA表达比较
2.7 各组大鼠肝组织TGF-β1、p38MAPK、ERK1/2、ERK2、P-p38MAPK、P-ERK1/2、P-ERK2蛋白表达比较 见表5和图3、4。

图3 各组大鼠肝组织TGF-β1、p38MAPK蛋白及P-p38MAPK 水平检测(Western Blotting检测)

图4 各组大鼠肝组织ERK1/2、P-ERK1/2蛋白表达 检测(Western Blotting检测)
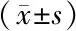
表5 各组大鼠肝组织TGF-β1、p38MAPK、ERK1/2、P-p38MAPK、P-ERK1/2蛋白表达比较
3 讨论
肝纤维化是指病毒、自身免疫因素、乙醇、药物、胆汁淤积、代谢紊乱等原因所致的肝脏炎性损伤随着时间的推移而发展,引发的以肌成纤维细胞被激活、细胞外基质大量合成和分泌为主要特点的病理过程[10]。研究认为,在肝纤维化发展的过程中,细胞外基质大量沉积于肝小叶内和汇管区,可造成局部组织变性坏死,甚至可进展为肝硬化[11]。但是目前常用的方法对肝纤维化发展的防治作用效果均不甚理想,仍需积极探讨合理有效的方案。
本次研究中,治疗后阳性药组和低、中、高剂量组状态较模型对照组好转,且血清AST、ALT、LN、HA、IV-C水平均较治疗前下降,且高剂量组治疗8周后上述指标水平与治疗前基本保持不变,可知秋水仙碱、大黄总蒽醌可促进大鼠的状态好转,并且还可保护大鼠的肝功能,抑制肝纤维化;模型对照组肝细胞内可见大量空泡,细胞核皱缩甚或消失,汇管区有大量炎性浸润,可见严重纤维化病变,阳性药组和高、中、低剂量组病理学改变则有所减轻,且高剂量组的肝脏组织病理学观察结果与正常对照组最为接近,肝脏指数和肝纤维化分级结果显示高剂量组优于低剂量组、中剂量组和阳性药组,可知秋水仙碱、大黄总蒽醌均可减轻大鼠的病情,控制肝纤维化,且大黄总蒽醌的作用呈明显的剂量依赖性。秋水仙碱是从秋水仙中提取的生物碱,可抗炎、抑制肝纤维化和肝硬化,在临床中其作用已得到肯定[12],故本研究选用该药物作为阳性对照,且本研究所用秋水仙碱的剂量为临床等效剂量。大黄可保肝利胆,在既往的研究中表明大黄可促进肝细胞再生,刺激产生干扰素抑制病毒繁殖,还可促进肝脏血液循环改善局部微循环,并且还能疏通肝内毛细胆管减轻胆汁淤积,因而保肝作用显著[13]。大黄总蒽醌为大黄的有效成分,该药物有助于减轻自身免疫性肝纤维化大鼠的病情程度,且还可显著控制细胞外基质的合成和分泌,增加细胞外基质的降解,通过上述途径减少肝细胞外基质的沉积,从而有助于减轻肝纤维化。覃鲁珊等[14]研究显示大黄蒽醌与鞣质对大鼠肝脏具有损伤和保护双向作用,且大黄蒽醌类成分对肝脏的保护作用强于大黄鞣质类成分,本研究结果与上述报道部分结果相符,但本研究并未发现大黄总蒽醌对实验动物有肝损伤作用,可能由于本研究中大黄总蒽醌低、中、高剂剂量组的给药剂量远低于上述报道,也提示将大黄总蒽醌应用于临床中时应严格注意使用剂量,确保安全。
TGF-β1是公认的与肝纤维化发展密切相关的因子之一[15-17],其基因与蛋白表达被激活可促使肌成纤维细胞的转化,并且还可诱导合成大量的细胞外基质,与肝纤维化指标、肝纤维化严重程度均密切相关。MAPK受TGF-β1的调控,有研究认为,在肝纤维化发展过程中P-p38MAPK水平异常升高,可介导细胞核引起一系列的生物学反应,影响肝细胞的增殖和活化过程,诱导肝纤维化的发生和发展;ERK包含ERK1和ERK2,受MAPK调控,与肝细胞的增殖活化密切相关[18]。研究显示,磷酸化的ERK1/2可进入细胞核内,对转录因子及细胞周期蛋白D的表达发挥调节作用,促使细胞增殖,且与肝小叶内、汇管区纤维化变性也有紧密关联[19]。另有报道指出,夏枯草总三萜可通过阻断ERK信号通路,控制ERK1/2的磷酸化水平抑制肝纤维化的发展,发挥抗肝纤维化作用[20]。本研究中,与正常对照组比较,模型对照组TGF-β1 mRNA及蛋白表达,P-p38MAPK、P-ERK1/2蛋白表达均显著升高,而与模型对照组比较,阳性药组和低、中、高剂剂量组上述水平均显著下降,且与阳性药组比较,低剂量组均显著升高,中剂量组均基本未变,高剂量组均显著下降,表明大黄总蒽醌可调控大鼠模型肝组织TGF-β1-MAPK/ERK通路。结合上述分析报道及本研究结果,推测大黄总蒽醌很可能是通过调控大鼠模型肝组织TGF-β1-MAPK/ERK通路抑制TGF-β1 mRNA及蛋白表达,降低P-p38MAPK、P-ERK1/2蛋白表达进而实现改善肝功能、降低血清肝纤维化指标水平、减轻肝纤维化病变的作用的。
综上,大黄总蒽醌可改善大鼠的一般状态、保护肝功能,还可降低血清肝纤维化指标水平,减轻肝脏组织病变程度,且中剂量的大黄总蒽醌作用与秋水仙碱相近,而高剂量的大黄总蒽醌作用最佳。推测大黄总蒽醌很可能是通过调控大鼠肝组织TGF-β1-MAPK/ERK通路抑制TGF-β1 mRNA及蛋白表达,降低P-p38MAPK、P-ERK1/2蛋白表达发挥上述作用的。但大黄总蒽醌是否通过调控此路径发挥抗肝纤维化作用的仍需要进一步研究证实。
