米香型白酒中不同制曲工艺的微生物群落结构差异分析
2023-11-23皇甫洁何猛超温银萍韩兴林何松贵王德良吴振强
皇甫洁,何猛超,刘 雅,温银萍,4,韩兴林,何松贵,王德良,吴振强
(1.华南理工大学生物工程学院,广东广州 510006;2.广东省九江酒厂有限公司,广东佛山 528203;3.中国食品发酵工业研究院有限公司,北京 100015;4.石河子大学化学化工学院,新疆石河子 832099)
中国白酒酿造历史久远,采用的是多种微生物共同发酵的传统酿制技术,其生产制作工艺更是中华民族至关重要的非物质文化遗产之一[1-2]。按照使用原料可分为粮食白酒和代用原料白酒;按照生产方式可分为固态法白酒、半固态法白酒和液态法白酒、机械化白酒、半机械化白酒和手工生产白酒;按糖化发酵剂分类可分为大曲白酒、小曲白酒和麸曲白酒;按香型可分为浓香型白酒、酱香型白酒、清香型白酒、豉香型白酒、米香型白酒、凤香型白酒等十二大香型白酒[3-4]。相比与世界上其他的蒸馏酒,中国白酒酒体和谐丰满,风格独特,酒体成分最为丰富[5]。
米香型白酒是以广东、广西地区米制蒸馏酒制作工艺为基础的一类白酒总称,包括豉香型白酒和米香型白酒,是一种独特的白酒,因独特的生产过程造就了其“玉、冰、清、米香、独特、甘润、回味爽净”的独特风格[6]。米香型白酒是酒曲中霉菌、酵母、细菌等微生物与原料的共同协调发酵作用得到的产物[7-9]。徐成勇等[10]利用平板稀释法在米香型白酒酒曲中分离出了部分微生物;萧暖章等[11]从麦芽汁培养基中分离出了表面酵母、产酯酵母、假丝酵母、酿酒酵母等功能性酵母菌;吴雪梅等[12]通过传统培养法分析了米香型白酒酒曲和发酵过程中的微生物,结果表明酒曲中主要的微生物是米根霉和酒精酵母。
随着科学技术的迅猛发展,白酒行业也逐渐往数字化、智能化、机械化方向发展,能够大大提高白酒的产量和品质的均一性,同时也能够解决生产劳动力不足、劳动强度大等问题。本论文通过高通量测序技术对九江酒厂传统制曲和圆盘制曲的微生物群落结构多样性进行对比分析,以期为企业机械化制曲的质量提升提供改进措施及建议。
1 材料与方法
1.1 材料、试剂及仪器
曲样:本实验所用的两种曲样为传统制曲和圆盘制曲,由广州九江酒厂有限公司提供,每次取200 g,实验室保藏(4 ℃和-20 ℃)至检测。大曲微生物DNA试剂盒为Fast DNA®Spin Kit for Soil。
试剂及耗材:无水乙醇、浓硫酸、氢氧化钠、酚酞等(均为分析纯),天津市福晨化学试剂厂;乙酸乙酯、己酸乙酯等标准品(均为色谱纯),美国Sigma-Aldrich 公司;TAE 缓冲液:北京索莱宝科技有限公司;引物,上海生物工程股份有限公司;DNA Marker,Takara;琼脂糖,南京生兴生物技术有限公司;核酸染料Gengreen,上海赛百盛有限公司;土壤DNA 提取试剂盒(E.Z.N.A.Soil DNA Kit),Omega Bio-Tek 公司。
仪器设备:CP1502 电子天平,上海奥豪斯仪器有限公司;HH-S6A 电热恒温水浴锅,北京利伟永兴仪器有限公司;PX2 型聚合酶链式反应(polymerase chain reaction,PCR)仪,上海赛默生物科技有限公司;DYY5 稳压电泳仪,北京六一仪器厂;GeI Image System Tanon 1600 凝胶成像仪,上海天能科技有限公司;Illumina MiSeq 高通量测序平台,美国Illumina公司。
1.2 实验方法
1.2.1 大曲理化指标检测
不同类型高温大曲的理化指标(糖化力、液化力、酯化力、发酵力、酸度等)依据QB/T 4257—2011《酿酒大曲通用分析方法》测定[13]。
1.2.2 大曲微生物群落组成检测
(1)总DNA 的提取[14-15]。称取不同类型高温大曲5.0 g 用液氮速冻后迅速研磨。大曲总DNA 提取方法按照土壤DNA 提取试剂盒(E.Z.N.A.Soil DNA Kit)操作说明书。为了保证所提取基因组的浓度及纯度对其进行PCR扩增及产物纯化,对细菌16S rRNA 基因的V3—V4 高变区进行扩增,所用引物为338F/806R(5-ACTCCTACGGGAGGCAGCA-3/5-GGACTACHVGGGTWTCTAAT-3);对真菌的内部转录间隔区(ITS1)进行扩增,所用引物为ITS5F/ITS1R(5-GGAAGTAAAAGTCGTAACAAGG-3/5-GCTGCGTTCTTCATCGATGC-3)。扩增后用1%琼脂糖凝胶电泳进行检测。
(2)高通量测序。将检测合格样品送往苏州帕诺米克生物医药科技有限公司,通过高通量测序(Illumina Miseq PE250)平台进行高通量测序。
1.3 数据分析
每个样品至少3 次重复,实验数据以平均数±标准差(mean±SD)表示,显著性差异以p<0.05 为标准。
利用Excel 2019、IBM SPSS Statistics 25等统计软件进行数据处理和分析,利用Origin pro 2021、Excel 2019 和网站https://www.omicstudio.cn/tool 进行作图。
2 结果与分析
2.1 传统制曲与圆盘制曲理化指标分析结果
衡量酒曲性能主要通过对糖化力、液化力、发酵力与酯化力四大发酵性能进行分析。糖化力指酒曲中糖化微生物及糖化酶将可溶性淀粉水解为葡萄糖的能力,是衡量酒曲糖化作用强弱的一个重要指标[16]。液化力指酒曲中多种酶系对淀粉水解的综合能力,当酒曲的液化力较高时,发酵体系中微生物可利用更多的可溶性糖,从而提高产酒率。此外,液化力与糖化力成正相关,当糖化力较高时,液化力也高。发酵力指酒曲生成乙醇的能力,是反映酒曲产酒能力的重要标志。酯化力指酒曲催化酸醇酯化的能力,直接影响酒曲酒的质量和品格。酒曲发酵性能、风味形成与发酵微生物分类组成息息相关。对比两种不同工艺酒曲糖化力发现,圆盘工艺制曲的糖化力较高,传统酒曲的酯化力较高,圆盘制曲的发酵力略高于传统制曲,两种不同工艺的酒曲液化力相差不大。由表1 可知,传统制曲与圆盘制曲相比其酯化力和水分含量更高,表明传统制曲更有利于曲中酯类等风味化合物的保存;圆盘制曲的发酵力和糖化力显著高于传统制曲,表明圆盘制曲中微生物的生长繁殖代谢和将可溶性淀粉水解能力均要高于传统制曲。
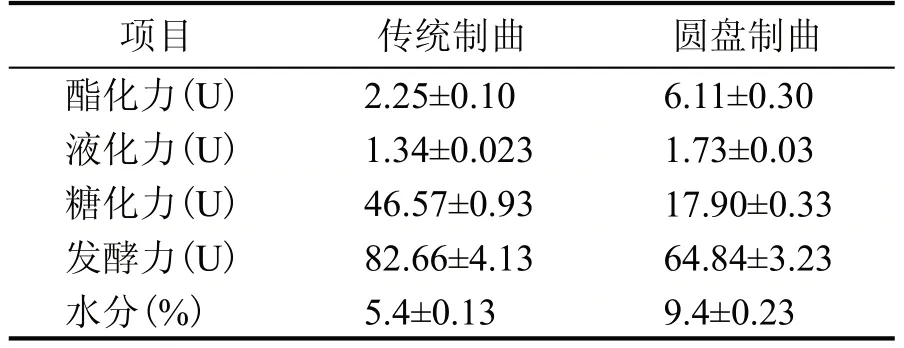
表1 酒曲理化指标分析
2.2 传统制曲与圆盘制曲微生物指标分析结果
2.2.1 传统制曲与圆盘制曲细菌微生物群落结构分析
从表2 可看出,传统制曲和圆盘制曲两种样品的覆盖率(Goods coverage)均高于0.99,说明测序结果具有较高可信度,能够反映样品的真实情况[17]。Chao 指数是用于估算样本中所含物种数目的指数,数值越高表示样本中所含的物种数目越多,可以看出传统制曲的物种数目高于圆盘制曲的物种数目。Shannon 指数、Simpson 指数能够反映样品的物种多样性,数值越大表示样本中群落多样性越高,可以看出圆盘制曲的群落多样性高于传统制曲。

表2 两种不同大曲微生物群落α-多样性指数差异
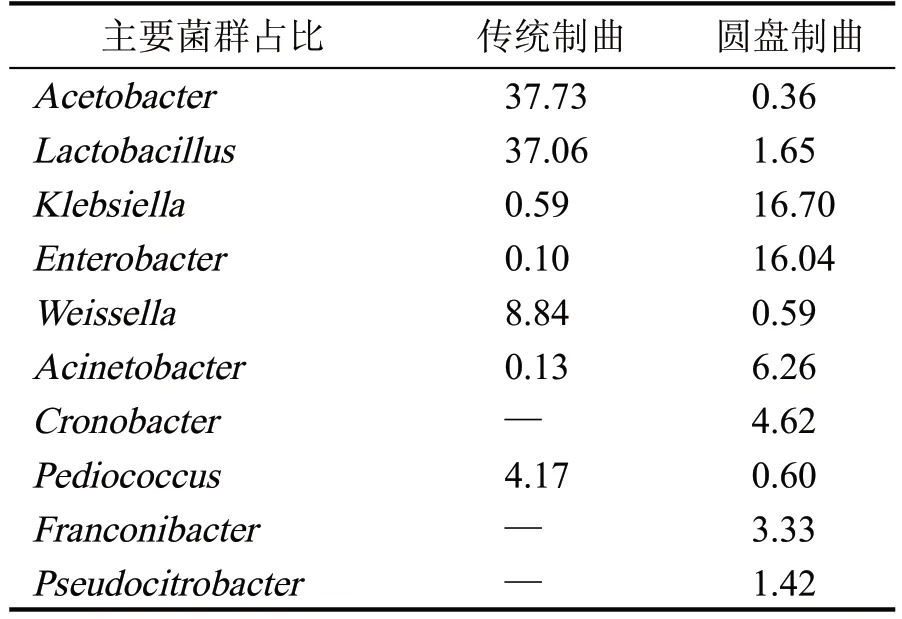
表3 两种曲在属水平主要细菌(>1%,%)
从图1(a)可以看出,传统制曲和圆盘制曲两种曲的优势细菌门是不同的,传统制曲的优势细菌门为厚壁菌门(Firmicutes),占总丰度的52.01 %,其次是变形菌门(Proteobacteria),占总丰度的40.79 %;圆盘制曲的优势细菌门为变形菌门(Proteobacteria),占总丰度的89.57 %,厚壁菌门(Firmicutes)占比较少。从图1(b)可以看出,传统制曲和圆盘制曲在细菌属水平上的微生物群落结构优势菌种完全不同。传统制曲的优势细菌属为:醋酸菌属(Acetobacter)占总丰度的37.72 %,乳酸杆菌属(Lactobacillus)占总丰度的37.06%,魏斯氏菌属(Weissella)占总丰度的8.84 %等,都为豉香型白酒中常见的功能微生物。圆盘制曲的优势细菌属为:克雷伯氏菌(Klebsiella)16.70 %,肠杆菌属(Enterobacter)16.04 %等,为非酿酒功能微生物,醋酸杆菌、乳酸杆菌占比几乎没有。
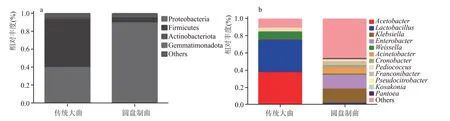
图1 细菌门/属水平相对丰度图
2.2.2 传统制曲与圆盘制曲真菌微生物群落结构分析
从表4 可以看出,传统制曲和圆盘制曲两种样品的覆盖率(Goods coverage)均高于0.99,说明测序结果具有较高可信度,能够反映样品的真实情况。Chao 指数可以看出圆盘制曲的物种数目高于传统制曲的物种数目。Shannon 指数、Simpson 指数能够反映样品的物种多样性,数值越大表示样本中群落多样性越高,可以看出传统制曲的群落多样性高于圆盘制曲。

表4 两种不同大曲微生物群落α-多样性指数差异
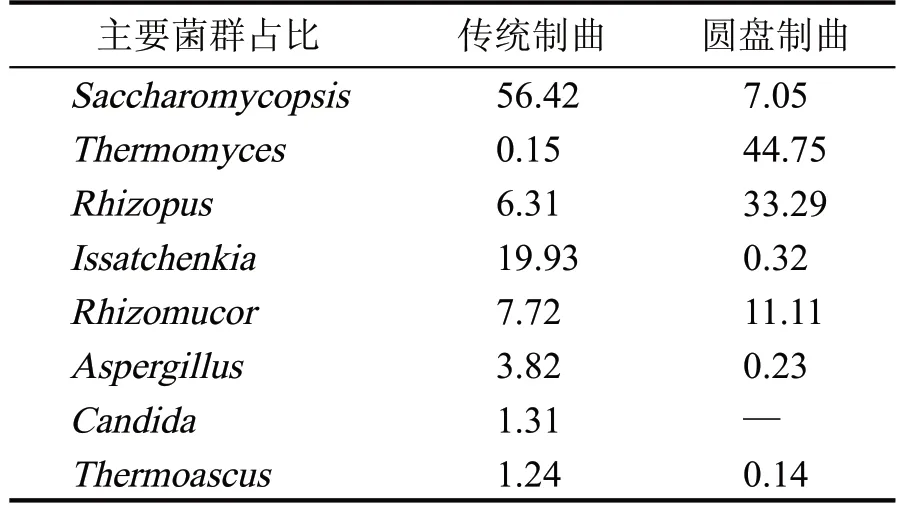
表5 两种曲在属水平主要真菌(>1%,%)
从图2(a)可以看出,传统制曲和圆盘制曲两种曲的优势真菌门也是不同的,传统制曲的优势真菌门为子囊菌门(Ascomycota),占总丰度的85.89%,而毛霉菌门(Mucoromycota)占比较少,仅为14.01 %,圆盘制曲的优势真菌门为子囊菌门(Ascomycota),占总丰度的54.21 %,其次是毛霉菌门(Mucoromycota),占总丰度的45.16 %。从图2(b)可以看出,传统制曲和圆盘制曲在真菌属水平上的微生物群落结构优势菌种完全不同。传统制曲的优势真菌属为:复膜孢酵母属(Saccharomycopsis)占56.42 %,伊萨酵母属(Issatchenkia)占19.93 %,毛霉属(Rhizomucor)占7.72 %,根霉属(Rhizopus)占6.30%等。圆盘制曲的优势真菌属为:嗜热真菌属(Thermomyces)占44.75 %,根霉属(Rhizopus)占33.29%,毛霉属(Rhizomucor)占11.11%,而复膜孢酵母属(Saccharomycopsis)仅占7.05 %、伊萨酵母属(Issatchenkia)占0.32%。

图2 真菌门/属水平相对丰度图
3 结论
本研究采用高通量测序技术,对比了九江酒厂米香型白酒中传统制曲和圆盘制曲两种制曲方式的理化指标、微生物指标的差异性。理化指标结果表明,传统制曲的酯化力、糖化力、发酵力、液化力等均高于圆盘制曲;微生物结果表明,在细菌门水平,传统制曲的优势细菌门为厚壁菌门(Firmicutes),占总丰度的52.01 %,圆盘细制曲的优势菌门为变形菌门(Proteobacteria),占总丰度的89.57%,在细菌属水平上,传统制曲的优势细菌属为醋酸菌属(Acetobacter)、乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)等,都为米香型白酒中常见的功能微生物,圆盘制曲的优势细菌属为克雷伯氏菌(Klebsiella)、肠杆菌属(Enterobacter)等为非酿酒功能微生物,而醋酸杆菌、乳酸杆菌占比几乎没有;在真菌门水平上,传统制曲的优势真菌门为子囊菌门(Ascomycota),占总丰度的85.89%,圆盘制曲的优势真菌门为子囊菌门(Ascomycota),占总丰度的54.21%,在真菌属水平上,传统制曲的优势真菌属为复膜孢酵母属(Saccharomycopsis)、伊萨酵母属(Issatchenkia)、毛霉属(Rhizomucor)、根霉属(Rhizopus)等,圆盘制曲的优势真菌属为嗜热真菌属(Thermomyces)、根霉属(Rhizopus)、毛霉属(Rhizomucor),两种曲在真菌属水平上也是各不相同的。通过以上结果显示,传统制曲的质量优于圆盘制曲的质量,可以为企业的圆盘制曲提供改进意见和策略。
