一株水华鱼腥藻溶藻细菌的分离鉴定和溶藻特性
2023-11-22洪桂云黄浚峰朱钰妮朱曙光
洪桂云,黄浚峰,朱钰妮,朱曙光
一株水华鱼腥藻溶藻细菌的分离鉴定和溶藻特性
洪桂云,黄浚峰,朱钰妮,朱曙光
(安徽建筑大学环境与能源工程学院,安徽省建筑能效控制与评估教育部工程研究中心,合肥 230601)
从不同来源的水体和土样中,筛选出对水华鱼腥藻具有溶藻作用的溶藻菌株SLW6。对菌株SLW6进行形态特征分析和生理生化鉴定,及16S rDNA序列分析,并研究了溶藻菌在不同培养时期、不同pH条件下对菌株SLW6溶藻效果的影响,探究了该菌株对水华鱼腥藻的溶藻方式。结果表明:菌株SLW6呈革兰氏阴性,V-P试验、明胶液化试验、甲基红试验为阴性,过氧化氢试验、硝酸盐还原试验都为阳性,菌株SLW6与产碱杆菌属的(NR113606.1)的同源性达到99.65%,结合形态学特征,生理生化鉴定和16S rDNA序列分析,初步判断溶藻菌株SLW6为产碱菌属(GenBank登录号为OP363821)。超声辅助热乙醇提取叶绿素a,分光光度法测定叶绿素a含量,用叶绿素a含量变化计算溶藻率,结果表明SLW6处于对数期时的溶藻效果最好,溶藻率达89.45%;在pH=7条件下,溶藻效果较好,溶藻率为47.03%;溶藻菌SLW6对水华鱼腥藻的作用方式是直接溶藻为主间接溶藻作用为辅。
溶藻菌;水华鱼腥藻;分离鉴定;溶藻特性;溶藻方式
当下淡水与海洋水体富营养化程度的日益加剧,有害藻类暴发日趋频繁,严重影响了水域生态系统的安全,治理水体富营养化现象,是水环境中一个重大的问题。对于藻类水华及其引起的灾害问题主要治理方法有物理、化学、生物处理3种。生物控藻技术是利用一些生物可产生的特殊物质或藻类的天敌抑制藻类的生长繁殖,控制藻类数量防治水华[1]。微生物控藻技术是利用微生物来控制蓝藻水华[2],本次实验研究的是水华鱼腥藻的溶藻作用,是微生物控藻技术中的一部分。噬藻体是一种能吞噬藻类的病毒,可通过直接侵染的方式裂解藻细胞[3]。细菌的溶藻有直接作用和间接作用两种方式,少数的溶藻细菌如黏细菌属[4]、噬胞菌属[5]和假交替单胞菌属[6]等可以与藻细胞直接接触破坏细胞壁达到裂解藻细胞的目的;大部分溶藻细菌可通过向环境中释放溶藻活性物质间接溶藻,如蛋白质、多肽、氨基酸、生物碱等[7]。
微生物控藻技术中溶藻菌抑藻的研究日益增多,很多研究都充分证明了溶藻菌在调节藻类生长速率,对毒素产生的控制,迅速消退水华现象方面起到重要的作用,具有广阔的应用前景。
本研究拟以水华鱼腥藻为研究对象,从不同来源的水体中分离具有溶藻作用的溶藻菌,对其进行形态观察、生理生化鉴定和16S rDNA序列分析。研究不同培养时期和不同pH值对溶藻菌溶藻效果的影响,分析溶藻菌的溶藻特性,并初步探究该溶藻菌对水华鱼腥藻的溶藻方式。
1 材料与方法
1.1 供试藻种
本实验所用水华鱼腥藻()FACHB-1255购自中科院水生生物所藻种保藏中心,采用BG11培养基培养[8]。培养条件为25 ℃下光照度2 000~2 500 lx,光暗比12 h∶12 h,静置培养,每天定时摇动3次。
1.2 试验方法
1.2.1 溶藻菌的分离与鉴定 在巢湖富营养化水体中采集5处具有代表性的水体,水样采集点分布图如图1所示。采集完毕立即置于冰箱中冷藏保存。
采回水样后立即经0.8 μm滤膜粗过滤,收集滤后滤液再经0.22 μm纤维滤膜过滤,收集0.22 μm的滤膜将其剪成小份,投入100 mL牛肉膏蛋白胨液体培养基中。放入150 r·min-1摇床中30 ℃培养24 h至混浊,按照接种量10%取l mL菌液与9 mL供试藻液共同培养。设置CK对照,CK不加菌液,加等体积BG11培养基,置于25 ℃的培养箱中培养,使藻液黄化的菌株为溶藻菌,编号SLW6,保种备用。将所得的菌以分区划线法接种在牛肉膏蛋白胨固体培养基上30 ℃培养48 h后,观察菌落形态,记录结果。并对溶藻菌进行革兰氏染色,甲基红(M.R)试验,V-P试验,3%~10%过氧化氢试验,明胶液化试验,糖酵解试验,硝酸盐还原试验[9]。
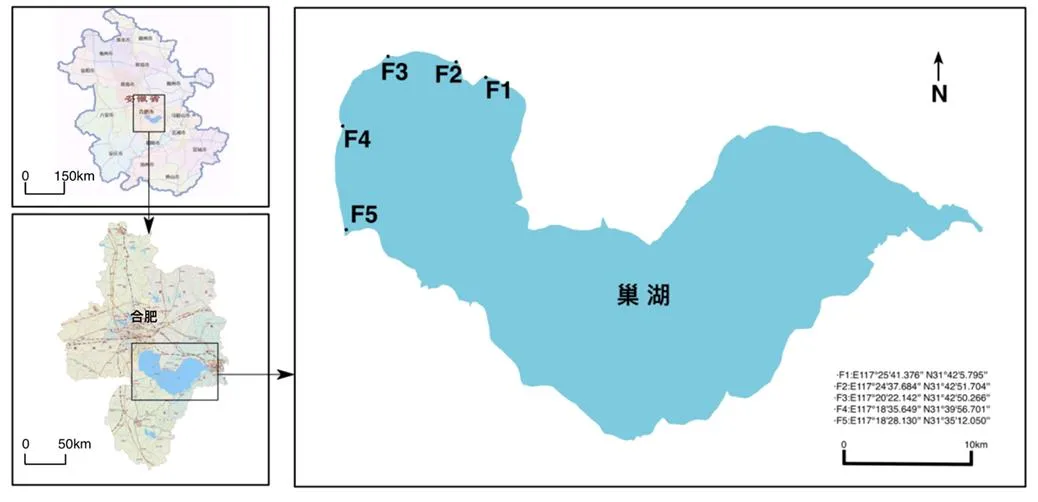
图1 巢湖采样点分布图
Figure 1 Distribution map of Chaohu Lake sampling point
实验采用1%琼脂糖凝胶电泳检测,用TaKaRa试剂盒提取总基因组DNA,EB染色,5 µL上样,用凝胶成像系统观察电泳结果并拍照。DNA样品置于-20 ℃长期保存。PCR扩增产物回收以细菌的16S rDNA通用引物对细菌基因组进行PCR扩增[10],其中上游引物为5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物为5′-ACGGCTACCTTGTTACGACTT-3′,扩增条件:94 ℃条件预变性5 min;94 ℃下30 s,55 ℃下30 s,72 ℃下2 min,30个循环;72环;延伸10 min。PCR扩增得到的目的片段经电泳分离后,紫外灯下切割收集长度为1 500 bp左右的目的条带,经Axygene胶回收试剂盒纯化后,送上海生物工程有限公司测序,PCR产物用PCR引物直接测序[11]。将测得的菌株序列用DNAstar软件编辑后在NCBI中利用Blast软件与GenBank中已知的16S rDNA序列进行同源性比较,确定菌株的种属。
1.2.2 溶藻菌株和水华鱼腥藻生长曲线的测定 菌悬液的浓度与吸光度(OD600值)成线性正比,对菌悬液光密度定性分析菌液浓度,并以所测光度值OD600值为纵坐标,培养时间为横坐标,绘制菌株在特定环境下的生长曲线[12]。通过分光光度计测定水华鱼腥藻在680 nm波长下的吸光度,判断水华鱼腥藻的生长状况。隔天测一次吸光值,直到水华鱼腥藻开始死亡为止。
1.2.3 溶藻菌株溶藻机理初步研究 培养SLW菌株至对数生长期,分别取10 mL原菌液、溶藻菌胞外分泌液(溶藻菌培养液经8 000 r·min-1,4 ℃离心5 min,取上清液)、菌体悬液(溶藻菌培养液经8 000 r·min-1,4 ℃离心5 min,弃去上清液,用牛肉膏蛋白胨液体培养基定容至10 mL,使菌体重新悬浮)、灭菌(121 ℃,0.1 MPa,20 min)处理后的原菌液、超声(100 W,10 min)破碎后的原菌液,加入到90 mL预培养一周的水华鱼腥藻藻液中,进行溶藻实验。设置空白对照,对照组不加菌液,加等体积的BGll培养基,各组分别设置3个平行样。培养条件:温度25 ℃,光暗比为12 h∶12 h。测定藻液明显黄化时的绿素a含量,并计算溶藻率。
1)藻类叶绿素a含量的测定。超声辅助热乙醇提取叶绿素a,分光光度法测定叶绿素a含量[13],取水华鱼腥藻的藻液10 mL过0.45 L藻的混合纤维素膜,将带藻细胞的膜冷冻过夜,取出后迅速用8 mL热乙醇于热水浴中萃取2 min,将萃取液超声破碎10 min后,于暗处静置4 h,离心(5 000 r·min-1,4 000 r·min-1)碎取藻后取上清液3.5 mL置于比色皿中,分别于665 nm和750 nm处测吸光值,滴加200光值的1 mol·L-1盐酸酸化,5 min后于波长665 nm和750 nm处再测吸光值。
酸化前测定的光密度值用D665b、D750b表示,酸化后测定的光密度值用D665a、D750a表示。则
665b=665b-750b(1)
665a=665a-750a(2)
根据Lorenzen公式计算单位样品中叶绿素a含量:
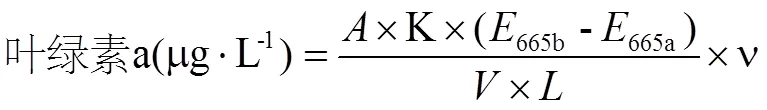
其中,为不同萃取溶剂中叶绿素a的比吸光系数;K为常数,为纯叶绿素a酸化前的光密度与酸化前后的光密度变化的比值;υ为提取液体积(mL);为样品的体积(L);为比色杯光程长度(cm)。
用热乙醇萃取,=11.5,=2.43,比色皿光程为1cm,简化Lorenzen公式得:

2)溶藻效果的判断—溶藻率。用叶绿素a含量来对藻的灭杀效果来进行衡量。采用溶藻率来评价溶藻效果,详见式(5)。

其中,为对照组的叶绿素a浓度,处理组为处理组的叶绿素a浓度。
1.2.4 溶藻菌株溶藻特性研究 菌种及培养基:菌株从富营养化水体中筛选获得。菌种用牛肉膏蛋白胨斜面培养基于4 ℃冷藏保存。定容后将pH调至7.2~7.6。取斜面保存的菌株,以无菌操作方式各挑取1环菌苔,接入装有100 mL牛肉膏蛋白胨液体培养基的三角瓶中培养制成种子液,取1 mL种子液接入装有牛肉膏蛋白胨培养基的三角瓶中,置于30 ℃,150 r·min-1摇床培养12 h。
1)不同生长期的溶藻菌对水华鱼腥藻的溶藻效果。在牛肉膏蛋白胨液体培养基中接入菌株种子培养液,接种量为1 %,30 ℃,150 r·min-1摇床培养,定时取样。由菌株的生长曲线,设定=1、4、48和72 h,分别代表溶藻菌生长的停滞期、对数期、稳定期和衰亡期,取各个时期的菌液10 mL加入到90 mL预培养一周的水华鱼腥藻藻液中,进行溶藻实验。设置空白对照,对照组不加菌液,加等体积的BGll培养基,各组分别设置3个平行样。培养条件:温度25 ℃,光暗比为12 h∶12 h。测定每天藻液的叶绿素a含量,并算溶藻率。
2)不同pH值对溶藻菌溶藻效果的影响。将牛肉膏蛋白胨液体培养基调整为5个不同pH值,研究溶藻菌在不同pH值条件下对水华鱼腥藻的溶藻效果。5个不同pH值分别为:5.0、6.0、7.0、8.0和9.0,各取培养至对数生长期的溶藻菌菌液10 mL加入到90 mL预培养一周的水华鱼腥藻藻液中,进行溶藻实验。设置空白对照,对照组不加菌液,加等体积的BGll培养基,各组分别设置3个平行样。培养条件:温度25 ℃,光暗比为12 h∶12 h。测定每天藻液的叶绿素a含量,并计算溶藻率。
2 结果与分析
2.1 溶藻细菌的分离鉴定
2.1.1 溶藻菌株的分离 经过初筛得到共20株形态大小各异的单菌落,再经过复筛,都有明显的溶藻效果,其中SLW6黄化最为显著,则菌株SLW6溶藻效果较好,对其鉴定并研究其溶藻方式和溶藻特性。
2.1.2 菌株SLW6的形态特征 通过观察菌株SLW6在牛肉膏蛋白胨固体培养基上的表型特征:菌株SLW6的菌落呈乳白色,菌落小,圆形,凸起,边缘规则,表面光滑。革兰氏染色结果为阴性菌。甲基红(M.R)试验结果、明胶液化试验结果、V-P试验结果均为阴性。过氧化氢试验结果、硝酸盐还原试验均为阳性。糖酵解实验中SLW6菌株几乎没有分解糖类产酸。
2.1.3 菌株SLW6的16S rDNA分子鉴定 提取的菌株SLW6的总基因组DNA大小约为23 kb。电泳结果可见,扩增得到的目的片段长约为1 500 bp左右,如图2所示。

图2 16S rDNA基因PCR扩增产物
Figure 2 PCR amplification of 16S rDNA
菌株SLW6的16S rDNA为1 463 bp,将SLW6的16S rDNA序列(GenBank中的登录号为OP363821)与GenBank中已知16S rDNA序列进行Blast比对,构建系统发育树,如图3所示,菌株SLW6与产碱杆菌属的(NR113606.1)的同源性达到99.65%。查阅《常见细菌系统鉴定手册》[14],初步确定菌株SLW6为产碱菌属。

图3 菌株SLW6基因组系统发育树
Figure 3 Phylogenetic tree of strain SLW6 genome
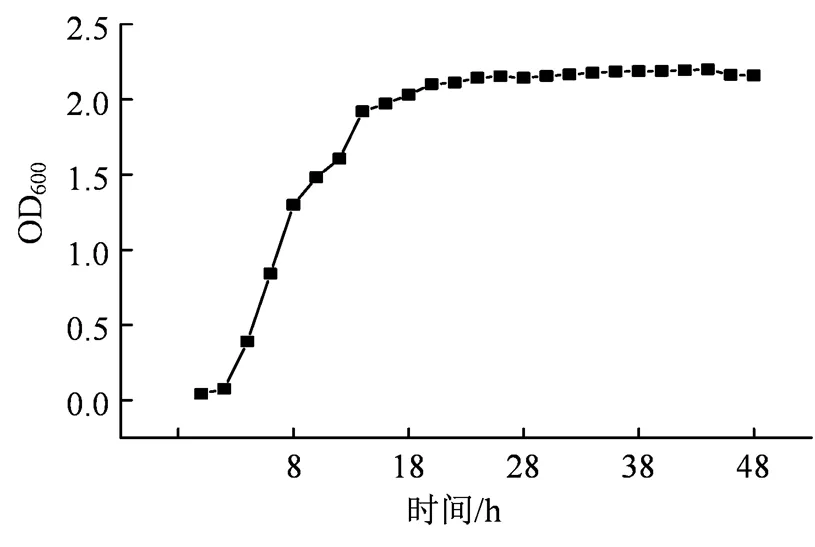
图4 溶藻菌SLW6的生长曲线
Figure 4 Growth curve of SLW6

图5 水华鱼腥藻的生长曲线
Figure 5 Growth curve of
2.2 溶藻菌株SLW6的生长曲线
溶藻菌的生长引起培养物混浊度的增高,菌悬液的浓度与吸光度(OD600值)成线性正比,对菌悬液的光密度定性分析菌液的浓度,在600 nm波长下测得溶藻菌的生长曲线值[15],绘制出菌株在特定环境下的生长曲线(图4),菌株SLW6在0~4 h处于停滞期,4~16 h处于对数生长期,16~48 h处于稳定期,48 h后进入衰亡期细菌生长速率大,浓度增长快。
绘制水华鱼腥藻的生长曲线(图5)显示,水华鱼腥藻在0 d处于停滞期,1~6 d处于对生长期,6~13 d处于稳定期,13 d后进入衰亡期。
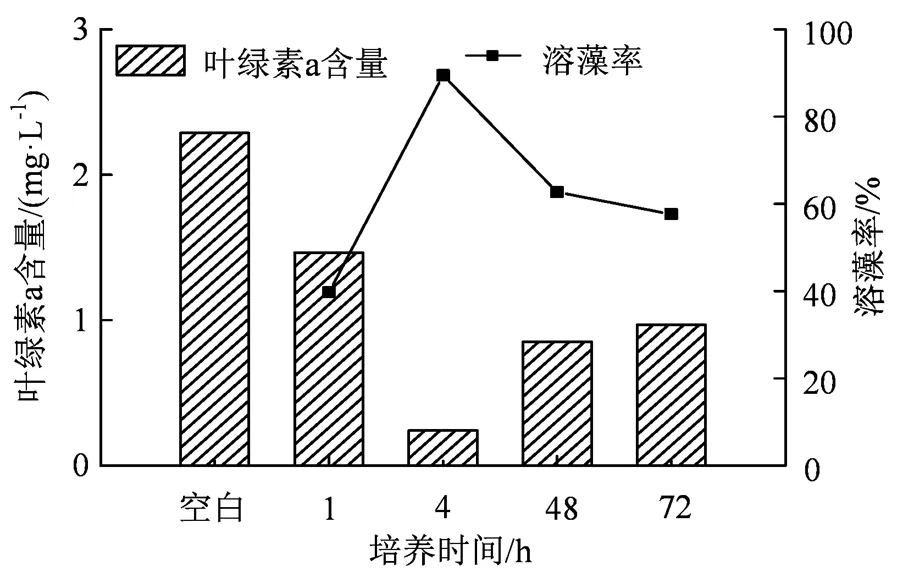
图6 不同生长期的溶藻菌SLW6溶藻效果
Figure 6 Algicidal effects of the strain SLW6 on different training periods

图7 不同pH值时溶藻菌SLW6的溶藻率
Figure 7 Algicidal effects of the strain SLW6 with different pH values
2.3 菌株SLW6的溶藻特性研究
2.3.1不同生长期的溶藻菌对水华鱼腥藻的溶藻效果 根据菌株的生长曲线,选取处于停滞期、对数期、稳定期和衰亡期的菌液与藻液共培养,探究其不同时期的溶藻效果[16],结果如图6所示。由上述简化Lorenzen公式4可知藻液初始叶绿素a含量为2.286 mg·L-1,培养1 h后到停滞期,对照组叶绿素a含量下降到1.464 7 mg·L-1,溶藻率为39.77 %。4 h后的对数期叶绿素a含量下降至0.241 2 mg·L-1,溶藻率为89.45 %,48 h后的稳定期叶绿素a含量升至0.852 4 mg·L-1,溶藻率为62.71 %;72 h后的衰亡期叶绿素a含量升至0.968 6 mg·L-1,溶藻率为57.63%。上述结果表明对数期的溶藻菌的溶藻效果最优,溶藻率为89.45%,停滞期的溶藻率最低,为39.77%。
2.3.2 不同pH值对溶藻菌溶藻效果的影响 将牛肉膏蛋白胨液体培养基调整为5个不同pH值,研究溶藻菌在不同pH值条件下对水华鱼腥藻的溶藻效果。如图7所示,5个不同pH值分别为:5.0、6.0、7.0、8.0和9.0。得出的结论为:pH为7的溶藻菌的溶藻效果最优,溶藻率为47.03%;其次在pH=5的条件下,溶藻率为40.89%,pH为6时的溶藻率为23.78%,pH为9时的溶藻率为18.48%;pH为8的时候溶藻效果最差,为2.89%。酸性条件下的溶藻效果要高于碱性条件下的溶藻效果,按效果排序可为:pH=7>pH=5>pH=6>pH=9> pH=8。
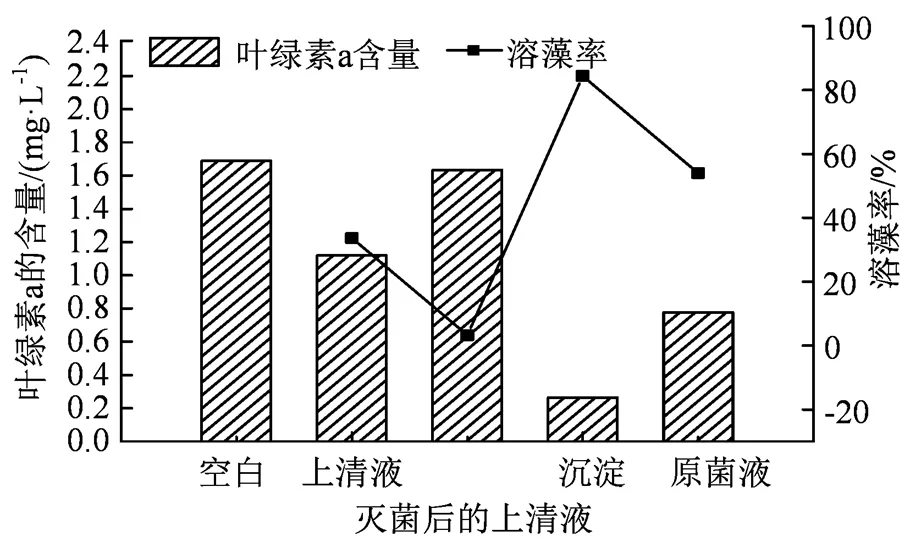
图8 溶藻菌SLW6的溶藻方式
Figure 8 The algae-soluble mode of algolytic bacteria SLW6
2.4 溶藻菌的溶藻方式研究
经过溶藻实验得出结果如图8所示:沉淀中的菌体悬液与原菌液的溶藻率分别为84.36%和54%,表明菌体本身对藻有较好的溶藻效果。上清液(胞外分泌液)溶藻率为33.65%,通过释放的胞外物质达到部分溶藻效果,而高温高压灭菌之后的上清液几乎没有溶藻效果,溶藻率仅为3.21%,故可判断溶藻菌SLW6以直接溶藻为主间接溶藻为辅。
3 讨论
目前对溶藻菌的研究报道中,基本上都以溶藻菌分泌溶藻物质等间接溶藻方式为主。范德朋等[17]发现,溶藻菌株BWFA55通过分泌溶藻化合物间接攻击水华鱼腥藻,使丝状群体的藻细胞数量明显降低,群体连接结构被破坏达到溶藻效果;李三华 等[18]在鱼腥藻中加入不动杆菌菌株A01可分泌能有效溶解鱼腥藻的活性物质来裂解藻细胞。为了开发微生物控藻技术,赵薇等[19]分离了不同具有溶藻活力的细菌,其中YTD5菌株-新鞘氨醇杆菌的溶藻作用最为明显,以间接溶藻为主,溶藻能力大于90%。本实验所研究的溶藻菌以直接溶藻为主,通过直接作用完成裂解藻细胞,表明菌株SLW6对水华鱼腥藻藻华爆发有较高的应用前景。
菌株SLW6为革兰氏阴性菌这同大多数研究所发现的溶藻菌均为革兰氏阴性菌相一致。李敏等[20]分离筛选出一株异养硫氧化细菌,为粪产碱杆菌,不能发酵糖类。在进行糖酵解实验时,葡萄糖开管中一支变黄可能受到了污染、麦芽糖和蔗糖均无明现象,更加确定产碱菌通常无法利用糖类的性质[21]。
对数期的溶藻菌SLW6的溶藻效果最好,溶藻率为89.45%,pH为7时的溶藻效果最好,溶藻率为47.03%,这与王佳等[22]的实验结果相接近。
4 结论
1)将菌株SLW6的16S rDNA序列与GenBank中已知16S rDNA序列进行Blast比对,可以确定SLW6菌株为产碱菌属。
2)对SLW6生长曲线的结果和实验数据的处理,表明在对数期SLW6菌液表现出最佳溶藻活性。
3)沉淀的菌体悬液溶藻效果最佳,溶藻率86.9%,溶藻菌SLW6主要是以直接溶藻的方式溶藻。
[1] 程新,李昆太,黄林.一株枯草芽孢杆菌的生长特性及抑藻效果研究[J].生物技术通报,2017,33(7):120-125.
[2] 王素钦,罗丛强,朱晓漫,等.高效溶藻放线菌LW9的分离鉴定及其溶藻特性[J].武汉大学学报(理学版), 2021, 67(1): 93-102.
[3] ZHANG Q Y, GUI J F. Diversity, evolutionary contribution and ecological roles of aquatic viruses[J]. Sci China Life Sci, 2018, 61(12): 1486-1502.
[4] SHILO M.of blue-green algae by myxobacter[J]. J Bacteriol, 1970, 104(1): 453-461.
[5] IMAI I, ISHIDA Y, HATA Y. Killing of marine phytoplankton by a gliding bacteriumsp, isolated from the coastal sea of Japan[J]. Mar Biol, 1993, 116(4): 527-532.
[6] IMAI I, ISHIDA Y, SAKAGUCHI K, et al. Algicidal marine bacteria isolated from northern Hiroshima Bay, Japan[J]. Fish Sci, 1995, 61(4): 628-636.
[7] MEYER N, BIGALKE A, KAULFUß A, et al. Strategies and ecological roles of algicidal bacteria[J]. FEMS Microbiol Rev, 2017, 41(6): 880-899..
[8] 薛静静, 王美娟, 毛林强, 等. 一株具有溶藻功能的sp. XXG的分离鉴定及溶藻特性研究[J]. 过程工程学报, 2020, 20(9): 1097-1105.
[9] 贺亚斐, 张来星, 曹子敬, 等. 1株二氯喹啉酸降解菌的分离、鉴定及降解特性研究[J]. 河南农业大学学报, 2020, 54(4):657-663.
[10] 高兆建, 王秋芬, 丁飞鸿, 等. 广谱拮抗菌株的筛选诱变及抗菌物质分离鉴定[J]. 食品科学, 2021, 42(2): 143-150.
[11] 刘攀龙, 于鲁冀, 李廷梅, 等. 污染河流土著异养硝化菌的筛选及其鉴定[J]. 生物技术通报, 2017, 33(10): 178-183.
[12] 卢婧, 余志晟, 张洪勋. 东方伊萨酵母菌对偶氮染料酸性大红GR的脱色优化及特性研究[J]. 安徽农业科学, 2014, 42(8): 2233-2236.
[13] 梁兴飞, 郭宗楼. 超声辅助热乙醇提取法测定浮游植物叶绿素a的方法优化[J]. 水生生物学报, 2010, 34(4): 856-861.
[14] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
[15] 胡钟师. H6-3枯草芽孢杆菌的分离、生物学特性、培养条件的优化及临床应用的研究[D]. 雅安: 四川农业大学, 2009.
[16] 张嗣萍, 贾楠楠, 王红兵, 等. 一株新型鱼腥藻溶藻细菌的分离鉴定及其溶藻特性[J]. 湖泊科学, 2018, 30(5): 1343-1350.
[17] 范德朋, 胡亚冬, 杨敏志, 等. 鱼腥藻藻华水体一株溶藻菌BWFA55的鉴定及溶藻特性[J]. 广东海洋大学学报, 2021, 41(6): 9-17.
[18] 李三华, 张奇亚. 1株溶藻菌的部分生物学特性及溶鱼腥藻作用[J]. 环境科学, 2013, 34(2):583-588.
[19] 赵薇, 许彤骏, 王喻元, 等. 溶藻细菌的筛选及群体感应信号对其活力的调节作用[J]. 生物加工过程, 2023, 21(4): 461-470.
[20] 李敏, 王琦, 魏菁, 等. 粪产碱杆菌的分离鉴定及其生物转化作用[J]. 微生物学通报, 2021, 48(10): 3612- 3620.
[21] 张嗣萍, 贾楠楠, 王红兵, 等. 一株新型鱼腥藻溶藻细菌的分离鉴定及其溶藻特性[J]. 湖泊科学, 2018, 30(5): 169-176.
[22] 王佳, 洪桂云, 张瑾. 一株铜绿微囊藻溶藻菌的分离鉴定和溶藻特性[J]. 安徽农业大学学报, 2016, 43(5): 768-773.
Isolation and characterization of algae-solubilizing bacteria from a waterwash strain of cichlidium ichneumoniae
HONG Guiyun, HUANG Junfeng, ZHU Yu'ni, ZHU Shuguang
(College of Environment and Energy Engineering, Anhui Jianzhu University, Engineering Research Center of Building Energy Efficiency Control and Evaluation, Ministry of Education, Anhui Province, Hefei 230601)
The algolytic strain SLW6 was screened from water and soil samples from different sources,which has the effect of algicidal activity on. The morphological characteristics, physiological and biochemical identification and 16S rDNA sequence analysis of strain SLW6 were carried out. The effects of algaeclytic bacteria on algaeclytic effect of strain SLW6 in different culture periods and pH conditions were studied. The pattern of dissolvingby the strain was explored. The results showed that: strain SLW6 was a Gram-negative bacterium, negative in V-P test, gelatin liquefaction test and methyl red test, while positive in hydrogen peroxide test and nitrate reduction test; the homology between SLW6 strain and(NR113606.1) strain was 99.65%; combined with morphological characteristics, physiological and biochemical identification and 16S rDNA sequence analysis, it was preliminarily determined that the algae lytic strain SLW6 was an alkali producing bacterium (GenBank accession number, OP363821).Ultrasound assisted hot ethanol extraction of the chlorophyll a, determination of chlorophyll a content by spectrophotometry, and calculation of the algal dissolution rate based on the change of chlorophyll a content, the results showed that SLW6 had the best algae dissolving effect when it was in the logarithmic phase, and the algae dissolving rate was 89.45%; when pH was 7, the effect of algae dissolution was better, and the algae dissolution rate was 47.03%; the mode of action of alginolytic bacteria SLW6 onwas that the direct alginolytic activity is dominant and the indirect alginolytic activity is secondary.
algicidalbacteria;; separation and identification; alginolytic characteristics; algicidal mode
X52
A
1672-352X (2023)05-0881-06
10.13610/j.cnki.1672-352x.20231030.022
2023-10-31 09:50:39
[URL] https://link.cnki.net/urlid/34.1162.S.20231030.1112.042
2022-09-07
安徽省自然科学基金(No.1908085141ME)和校级教研项目(No.2021jy27)共同资助。
洪桂云,博士,副教授。E-mail:honggy@ahjzu.edu.cn
