茶树CsC7蛋白异源表达及抗真菌活性分析
2023-11-22姜看文赵懿琛陆莹霞
曹 瑞, 姜看文, 赵懿琛,2, 陆莹霞, 彭 磊, 董 旋,2
(1.贵州大学茶学院, 贵阳 550025;2.山地植物资源保护与种质创新省部共建教育部重点实验室, 贵阳 550025)
茶树(Camelliasinensis)起源于中国西南部,是一种全球广泛种植的经济作物。茶与咖啡、可可并称为三大无酒精饮料,具有极高的经济价值[1]。因为茶树主要生长于热带、亚热带和温带,且生性喜湿热,所以在生长过程中不可避免地遭受外来因素的影响。而茶树病害是对茶树生产造成不良影响的重要因素之一,特别是我国作为全球最大的茶叶生产国[2],因为高密度种植和农药的滥用,已导致茶树病害频繁发生,每年导致茶叶产量损失达10%~20%[3]。当前茶树的病害主要采用化学药剂进行防治,但这种方法容易影响茶叶的品质,并且一些残留的化学药剂很容易造成食品安全隐患,同时也不利于茶叶进出口贸易的发展,为解决这些问题,开发植物免疫激活剂、杀菌剂和杀虫剂等高效低毒及环境友好的绿色农药,以推动茶产业向绿色健康发展。
几丁质酶是一种重要的植物病程相关蛋白。几丁质酶在植物中的抗真菌作用已在许多研究中得到证实[4-7],过表达几丁质酶编码基因的转基因植物对真菌和细菌病原体的抗性增强[8-11]。一些植物几丁质酶分别通过对几丁质和肽聚糖的裂解作用(溶菌酶作用)参与植物防御真菌和细菌病原体的机制[12-13],并显示出对几种植物病原真菌的体外抗真菌特性,单独或与其他病程相关蛋白协同抑制孢子萌发和菌丝生长[14-16]。几丁质酶在生物技术应用中具有巨大的潜力,例如在制备具有药学重要性的甲壳低聚糖和N-乙酰基D-葡萄糖胺方面,是有前途的抗菌剂、溶菌酶诱导剂和免疫增强剂;开发害虫和病原体以及抗病转基因植物的生物控制剂[17-18]。
迄今为止,来自不同物种的几丁质酶已经在大肠杆菌BL21[19]和毕赤酵母[20]中表达。研究人员正在努力使用毕赤酵母等异源表达系统来增加几丁质酶的表达水平[21]。毕赤酵母是第二大蛋白表达系统,由于巴斯德毕赤酵母AOX1启动子强且受严格调控,因此适合高水平表达目的蛋白。此外,目的蛋白将被有效地分泌到细胞外,简化了后续的纯化过程。最后,巴斯德毕赤酵母可用于大规模高密度发酵。数千种蛋白质已在毕赤酵母中成功表达,它是生产重组蛋白的常用表达系统,在毕赤酵母中表达为重组酶的几丁质酶可以作为糖基化或糖基化变体生产[22-23]。
基于本实验室前期研究,不同抗性的茶树品种在接种茶饼病病原菌(坏损外担菌)后,茶树几丁质酶编码基因(CsC7)相对表达量显著提高。因此,本研究拟通过毕赤酵母表达系统来表达茶树CsC7蛋白,同时对该蛋白做抑菌活性分析,以期获得有效的CsC7蛋白抑制剂,为研发防治茶树真菌病害的绿色农药提供理论依据,同时为抗真菌病害茶树品种的选育提供理论支撑。
1 材料与方法
1.1 植物材料、菌株、质粒和试剂
“梅占”(编号GS13004—1985)采自安顺市农业科学研究院;质粒pPICZαA、毕赤酵母X-33菌株、大肠杆菌(Escherichiacolistrain)DH5α购于北京擎科生物科技有限公司。尖孢镰刀菌(Fusariumoxysporum)、厚孢镰刀菌(Fusariumchlamydosporum)、灰霉菌(Botrytiscinerea)、白桦茸担子菌(Inonotusobliquus)、脆弱毛霉菌(Mucorfragilis)、枯叶格孢腔菌(Pleosporaherbarum)、赤星菌(Alternariaalternata)均来自贵州大学茶学院茶生物技术实验室分离保存的菌种。
1.2 基因克隆
称取“梅占”健康顶芽100 mg,加入液氮充分研磨至无成块的植物组织。使用植物RNA提取试剂盒(DNase I) (ComWin Biotech,Jiangsu) 根据说明书提取总RNA,RNA 的质量用Nano Drop仪进行检测,使用GoldenstarTMRT6 cDNA Synthesis Kit (Tsingke Biotechnology, Beijing) 从5 μg总RNA中获得第一链cDNA。基于云抗10号茶树的基因组数据的CsC7序列(登录号:TEA002526.1),使用DNAMAN-8软件设计CsC7基因的特异性引物F1:ATGTCTCCAAAACAACCTCATTC和R1:TCAAACATTG CTCTTAATGCTAG,用于以cDNA为模板进行目的基因的克隆。使用ExTaqTM聚合酶混合物(Takara Biomedical Technology,Beijing)在含有21.5 μL ddH2O、1.5 μL第一链cDNA、基因特异性引物 (CsC7-F1、CsC7-R1)各1 μL (20 μmol/L)和25 μL ExTaq聚合酶混合物的反应混合物中进行聚合酶链反应(PCR)。PCR程序设置为98 ℃下持续10 s,55 ℃持续30 s 和72 ℃ 3 min。PCR产物在1.0%琼脂糖/GelRed凝胶上检测,并使用EZNA凝胶提取试剂盒(Omega Bio-Tek,Norcross,USA)纯化相应的DNA条带。该产物与pGEM-T Easy Vector((Promega Corporation,Madison,USA)连接,在大肠杆菌DH5α中扩增并进行测序。使用Serial Cloner 1-3进行序列分析,以确定CsC7序列。所有引物均由擎科生物科技公司重庆分公司合成。
1.3 CsC7蛋白生物信息学分析
使用SignalP (http://www.cbs.dtu.dk/services/SignalP/)预测信号肽、NetNGlyc (http://www.cbs.dtu.dk/services/NetNGlyc/)预测糖基化位点、TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)预测跨膜结构域,使用在线网站ProtParam(https://web.expasy.org/protparam/)预测蛋白质理化性质,使用ProtScale(http://web.expasy.org/ProScale)预测蛋白质的疏水性。
1.4 密码子优化及pPICZαA-CsC7质粒的构建
通过对CsC7进行生物信息学分析,需将CsC7蛋白所含信号肽切除,即去掉前27个氨基酸,根据巴斯德毕赤酵母的密码子偏好性(http://www.kazusa.or.jp/codon)对重组蛋白基因进行密码子优化,避开SacI酶切位点,用巴斯德毕赤酵母中的高频密码子替换CsC7中的相应密码子;基因合成至 pPICZαA,目的基因紧挨着载体α-factor,C端带上6个氨基酸His标签(CTCGAGAAAAGACACATCATCATCATCAT)。将所得重组表达质粒pPICZαA-CsC7最终转化为大肠杆菌E.coliDH5α,并在含有25 μg/mL博莱霉素的LB琼脂平板上37 ℃培养16 h。首先使用设计的引物pPICZα-F:GACTGGTTCCAATTGACAAGC和pPICZα-R:GCAAATGGCATTCTGACATCC通过PCR鉴定阳性pPICZαA-CsC7质粒克隆,并测序确认阳性质粒,然后进一步转化毕赤酵母X-33。
1.5 毕赤酵母转化及蛋白表达纯化
构建的pPICZαA-CsC7质粒通过SacI线性化,并通过电穿孔法 (GenePulser,Bio-Rad,USA)转入毕赤酵母 X-33细胞[24]。在含有100 mg/L 博莱霉素的YPD(1%酵母提取物、2%蛋白胨、2%葡萄糖、2%琼脂)平板上选择转化的单菌落进行菌落PCR并测序鉴定后挑选7个阳性转化子表达小试,将最优表达转化子命名为CsC7-6。
250 mL 锥形瓶中加入 50 mL YPG 培养基(1%酵母提取物、2%蛋白胨、3%乙醇和3%甘油),接入最优表达转化子CsC7-6,30 ℃ 220 r/min培养至菌液饱和; 转移到50 mL 离心管中,4 000 r/min离心5 min,弃上清; 用50 mL BMMY 培养基(1%酵母提取物,2%蛋白胨,100 mmol/L磷酸钾,pH=6.0,1.34% YNB(不含氨基酸的酵母氮碱),0.005%生物素和0.5%甲醇)重悬菌体,转移至新的250 mL无菌锥形瓶中,加入甲醇至终浓度0.5%(V/V),28 ℃ 220 r/min培养6 d;为了诱导目标蛋白的表达,每24 h加入100%甲醇至终浓度为0.75%; 第6天上午收集菌液,4 000 r/min离心5 min,收集上清。
30 mL 的重力柱中填装 5 mL Ni-NTA beads;用5 mL Lysis buffer(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L imidazole,pH=8.0,过滤除菌) 平衡柱子,重复 3 次; 50 mL 蛋白溶液分两次过柱;加入10 mL Wash buffer (50 mmol/L NaH2PO4,300 mmol/L NaCl,20 mmol/L imidazole,pH=8.0,过滤除菌)进行洗杂,重复5次;加入5 mL Elution buffer (50 mmol/L NaH2PO4,300 mmol/L NaCl,250 mmol/L imidazole,pH=8.0,过滤除菌)洗脱,即得到纯化后蛋白并储存在-80 ℃进行进一步分析。用 Western Blot 检测,蛋白质浓度用BCA蛋白质试剂盒(中国南京建成生物工程研究所有限公司)测定。
1.6 抗真菌活性测定
酵母纯化蛋白按照体积比1∶1与PDA培养基混匀后倒入培养皿(直径9 cm)中,以不加入外源试剂PDA培养基为对照。
将尖孢镰刀菌、厚孢镰刀菌、灰霉菌、白桦茸担子菌、脆弱毛霉菌、枯叶格孢腔菌、赤星菌接种在PDA培养基上,25 ℃恒温倒置暗培养7 d。用无菌打孔器取菌斑边缘6 mm菌饼,接种于混有目的蛋白的PDA培养基中心位置,25 ℃恒温倒置暗培养,每组试验重复3次。
采用“十字交叉法”测量菌落直径并拍照记录,根据生长抑制率公式[25]计算生长抑菌率。
抑菌率/%=[(对照组病原菌的直径-处理组病原菌直径)/对照组病原菌直径]×100%。
2 结果与分析
2.1 CsC7生物信息学分析
对CsC7编码的蛋白质理化性质预测,结果显示,该蛋白的分子式为C1463H2226N386O436S9,分子量为32 486.63 kD,等电点为8.42,不稳定指数为41.41,总平均疏水指数为-0.140,脂肪族指数为80.86;用TMHMM Server v2.0软件预测目标蛋白跨膜结构域,如图1所示,目标蛋白N端和C端都在细胞膜外部,因此CsC7蛋白不含跨膜结构。
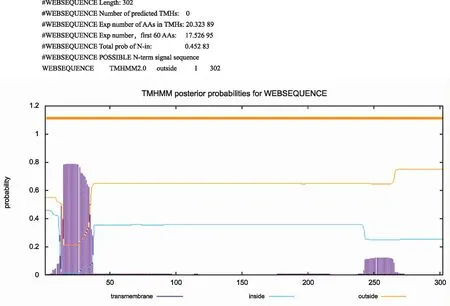
图1 跨膜结构域预测
应用在线网站NetNGlyc预测目标蛋白的糖基化位点数目,如图2所示,目标蛋白可能含有1个糖基化位点,推测毕赤酵母工程菌分泌表达的CsC7蛋白分子量可能与预测的蛋白分子量有偏差。

图2 糖基化位点预测
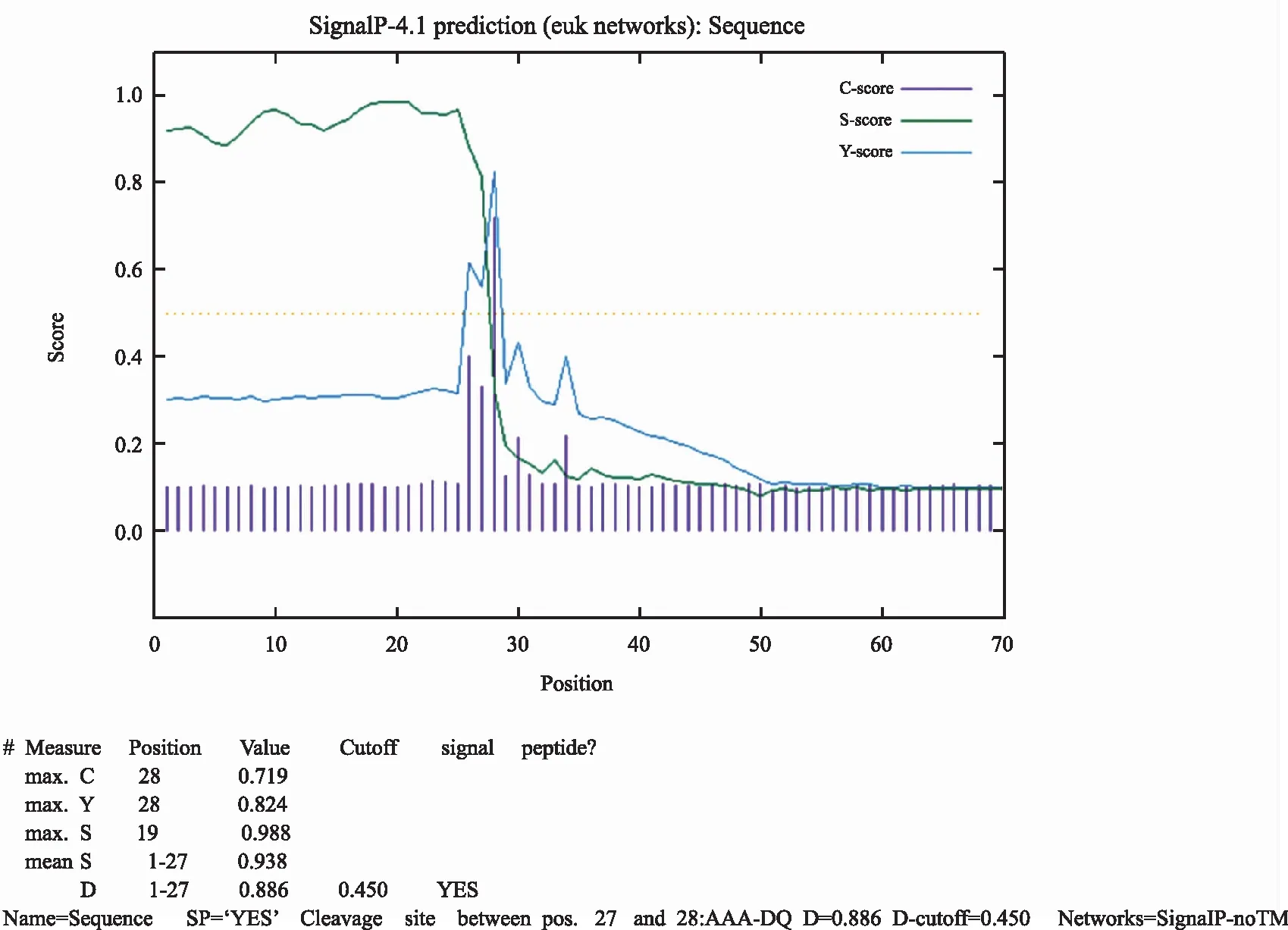
图3 信号肽预测
使用SignaIP信号肽预测工具预测目标蛋白的信号肽。结果显示,目标蛋白含有1个信号肽,由于毕赤酵母表达载体自身含有1个α-分泌信号肽,因此要将目的蛋白的信号肽切除,即去掉前27个氨基酸。
2.2 CsC7基因密码子优化及载体构建
本研究在去掉CsC7自身具有的信号肽后,不改变CsC7蛋白氨基酸序列的情况下,根据毕赤酵母密码子偏好性优化了CsC7基因核苷酸序列。具体优化位点所在位置见图4红色部分, 由金斯瑞生物科技有限公司将基因合成至 pPICZαA,目的基因紧挨着载体α-factor,C端带上6个氨基酸His标签,载体示意图如图5所示。
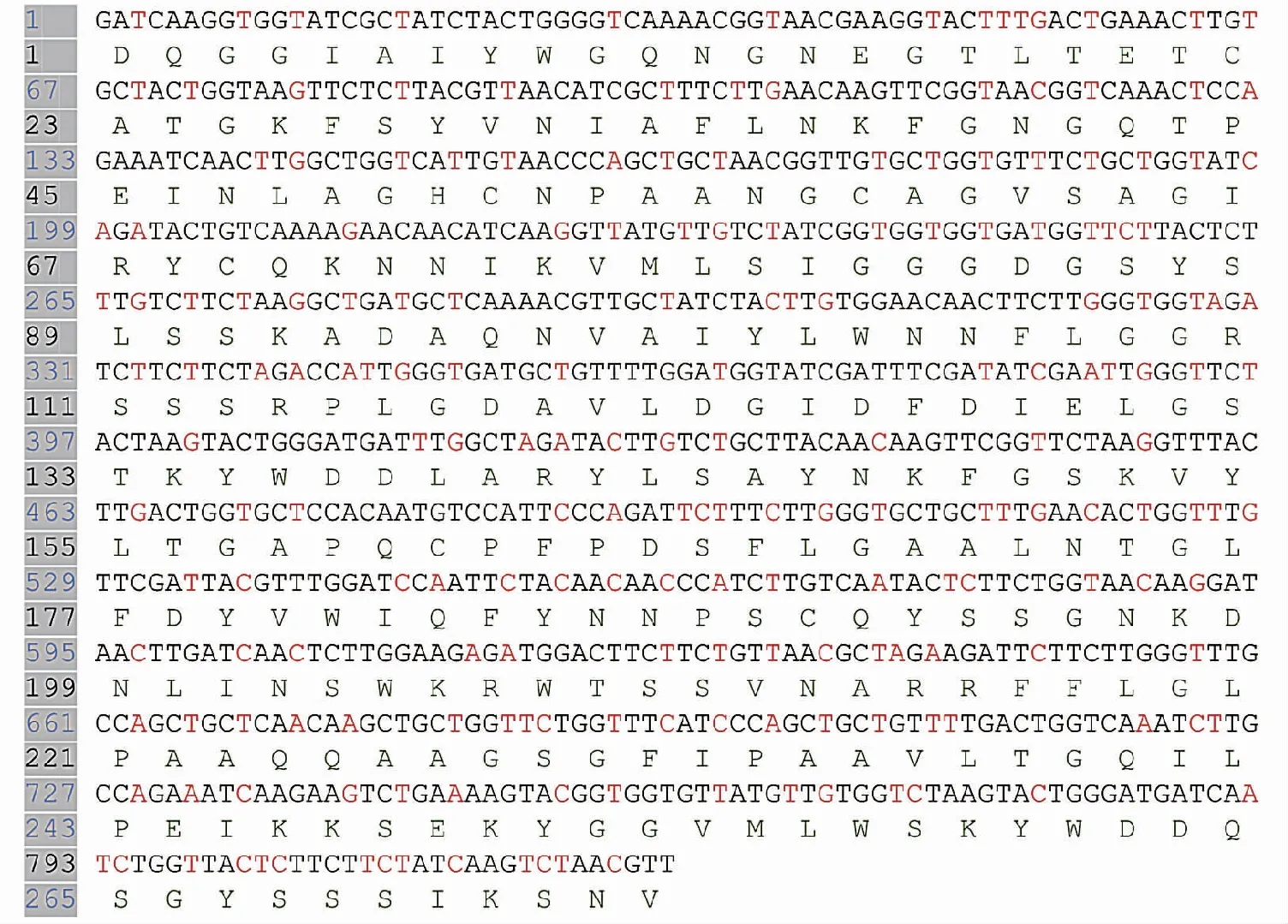
图4 毕赤酵母系统优化后的CsC7基因序列及编码氨基酸序列
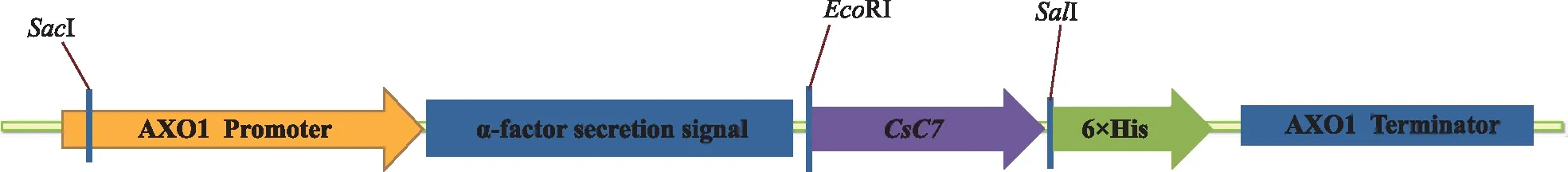
图5 CsC7毕赤酵母表达载体

注:M为DNA Maker(5 000 bp);1为线性化前质粒;2为线性化后质粒。
2.3 酵母工程菌构建及筛选
将构建完成的质粒用限制性内切酶SacI进行线性化,经1%琼脂糖凝胶电泳检测,结果如图4所示,将含有CsC7基因的线性化重组质粒电转入毕赤酵母X-33菌株,经PCR筛选,图7琼脂糖凝胶电泳结果说明,目的基因已整合到酵母染色体中。
注:M为DNA Maker(5 000 bp);1~8为不同克隆转化子。
2.4 毕赤酵母重组蛋白的表达和纯化
将PCR结果为阳性的单克隆菌落转接后,待生长浓度合适时诱导, Western blot检测目的蛋白表达情况,图8检测结果显示蛋白分泌表达,其中6号酵母转化克隆子的蛋白表达效果最好,为了获得大量纯化的目的蛋白,将酵母转化克隆子CsC7-6扩大表达并进行Ni-NTA beads纯化,纯化后用WB检测,结果(图9)表明,蛋白样品纯化成功,未有其他杂带。用BCA法测定其浓度(表1),在标准曲线上(图10)计算出CsC7蛋白样品经过稀释后的蛋白质浓度为62 μg/mL,由稀释倍数计算原CsC7纯化蛋白质浓度为150 μg/mL。
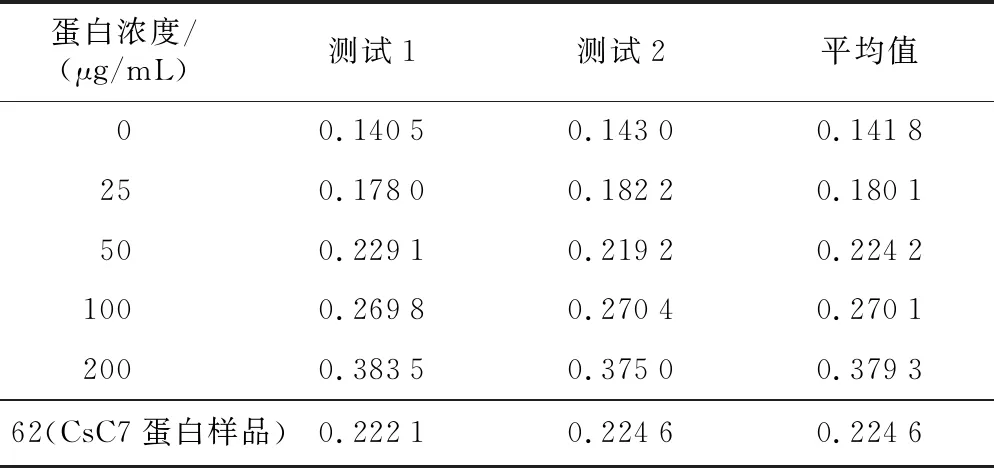
表1 蛋白浓度测定
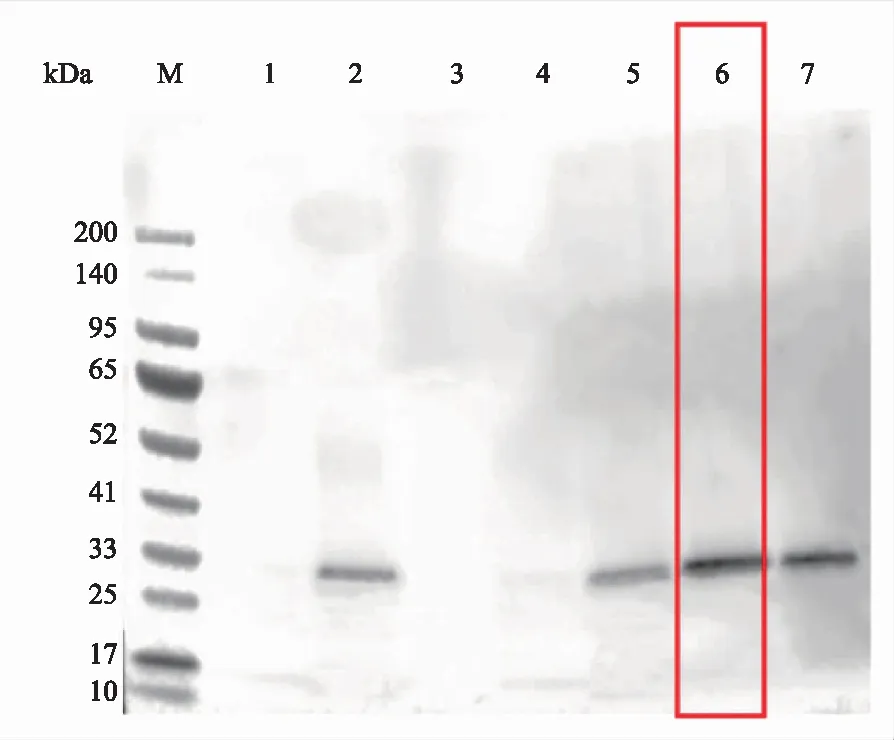
注:M为Protein Marker;1~7为PCR检测为阳性的菌落。其中用红框标注出的6号酵母转化克隆子的蛋白表达效率最高,用于后续蛋白表达。

注: M为Protein Maker;1为流出液;2为纯化蛋白;3为洗杂液;4为阳性对照牛血清蛋白。
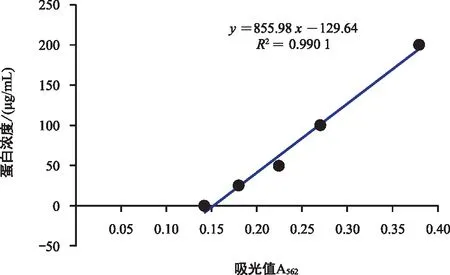
图10 蛋白的标准曲线
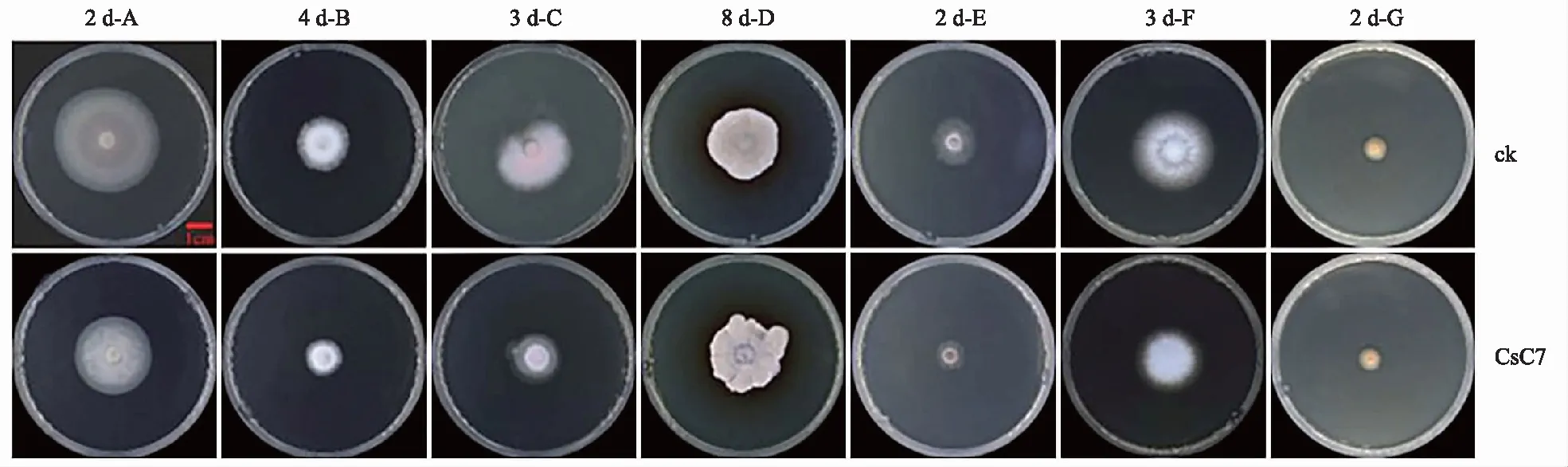
注:A为脆弱毛霉菌;B为白桦茸担子菌;C为尖孢镰刀菌;D为赤星菌;E为灰霉菌;F为厚孢镰刀菌;G为枯叶格孢腔菌。
2.5 CsC7蛋白异源表达及抗真菌活性测定
将脆弱毛霉菌、白桦茸担子菌、尖孢镰刀菌、赤星菌、灰霉菌、厚孢镰刀菌、枯叶格孢腔菌等7种不同真菌分别接种在混有酵母异源表达CsC7纯化蛋白和不加入外源试剂(对照)的PDA培养基中,不同真菌达到最高抑菌率的时间不同,结果显示,培养2 d时对脆弱毛霉菌和灰霉菌的抑制率最高,分别为27.07%和32.23%;培养3 d时对尖孢镰刀菌和厚孢镰刀菌的抑制率最高,分别为39.21%和28.45%;培养4 d时对白桦茸担子菌的抑制率最高,为21.90%;对赤星菌和枯叶格孢腔菌没有显著抑制作用。
3 讨 论
植物生长发育中可能受到各种病原菌侵害,进而影响农产品质量和产量。目前,主要使用化学农药进行防治[26],但化学农药在土壤中残留时间长,对生态造成破坏,危及人类健康[27]。因此,为了自然环境及人类健康,寻找更健康的替代品成为当务之急。
几丁质酶存在于细菌、真菌、昆虫和植物等不同形式的生物体中,是一种具有降解真菌细胞壁作用的病程相关蛋白,当植物(宿主)细胞处于病原体胁迫下时,植物几丁质酶会强烈表达,因此植物几丁质酶在对抗真菌病原体方面起着关键作用[28]。本实验室前期研究发现,不同抗性的茶树品种在接种茶饼病病原菌(坏损外担菌)后,茶树几丁质酶CsC7相对表达量显著提高,推测茶树几丁质酶CsC7在茶树抗真菌病害中扮演着重要角色。
在病原体攻击期间,植物几丁质酶释放出病原体反应蛋白作为自我防御,在以往一些研究中已证实许多植物几丁质酶都具有潜在的抗真菌活性[29],如从乌头叶豇豆(Vignaaconitifolia)中提取的几丁质酶可用于抑制真菌病原体[30],从尖葫芦(Trichosanthesdioica)种子中提取的几丁质酶对黑曲霉和木霉均有抗真菌活性[31],使用纯化的几丁质酶蛋白进行微量滴定板测定中发现几丁质酶对真菌孢子萌发和菌丝生长有抑制活性[32]。本研究通过使用酵母异源表达纯化后的CsC7蛋白对脆弱毛霉菌、白桦茸担子菌、尖孢镰刀菌、赤星菌、灰霉菌、厚孢镰刀菌、枯叶格孢腔菌7种真菌进行抗菌活性分析,发现纯化后的酵母异源表达蛋白CsC7对脆弱毛霉菌、白桦茸担子菌、厚孢镰刀菌、尖孢镰刀菌、灰霉菌有明显抑制活性,这一研究结果表明,茶树几丁质酶CsC7对多种茶树真菌病害具有抑制作用,也为进一步探究茶树抗真菌病害分子机制提供一定的理论基础。
叶片病原体对植物的侵染涉及病原体渗透到内部组织中,在那里它们从内部细胞中获取水和养分。各种细菌、卵菌和真菌利用气孔开口作为主要的入侵途径。作为对策,植物可以在感知到病原体时迅速关闭气孔以限制其进入。这种对气孔关闭的控制,也称为气孔免疫,是植物先天免疫反应之一[33-34]。高静等[35]研究表明,叶面喷施酵母后,酵母能诱导气孔关闭。本实验通过在茶树叶片表面喷施表达茶树几丁质酶CsC7蛋白的毕赤酵母培养液,以酵母液体培养基为阴性对照,叶面喷施型的哈茨木霉可湿粉剂为阳性对照,蒸馏水为空白对照,在茶饼病发病期选取无肉眼可见病斑的茶树为实验对象测量茶园中茶饼病田间发病情况,田间实验结果显示,酵母表达CsC7处理组相对蒸馏水处理组的病斑数降低了34.04%。本研究结果为研发防治茶树真菌病害的绿色农药提供理论依据,同时为抗真菌病害茶树品种的选育提供理论支撑。
