非靶向代谢组学分析不同品种青花椒的化学成分差异
2023-11-22祝晓云蒋永梅余家奇
祝晓云, 蒋永梅, 余家奇, 郑 宇, 覃 成
(1.遵义职业技术学院现代农业系/喀斯特地区特色生物资源保护与开发利用重点实验室, 贵州 遵义 563006;2.遵义医科大学, 贵州 遵义 563099; 3.遵义医科大学第三附属医院, 贵州 遵义 563000)
青花椒为芸香科(Rutaceae)花椒属竹叶花椒(ZanthoxylumschinifoliumSieb. et Zucc)的果皮[1],又名野椒、天椒、崖椒等[2]。青花椒因其果实成熟后为青色而得名,主产于云南昭通、陕西韩城、四川汉源、重庆江津和贵州等地[3]。青花椒具有独特的浓烈香气,在我国主要用作食品调味香辛料。青花椒含有酰胺类、萜类、生物碱类、氨基酸类、香豆素类等化学成分[1,4],具有麻醉、抗菌[1]、抗炎[4]、镇痛[5]、降血脂[6]、抗氧化和抗肿瘤[7]等生物活性。
非靶向代谢组学针对生物体内的代谢物物质(<1 kDa)开展全面、系统的定性和定量分析[8-9]。结合多元统计分析方法能更好地对样品鉴定差异进行更为详细的分析,同时针对特定的差异代谢物进行深度挖掘[10]。在不同外界环境情况下,植物体内在代谢组学水平的表达变化通常会随着外部环境的变化而变化。如花椒体内代谢物质的变化会随着环境因子的变化而变化,其中包括土壤因子、气候因子等外部环境影响而改变,从而影响花椒的品质和市场经济价值。研究发现,非靶向代谢组学同近红外光谱[8]、核磁共振[11]、高效液相色谱[12]等分析方法相结合,对研究植物体中代谢物的表达水平和外部环境之间的关系具有更为显著的优势。相比较其他代谢组学平台分析方法,其中超高效液相色谱-四极杆飞行时间质谱具有分辨率高、灵敏度和重现性好等特点,并允许同时对多个化合物进行快速的定性或相对定量分析[13],因此在生物学[14]、临床医学[15]、药学[16]、食品[17]等生命科学领域广泛应用。
本研究收集了国内4种不同来源的青花椒(新舟青椒(Zb005)、遵义大木椒(Zb004)、江口青椒(Zb0010)和峨眉山藤椒(Zb003)),基于液相-质谱(Liquid Chromatography-mass Spectrometry,LC-MS)联用技术的非靶向代谢组学,分析不同来源代谢物质,经过包括主成分分析(Principal Component Analysis,PCA)、偏最小二乘判别分析(Partial Least Squares Discriminant Analysis,PLS-DA)等多元统计分析方法,筛选不同来源青花椒的差异并分析其相关通路,以期为筛选青花椒优质种质资源提供理论基础,同时为花椒加工提供现实依据。
1 材料与方法
1.1 材料与试剂
4个不同花椒品种均种植在遵义职业技术学院花椒种植基地(107°045′E,27°710′N),采集成熟青花椒果实,液氮速冻备用。4个不同花椒品种分别是来自贵州省遵义市本地的新舟青椒和遵义大木椒、引种自贵州省铜仁市的江口青椒和四川省乐山市的峨眉山藤椒。
试剂:甲醇(北京百灵威科技有限公司,纯度:分析纯)、乙腈(Merck,纯度:色谱纯)、乙酸铵(Sigma,纯度:色谱纯)、氨水(上海阿拉丁生化科技股份有限公司,纯度:分析纯)、L-2-氯苯丙氨酸(上海恒柏生物科技有限公司,纯度≥98%)。
1.2 仪器与设备
Agilent 1290 Infinity LC超高压液相色谱仪(美国安捷伦公司);AB Triple TOF6600质谱仪(AB SCIEX);JXFSTPRP-24研磨仪(上海净信科技有限公司);VORTEX-5涡旋仪(其林贝尔仪器制造有限公司);低温高速离心机(Eppendorf 5430R);色谱柱:Waters,ACQUITY UPLC BEH Amide 1.7 μm,2.1 mm×100 mm column。
1.3 实验方法
1.3.1样品前处理
上述4种青花椒中,每组青花椒样品分别设6个生物学重复。样品放置于冻干机(Scientz-100F)中真空冷冻干燥,用研磨仪研磨(30 Hz,1.5 min)至粉末状备用。
1.3.2代谢物的提取
称取20 mg青花椒粉末加入2 mL离心管中,加入1 000 μL提取液(V甲醇∶V乙腈∶V水溶液=2∶2∶1)涡旋30 s将其混匀;然后放置在研磨仪中45 Hz处理4 min,接着冰水浴超声处理5 min,重复以上步骤3次;将处理后得到的液体在-20 ℃环境中静置10 min。静置后,4 ℃下14 000 r/min离心20 min,提取上层清液置于真空干燥机中干燥,质谱分析时加入100 μL乙腈水溶液(V乙腈∶V水=1∶1)复溶,涡旋,14 000 r/min 4 ℃离心15 min,取上清液进样分析。为确保花椒样品间的可重复性,对样品进行同等体量进行混合开展质控。
1.3.3色谱条件
样品采用Agilent 1290 Infinity LC超高效液相色谱进行分离,色谱柱为Waters,ACQUITY UPLC BEH Amide 1.7 μm,2.1 mm×100 mm column;柱温25 ℃;流速0.5 mL/min;进样量2 μL;流动相组成A:水+25 mmol/L乙酸铵+25 mmol/L氨水,B:乙腈。梯度洗脱程序:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B;为保障样品分析过程的顺利进行,将需要分析的样品放置于4 ℃自动进样器中。为避免仪器检测信号波动而造成的影响,对需要进行分析的样本采用随机进样。为获得更为稳定和可靠的实验数据,在分析的样品中插入质控样品。
1.3.4Q-TOF质谱条件
采用AB Triple TOF6600质谱仪进行样本一级、二级谱图的采集。HILIC色谱分离后的ESI源条件如下:Ion Source Gas1(Gas1):60,Ion Source Gas2(Gas2):60,Curtain gas(CUR):30,source temperature:600 ℃,IonSapary Voltage Floating (ISVF)±5 500 V(正负两种模式);TOF MS scan m/z range:60~1 000 Da,product ion scan m/z range:25~1 000 Da,TOF MS scan accumulation time 0.20 s/spectra,product ion scan accumulation time 0.05 s/spectra;二级质谱采用information dependent acquisition (IDA)获得,并且采用high sensitivity模式,Declustering potential(DP):±60 V(正负两种模式),Collision Energy:(35±15)eV,IDA设置如下Exclude isotopes within 4 Da,Candidate ions to monitor per cycle:10。
1.3.5数据处理
首先,使用ProteoWizard软件将经质谱分析后的原始数据转换mzML格式;然后使用ChromaTOF软件对质谱数据进行峰提取、基线矫正、解卷积、峰积分、峰对齐等分析。采用Compound Discover(2.0 版,Thermo)和OSI-SMMS(1.0 版,大连化学数据解决方案信息技术公司),与MassBank、HMDB、MoTo DB、METLIN及Mzcloud数据库等进行物质鉴定,再将质控样本中检出率50%以下或RSD大于30%的峰去除。使用SIMCA14.1软件进行PCA、OPLS-DA等多元统计分析,筛选差异代谢物。对筛选出的差异代谢集,通过关联分析、KEGG Pathway数据库通路分析、聚类分析等分析手段进行生物学信息挖掘。
2 结果与分析
2.1 数据质量控制
为获得真实可靠的数据,本实验从以下两方面进行数据质量控制:一是在正、负离子采集分析时,通过组间穿插进样、样品组内随机进样的方式进行检测; 二是通过绘制QC样品的PCA得分图考察检测系统的稳定性。如图1所示,正、负离子模式下青花椒QC样品多次进样的峰面积偏差在-2~2 SD之间。结果表明,本次测试系统稳定,误差小,重复性好,数据稳定可靠。
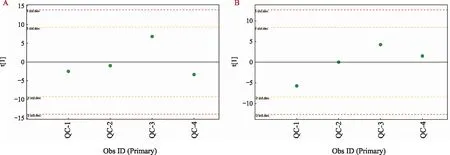
注:A为正离子模式PCA得分图;B为负离子模式PCA得分图。
2.2 代谢物鉴定数量统计
4个品种青花椒中,正、负离子模式合并后鉴定出差异显著的代谢物131种,在正离子模式下共鉴定到54种代谢物,而在负离子模式下共鉴定到77种代谢物,统计结果如表1所示。
表1 差异代谢物的统计
Table 1 Statistics of the differential metabolites
2.3 代谢物化学分类归属统计
从4个品种青花椒中鉴定到的所有代谢物(合并正负离子模式鉴定到的代谢物),根据代谢物的化学分类进行统计,每组代谢物数量占总代谢物量比率如图2所示。有机酸及其衍生物(Organic acids and derivatives)代谢物量占总比16.111%,有机氧化合物(Organic oxygen compounds)占总比14.444%,核苷、核苷酸以及其类似物(Nucleosides, nucleotides, and analogues)占总比6.111%,有机杂环化合物(Organheterocyclic compounds)占总比5.556%,脂质和类脂质分子(Lipids and lipid-like molecules)占总比5%,苯类化合物(Benzenoids)占总比3.889%,有机氮化合物(Organic nitrogen compounds)占总比2.5%,苯丙素和聚酮化合物(Phenylpropanoids and polyketides)占总比2.222%,有机氧化物(Organooxygen compounds)占总比0.556%,木脂素、新木脂素以及相关化合物(Lignans, neolignans and related compounds)占总比0.278%,苯丙烷和聚酮化合物/生物碱和衍生物(Phenylpropanoids and polyketides/Alkaloids and derivatives)占总比0.278%。
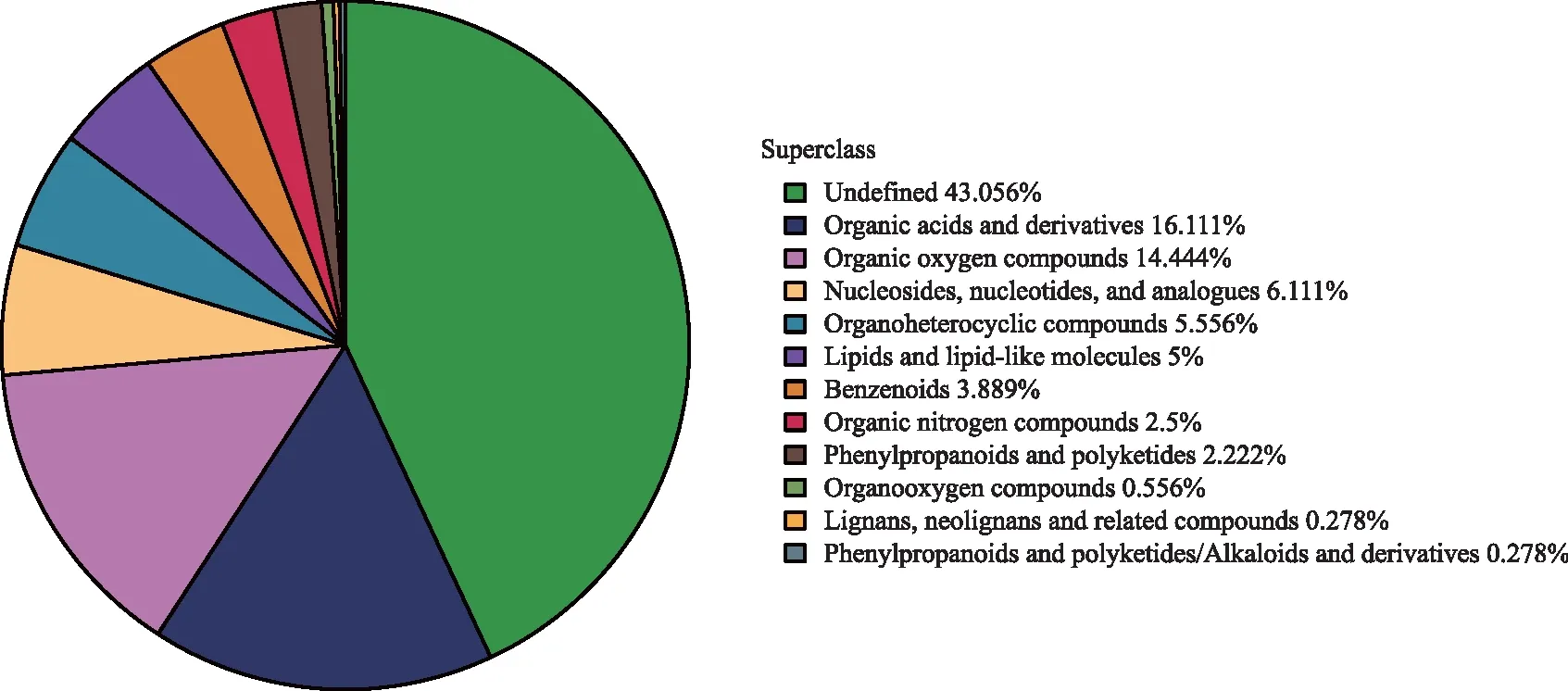
图2 鉴定的代谢物在各化学分类的数量占比
2.4 单变量统计分析
单变量分析中,差异代谢物的筛选通过差异倍数(FC≥1.2或≤0.833 3)和p-value(p<0.05)的指标在火山图3中体现。其中显著上调的代谢物和显著下调的代谢物分别用红色点和蓝色点表示,灰色表示未显著变化的代谢物。圆点的大小表示变量权重值。图3为正离子模式下4个不同品种青花椒比较的火山图,新舟青椒与峨眉山青椒比较(图3A),存在24种显著差异的代谢物;新舟青椒与遵义大木椒比较(图3B),存在17种差异代谢物;新舟青椒与江口青椒比较(图3C),存在13种差异代谢物。
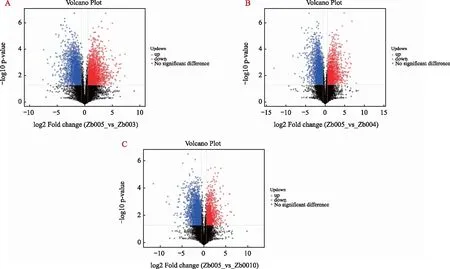
注:A为新舟青椒与峨眉山藤椒的比较;B为新舟青椒与遵义大木椒的比较;C为新舟青椒与江口青椒的比较。红色表示上调,蓝色表示下调,黑色表示差异不显著。
2.5 不同品种青花椒代谢物的多元统计分析
2.5.1主成分分析
主成分分析作为一种多元统计非监督的数据分析方法。为分别筛选新舟青椒与峨眉山藤椒、遵义大木椒、江口青椒的差异代谢物,首先建立非监督的主成分分析模型(PCA-X)对上述4个品种青花椒进行分析。通过自动拟合,新舟青椒与峨眉山藤椒模型的解释率为0.823,新舟青椒与遵义大木椒模型的解释率为0.796,新舟青椒与江口青椒模型的解释率为0.774。主成分得分散点图详见图4,新舟青椒分别与峨眉山藤椒(图4A)、遵义大木椒(图4B)、江口青椒(图4C)的分布比较分散,而组内3次生物学重复分布较紧凑。这表明该主成分分析模型可靠,不同品种的青花椒代谢物存在差异。
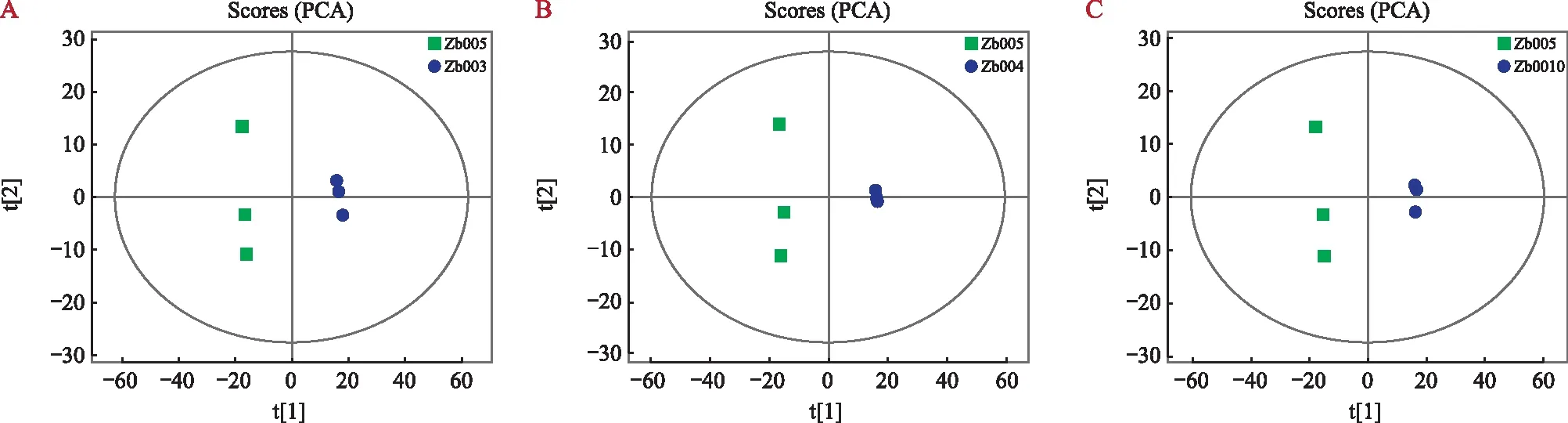
注:A为新舟青椒与峨眉山藤椒的主成分得分散点图;B为新舟青椒与遵义大木椒的主成分得分散点图;C为新舟青椒与江口青椒的主成分得分散点图。t[1]代表主成分1,t[2]代表主成分2,椭圆代表95%置信区间。同一颜色的点表示组内的各个生物学重复。
2.5.2正交偏最小二乘判别分析
由于采用PCA-X建模不能完全将新舟青椒与峨眉山藤椒、遵义大木椒和江口青椒区分开,而正交偏最小二乘判别分析(Orthogonal Partial Least Squares Discrimination Analysis,OPLS-DA)是一种有监督的判别分析统计方法,增加正交矫正之后会使得数据检出的假阳性降低,在OPLS-DA得分图上有两种主成分,即预测主成分和正交主成分。OPLS-DA将组间差异最大化地反映在t[1]上,所以从t[1]上能直接区分组间变异,而在正交主成分to[1]上则反映了组内的变异,比主成分分析更准确。
从图5可以看出,新舟青椒与峨眉山藤椒(图5A-1)、新舟青椒与遵义大木椒(图5B-1)、新舟青椒与江口青椒(图5C-1)样品均能明显的分开,说明不同品种青花椒存在较大差异,而组内3次生物学重复散点较集中,表明组内差异较小。

注:第1列为新舟青椒与峨眉山藤椒OPLS-DA得分图(A-1)和模型验证图(A-2);第2列为新舟青椒与遵义大木椒OPLS-DA得分图(B-1)和模型验证图(B-2);第3列为新舟青椒与江口青椒OPLS-DA得分图(C-1)和模型验证图(C-2)。
2.5.3OPLS-DA置换检验
为分析不同品种青花椒代谢物的差异,采用OPLS-DA模型对4个不同品种青花椒果皮中的差异代谢物进行了分析,模型拟合参数见表2。采用R2Y
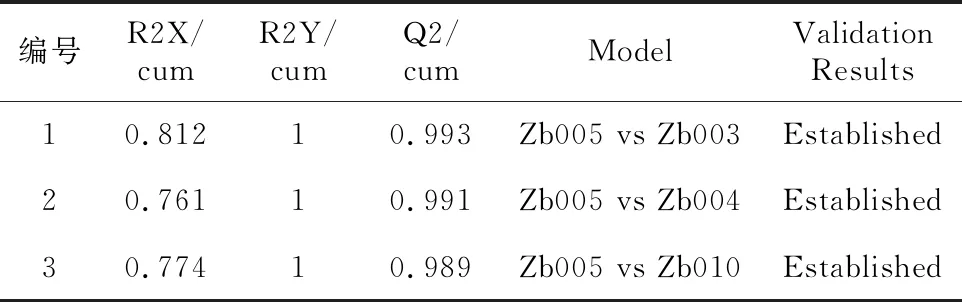
表2 正离子模式下OPLS-DA模型的评价参数
和Q2对OPLS-DA模型进行了评估,其中,R2Y代表模型的拟合能力,Q2代表预测能力。三组结果的R2Y均为1,Q2>0.5,说明模型稳定可靠,预测能力好。继续对模型进行了N=200的置换检验(图5A-2、B-2、C-2),正负离子模式下的3个原模型R2Y均接近1,说明模型拟合效果较好。在正负离子模式下置换检验随机模型的Q2值均小于原模型的Q2值,正离子模式下Q2的回归线与纵轴的截距小于零,说明原模型稳健性较好,不存在过拟合现象。
2.5.4不同品种青花椒差异代谢物的筛选
为筛选不同品种青花椒中显著性的差异代谢物,以OPLS-DAVIP>1和p<0.05作为评价指标,筛选显著性差异代谢物。经过筛选和统计分析,本实验共筛选出90种差异代谢物(表3、表4),其中正离子模式的显著性差异代谢物有39种,负离子模式的显著性差异代谢物51种,共有的差异代谢物有7种,分别是:
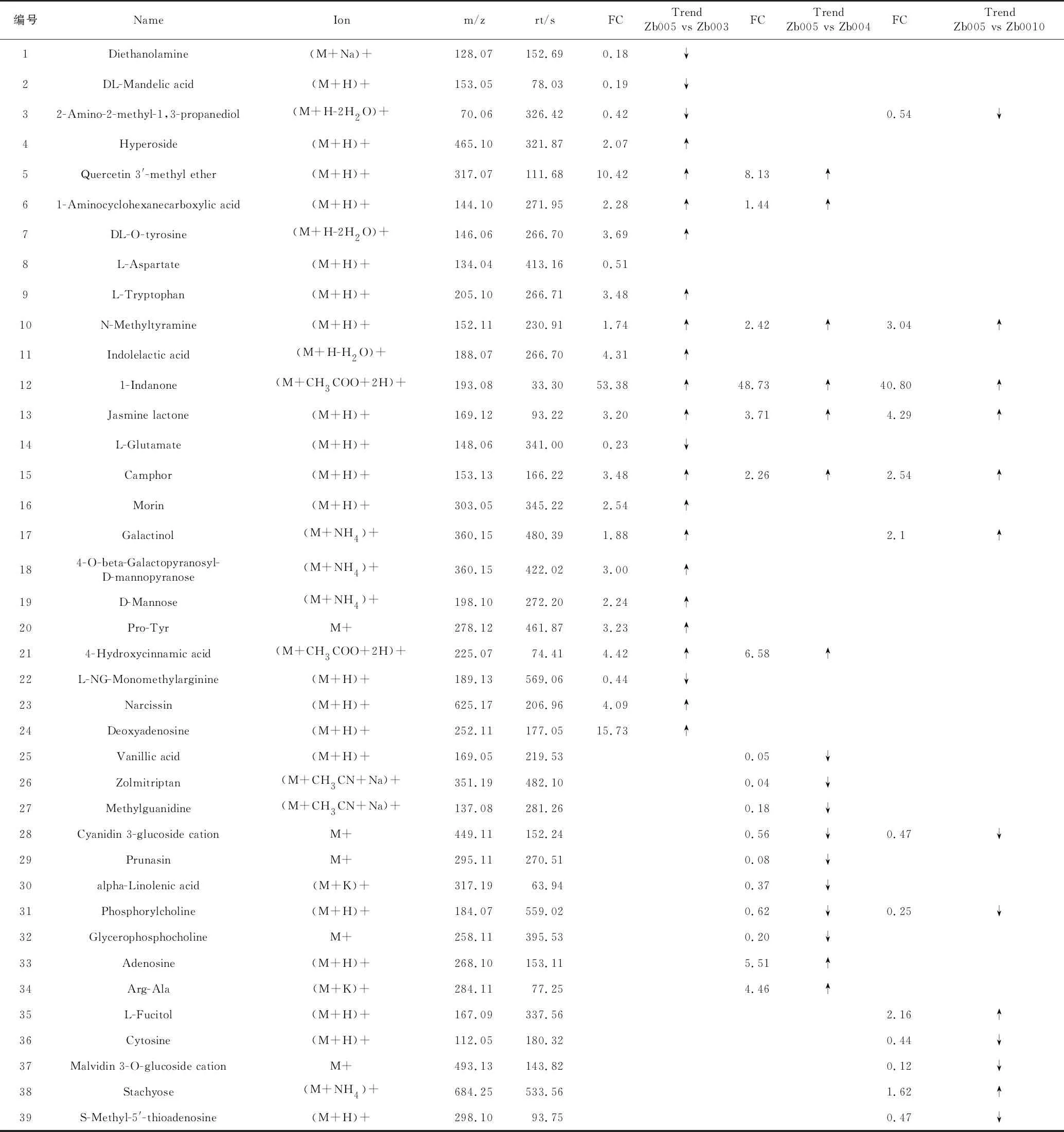
表3 正离子模式下差异代谢产物及变化趋势
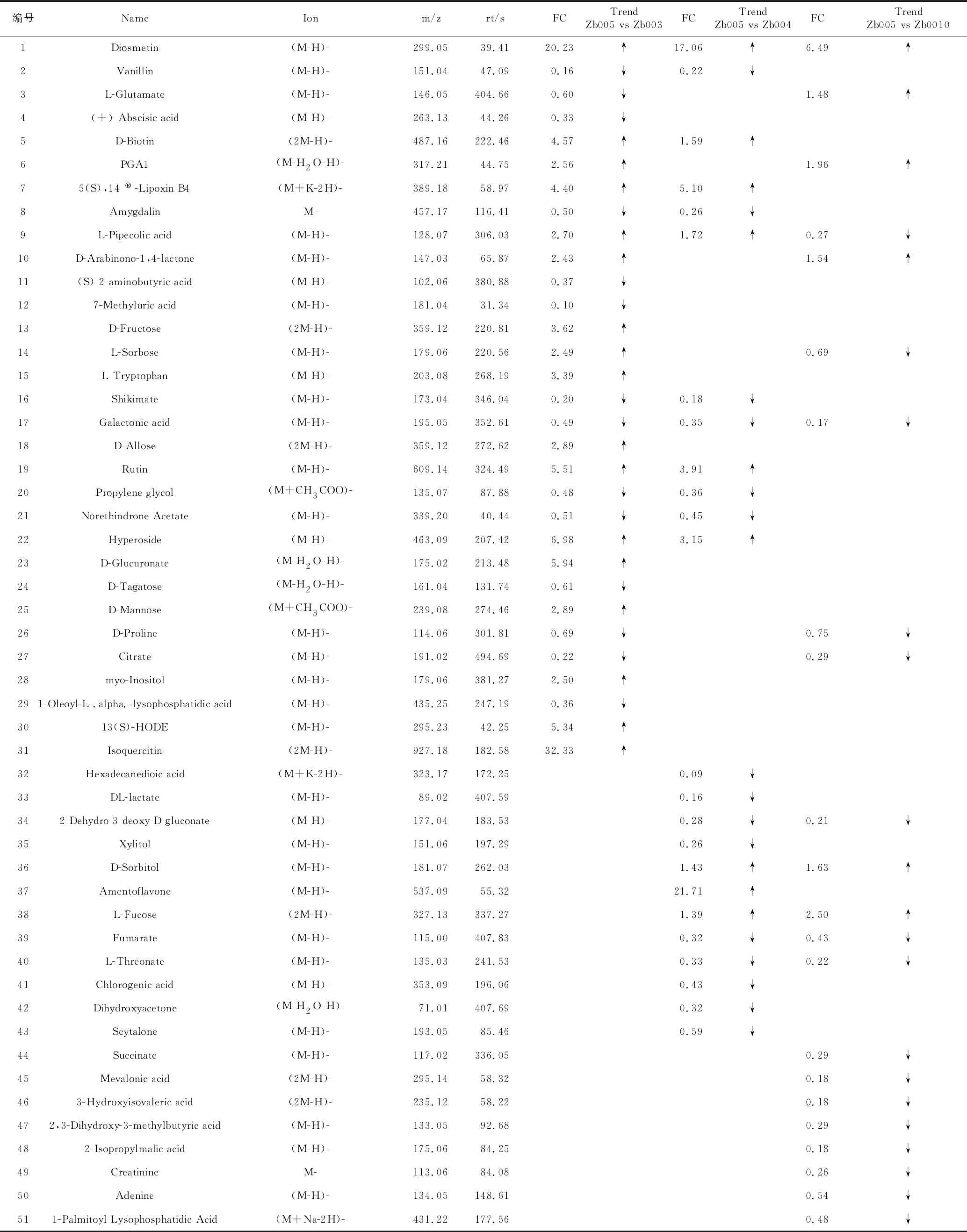
表4 负离子模式下差异代谢产物及变化趋势
N-甲基酪胺(N-Methyltyramine)、1-吲哚酮(1-Indanone)、茉莉内酯(Jasmine lactone)、樟脑(Camphor)、香叶木素(Diosmetin)、L-哌啶酸(L-Pipecolic acid)、半乳糖酸(Galactonic acid)。为简单、直观地表现差异代谢物的变化情况,进一步绘制了组间具有显著差异的代谢物变化的FC图(图6)。图中横坐标表示差异表达倍数,红色表示上调,绿色表示下调,纵坐标表示显著性差异代谢物,从图6可知,组间差异代谢物种类及表达情况存在差异,提示与青花椒的品种密切相关。
2.6 层次聚类分析
为更好地了解不同品种青花椒之间代谢物的差异,通过聚类热图分析对不同品种青花椒中的差异代谢产物进行分析,结果见图7。从图中条带可以看出,不同品种青花椒中都有明确的高表达或者低表达的区域,可以根据表达情况区分不同品种青花椒。新舟青椒与峨眉山藤椒相比,有32种化合物的含量高表达(图7A-1、A-2),新舟青椒与遵义大木椒相比,有18种化合物的含量高表达(图7B-1、B-2),新舟青椒与江口青椒相比,有13种化合物的含量高表达(图7C-1、C-2)。在3个比较组中,新舟青椒(Zb005)代谢物的含量均表现出高表达的化合物有4种,分别为:1-吲哚酮(1-Indanone)、樟脑(Camphor)、茉莉内酯(Jasmine lactone)和香叶木素(Diosmetin),这提示新舟青椒(Zb005)口感较其他几种青椒品种较好的原因。
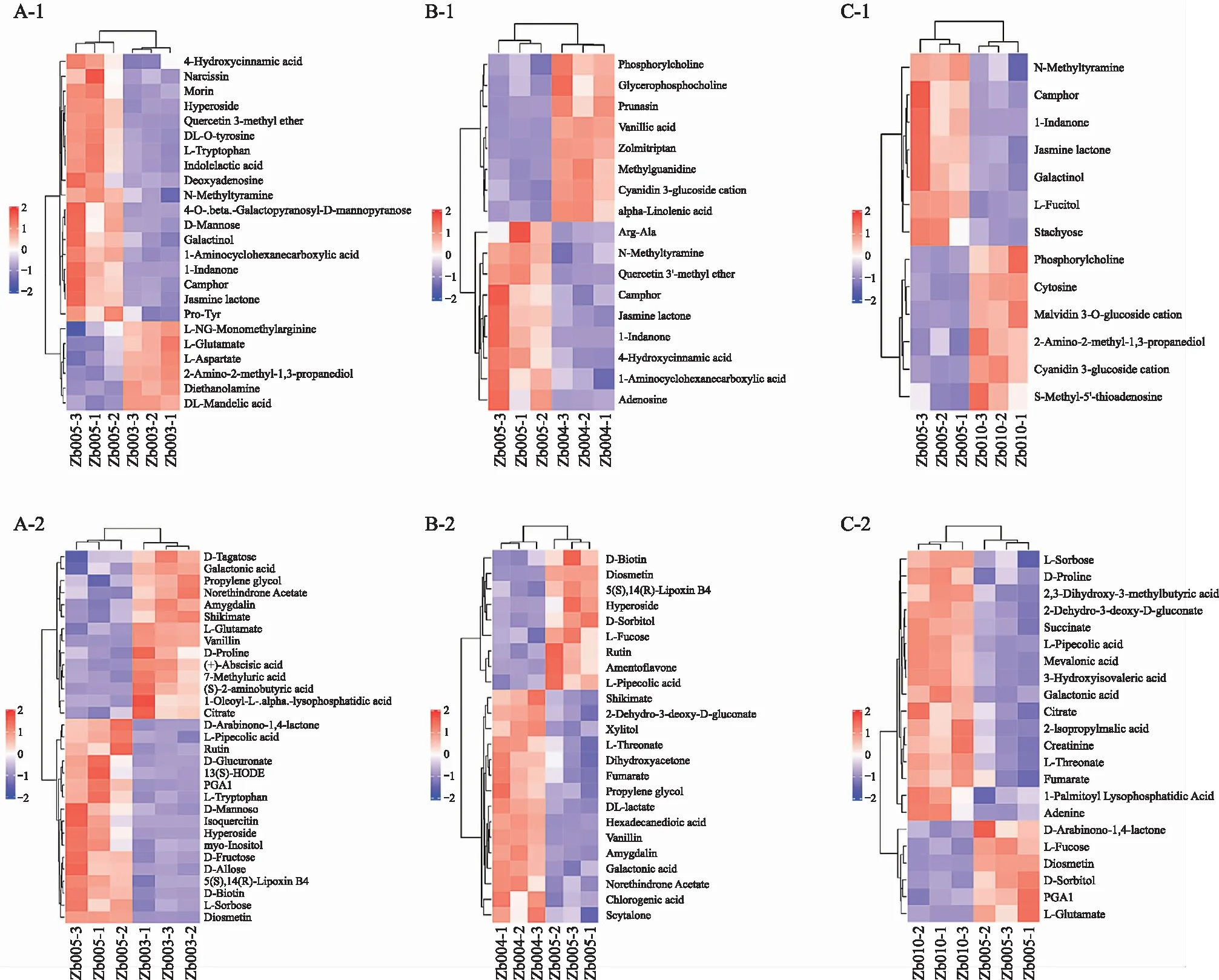
注:第1列为新舟青椒与峨眉山藤椒代谢物的比较;第2列为新舟青椒与遵义大木椒代谢物的比较;第3列为新舟青椒与江口青椒代谢物的比较。其中A-1、B-1、C-1为正离子模式,A-2、B-2、C-2为负离子模式。横坐标为各组青花椒样本编号,纵坐标为已具有显著性差异的代谢物,颜色表示含量的变化趋势,红色表示含量高表达,蓝色色表示含量低表达。
2.7 差异代谢物的相关分析
相关性分析有助于测量不同具有显著性差异代谢物之间的代谢接近度(VIP>1,p<0.05),并有助于了解生物状态变化过程中代谢物之间的相互调节。图8为不同品种青花椒中90种显著差异代谢物的相关分析结果。红色表示正相关,蓝色表示负相关,颜色深浅与相关性系数的绝对值大小有关,即正相关或负相关的程度越高,颜色越深,点的大小与相关性的显著性有关,越显著,p值越小,点越大。由图8可知,各品种青花椒中的显著性差异代谢物之间存在较好的正相关或负相关性。
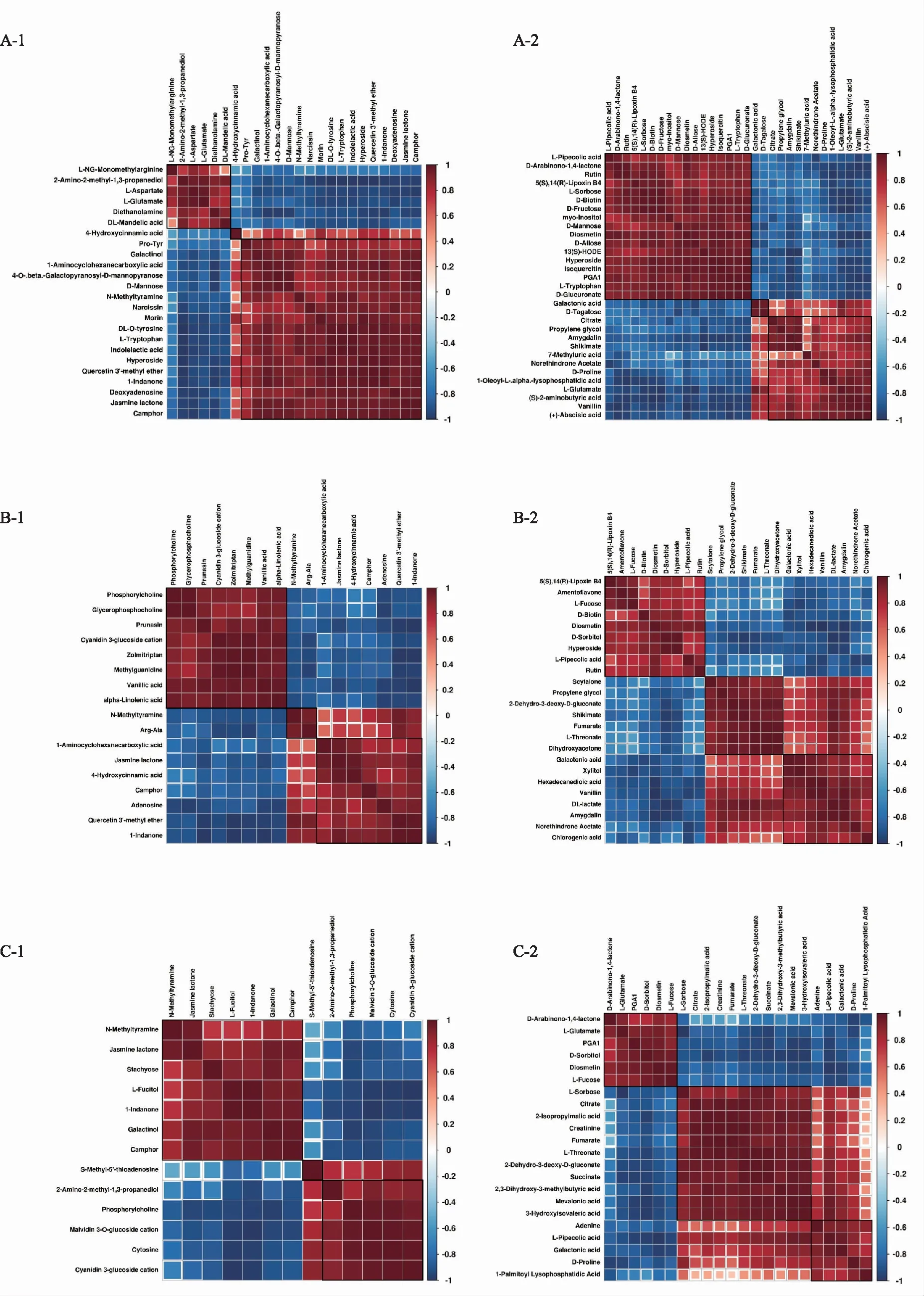
注:第1行为新舟青椒与峨眉山藤椒差异代谢物的相关性热图;第2行为新舟青椒与遵义大木椒差异代谢物的相关性热图;第3行为新舟青椒与江口青椒差异代谢物的相关性热图。其中A-1、B-1、C-1为正离子模式,A-2、B-2、C-2为负离子模式。
2.8 差异代谢物的KEGG通路注释与分析
在生物体内,不同代谢物之间的相互协调作用使得生物体具有相应的功能,通过对生物体重KEGG通路的详细分析更有助于了解不同生物在代谢组水平上的生物学功能。如图9所示,新舟青椒与峨眉山藤椒相比(图9A),差异代谢物主要富集在代谢途径(Metabolic pathways)、2-氧代环戊烷羧酸甲脂代谢(2-Oxocarboxylic acid metabolism)、各种次生代谢产物的生物合成(Biosynthesis of various secondary metabolites)、氨基酸生物合成(Biosynthesis of amino acids)、氰基氨基酸代谢(Cyanoamino acid metabolism)、二元组分系统(Two-component system)。新舟青椒与遵义大木椒相互比较中的代谢通路结果中发现(图9B),差异代谢物主要富集的代谢通路为代谢途径、碳代谢(Carbon metabolism)、ABC转运(ABC transporters)、戊糖和葡萄糖醛酸的相互转换(Pentose and glucuronate interconversions)、二元组分系统、酪氨酸代谢(Tyrosine metabolism)。新舟青椒)与江口青椒(Zb0010)相比(图9C),差异代谢物主要富集在代谢途径、2-氧代环戊烷羧酸甲脂代谢、氨基酸生物合成、精氨酸和脯氨酸代谢(Arginine and proline metabolism)、酪氨酸代谢(Tyrosine metabolism)、碳代谢。
3 结论与讨论
花椒是一种常用的香料,其种类繁多,广泛分布于我国各地,且资源丰富。其独特的香味和麻味来自于内部的挥发性风味物质,且含有大量的活性化学成分,包括挥发油[18]、酰胺类物质[19]、生物碱[20]、香豆素[21]、木脂素[22]和脂肪酸[23-24]等。
本研究通过超高效液相色谱结合四极杆飞行时间质谱对供试4种青花椒进行非靶向代谢组学分析,结合单变量统计分析和多元统计分析进行组间差异分析,筛选出差异代谢物,再通过层次聚类、相关性分析和KEGG数据库注释差异代谢物参与的代谢途径,从中筛选出关键代谢物,以期为筛选青花椒优质种质资源提供理论基础,为从多组学研究花椒遗传多样性提供理论依据,同时为花椒加工提供现实依据。
4种青花椒中,鉴定出正、负离子模式下差异显著的代谢物共131种,正离子模式54种,负离子模式77种。对这些差异代谢物进行化学分类归属信息的统计后,发现占比最大的是有机酸及其衍生物(16.11%),其次是有机氧化合物(14.44%)。在正离子模式下,新舟青椒与峨眉山藤椒存在24种显著的差异代谢物,新舟青椒与遵义大木椒存在17种差异代谢物,新舟青椒与江口青椒存在13种差异代谢物。对所有的差异代谢物进行筛选后,发现有7种共有的差异代谢物,分别为N-甲基酪胺、1-吲哚酮、茉莉内酯、樟脑、香叶木素、L-哌啶酸、半乳糖酸(图6),这些代谢物的表达情况存在差异,提示与青花椒的品种密切相关。
为深入理解这4种青花椒之间代谢物的差异,通过层次聚类热图对其进行分析(图7),发现在3个比较组中(Zb005 vs Zb003、Zb005 vs Zb004、Zb005 vs Zb0010),新舟青椒(Zb005)的含量表现出比其他几种青椒更高表达的化合物有4种(1-吲哚酮、樟脑、茉莉内酯和香叶木素),这可能是遵义本地青椒(新舟青椒)
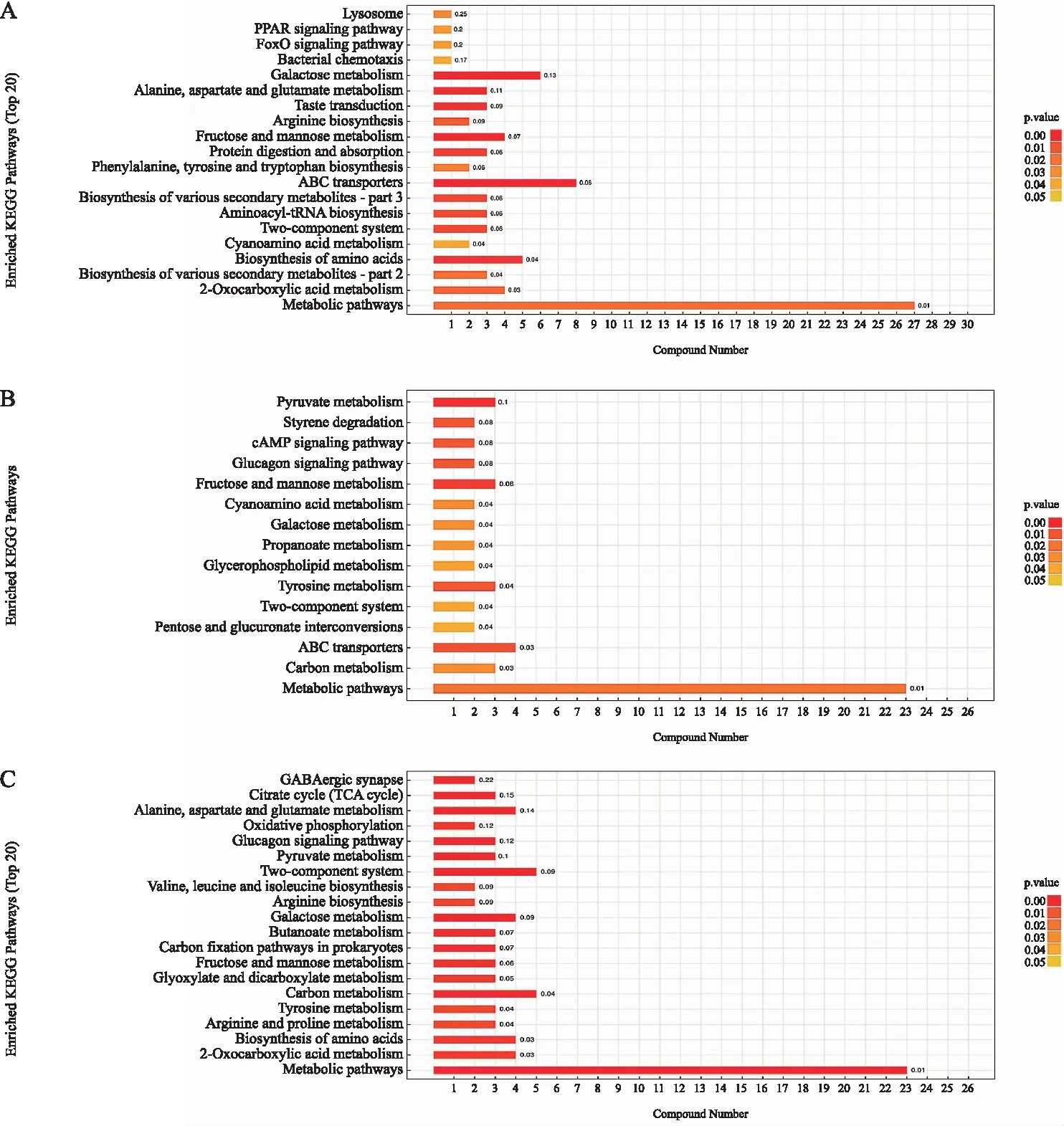
注:A为新舟青椒与峨眉山藤椒比较组中代谢通路富集分析;B为新舟青椒与遵义大木椒 比较组中代谢通路富集分析;C为新舟青椒与江口青椒。柱状图中纵轴代表各KEGG代谢通路,横轴表示各KEGG代谢通路中包含的差异表达代谢物数目。颜色表示富集分析的p值,颜色越深p值越小,富集程度越显著。 图9 KEGG通路富集分析
口感较其他几种青椒好的原因。
氨基酸在植物初级代谢中扮演着不可或缺的角色,对于植物的生理过程具有重要的作用[25]。而糖和有机酸则作为植物构建碳骨架和提供能量的必要代谢资源[26-28],同时也是影响花椒风味的重要因素。脂类是细胞膜的主要成分,在信号转导、膜运输和细胞骨架重排等细胞功能中担任多重任务,同时也是香气组分的重要前体物质[29-30]。此外,花椒中独特的挥发性香味物质和芳香化合物也是花椒风味的重要组成部分,这些代谢物质的含量和组成对花椒的质量和口感具有重要影响[31]。经多元统计分析,发现各个青花椒样品之间的代谢物有明显的差异,呈现出明显的聚集区,表明这些品种的代谢物存在一定差异。对发现的差异代谢物进行KEGG通路的注释和分析后,发现代谢途径、碳代谢、糖类物质代谢及氨基酸代谢等途径是主要的焦点。其中,大部分的代谢物与糖类代谢有关,由此可见,糖类物质的代谢对青花椒的品质有较大影响。
综上所述,该研究从植物代谢组学角度初步揭示了不同品种青花椒的代谢产物差异性以及特征化合物,为青花椒的精深加工以及优良种质资源的筛选提供了一定的理论基础。
