异槲皮苷对β-淀粉样蛋白诱导毒性的阿尔茨海默病转基因秀丽隐杆线虫模型的神经保护作用△
2023-11-21李冰琪侯晓梦杨扬刘傲雪李强
李冰琪,侯晓梦,杨扬,刘傲雪,李强
北京中医药大学 中药学院,北京 100029
阿尔茨海默病(AD)是一种常见的神经系统退行性疾病,是老年痴呆的最常见原因之一。AD 对60 岁以上患者的致残率大于卒中、肌肉骨骼疾病、心血管疾病和癌症[1],除了对患者生活的影响外,还给家人带来了巨大的心理和经济负担。目前,可用于治疗AD 的药物相对不足,开发新药物与新疗法迫在眉睫。AD 主要由淀粉样β蛋白(Aβ)沉积引起,会出现脑组织萎缩、神经损伤等病理现象[2]。所以,AD 的防治应该从抑制Aβ的沉积、促进损伤神经的再生着手。
中医认为,痴呆疾病是由肾虚气弱导致。补肾益精法是痴呆治疗的基本原则,摄入补肾药可以一定程度上对大脑退化起到延缓甚至抑制作用[3]。肾精充足,可上充髓海,而中医所言之髓海之精从功能上与脑中的神经干细胞非常接近。通过本课题组对补肾中药菟丝子的研究发现[4],从菟丝子中分离出的异槲皮苷促体外神经干细胞增殖活性显著,说明异槲皮苷对改善AD 等神经退行性疾病具有潜在的药用价值。
秀丽隐杆线虫CL4176(以下简称线虫)是AD相关研究常用的实验动物模型,为温度诱导型转基因株,在16 ℃的温度下可正常生长,当温度升高到25 ℃时,Aβ被强烈诱导表达,从而导致虫体出现瘫痪[5-6]。因此,本研究考察了异槲皮苷对线虫CL4176寿命和Aβ诱导毒性的潜在影响,并阐明其发挥神经保护作用的可能机制,为治疗AD 的新药研发提供依据。
1 材料
1.1 菌株、线虫
转基因线虫CL4176由北京中医药大学中药学院谭鹏课题组提供;大肠埃希菌Escherichia coliOP50由北京中医药大学中药学院刘永刚课题组提供。
1.2 仪器
SPX-250 型生化培养箱(北京科伟永兴仪器有限公司);ECLIPSE Ts2R 型荧光倒置显微镜、SMZ745 型体视显微镜(尼康映像仪器销售中国有限公司);Multiskan FC 型酶标仪(赛默飞世尔科技有限公司);GTR10-2型高速冷冻离心机(北京时代北利离心机有限公司);VORTEX-7 型涡旋振荡仪、LX-300型离心机、QL-902型涡旋振荡仪均购于海门其林贝尔仪器制造有限公司;YXQ-LS-50SII 型高温高压灭菌锅(上海博迅实业有限公司医疗设备厂);VD650 型超净工作台(浙通品牌有限公司);ABI 7500 型荧光定量聚合酶链式反应(PCR)仪(Applied Biosystems 公司);NanoDrop® ND-2000型分光光度计(Thermo Scientific 公司);Tanon 1600 型凝胶成像系统(上海天能科技有限公司);Sub-Cell GT-1704486型水平电泳槽(Bio-Rad公司)。
1.3 试剂
2-(3,6-二乙酰氧基-2,7-二氯-9H-氧杂蒽-9-基)苯甲酸(上海麦克林生化科技有限公司);NaOH、NaCl、MgSO4、KH2PO4、NaH2PO4、CaCl2、NaClO、KOH 均为分析纯(北京试剂有限公司);琼脂粉、胰蛋白胨、酵母提取物、蛋白胨、胆固醇、盐酸咪唑(Innochem 公司);二喹啉甲酸(BCA)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)试剂盒(南京建成生物工程研究所)。
2 方法
2.1 线虫的培养及同步化
4 mol·L-1NaOH 溶液-H2O-NaClO(1∶1∶8)混合制备裂解液,挑出处于繁殖期的线虫,用M9 缓冲液将其冲下转移至离心管中,静置沉降再去掉上清液,加入裂解液1 mL 使其裂解充分,将虫卵转移至新的培养皿中培养。
2.2 药物配制
配制含有E.coliOP50 的固体培养基NGM 作为模型组。取异槲皮苷20 mg,用去离子水1 mL溶解,作为母液。给药组在模型组NGM 中加入异槲皮苷,配制质量浓度为100.00、25.00、6.25 μg·mL-1的含药固体培养基。
2.3 瘫痪实验
将繁殖期的线虫放置在含有E.coliOP50 的NGM板上产卵。每次处理在每个平板上保留大约50个虫卵,并在16 °C 下孵育2 d。同步化的线虫卵在16 °C 下培养至L3 时期,随机挑选线虫并放入给药组与模型组中,每个培养皿的线虫数量控制在50 条左右。然后将线虫转移至25 ℃培养箱,温度变化刺激Aβ的表达,Aβ聚集导致线虫瘫痪。每2 h 在显微镜下观察线虫瘫痪情况。线虫的瘫痪特征为在观察期间只有头部摆动而身体不动,甚至用铂丝触碰线虫的身体后依然不动。
2.4 寿命实验
将线虫同步化至L3 期,在加药组与模型组培养基中加入随机挑取的处于L3 期的线虫。每皿线虫的数量控制在30 条,16 ℃为线虫正常生长时的温度,培养2 d后转移至25 ℃恒温培养箱诱导Aβ表达。每天计算线虫的存活或死亡情况,直到最后1 条线虫死亡,线虫死亡判断标准为对铂丝的温和刺激没有反应或没有表现出咽部泵送运动。每隔2 d将线虫转移至新的培养基培养,统计每个培养皿中线虫存活数量,直到所有线虫死亡时终止计数。
2.5 运动能力测定
将线虫同步化至L3 期,在加药组与模型组培养基中,加入随机挑取的处于L3 期的线虫。每皿线虫的数量控制在50 条,保持温度在16 ℃下培养4 d。为了防止线虫培养过程中出现食物不足的情况,需要2 d换1次培养基。将各组培4 d后的线虫用M9缓冲液冲洗3 次,静置使其沉降,吸去上清液,转入新的培养基进行培养。从各组随机挑取10 条线虫,每次在体视显微镜下观察1 条,对线虫身体弯曲次数进行统计,计时时间为30 s。
2.6 吞咽频率测定
将线虫同步化至L3 期,在加药组与模型组培养基中,加入随机挑取的处于L3 期的线虫。每皿线虫的数量控制在50 条,线虫置于16 ℃培养箱培养4 d后,随机挑取10 条线虫对线虫的吞咽次数进行观察并计数,每次在体式显微镜下观察1 条,线虫头部位置的咽泵上下跳动时则计为完成1 次吞咽,计时时间为20 s。
2.7 活性氧(ROS)含量测定
将线虫同步化至L3 期,在加药组与模型组培养基中加入随机挑取的处于L3 期的线虫。每皿线虫数量控制在30条,16 ℃培养36 h,然后将线虫转移至25 ℃培养箱处理36 h。将各组培养好的线虫用M9缓冲液冲下转移至离心管中,静置沉降再弃掉上清,在暗棕色离心管中加入2,7-二氯二氢荧光素二乙酸酯(DCFH-DA),将DCFH-DA 探针的终浓度控制在20 μmol·L-1,每管中加入100 μL 左右,实验需要避光操作且在室温下孵育2.5 h。随后在荧光倒置显微镜下观察线虫,调整好显微镜拍摄荧光图片(激发波长485 nm,发射波长530 nm),实验结束后用Image J软件对每组线虫的荧光强度值进行测量。
2.8 抗氧化酶含量测定
将线虫同步化至L3 期,在加药组与模型组培养基中加入随机挑取的处于L3 期的线虫。每皿线虫的数量控制在30 条,保持温度在16 ℃下培养2 d,之后将线虫转移至25 ℃培养箱中继续培养2 d。将各组培养好的线虫用M9 缓冲液冲下转移至离心管中,静置沉降再弃掉部分上清液,4 ℃下用自动匀浆器匀浆,12 000 r·min-1离心4~5 min(离心半径为13 cm),取上清液,按照试剂盒的说明书测定各组线虫的蛋白质、MDA含量和SOD、CAT活性。
2.9 实时荧光定量PCR(qRT-PCR)检测mRNA表达
将线虫同步化至L3 期,在加药组与模型组培养基中加入随机挑取的处于L3 期的线虫。保持温度为16 ℃培养1 d,之后将线虫转移至25 ℃培养箱中继续培养4 d。通过Trizol 法获取线虫的总RNA,操作步骤严格遵循说明书,SYBR Green 作为DNA 荧光染料,通过qRT-PCR 对目标基因的表达进行测定,以actin-1为内参测定daf-16及其下游靶基因的表达量,相对定量结果采用2-△△Ct法进行计算,以扩增效率为100%计算基因表达量差异。引物设计见表1。

表1 线虫基因qRT-PCR扩增引物设计
2.10 数据统计
所有计量资料均使用SPSS 25.0 统计学软件处理,数据结果用(±s)表示。采用单因素(ANOVA)检验,P<0.05 为差异有统计学意义。事后比较时,方差齐者用Tukey,方差不齐者用Tamhane'sT2。采用Origin 2022软件进行数据作图。
3 结果
3.1 瘫痪实验
与模型组比较,异槲皮苷对线虫的僵化速率有一定的延缓作用(图1)。质量浓度为6.25 μg·mL-1的异槲皮苷处理后,线虫僵化速率达到50%的时间(PT50)[7]延长了11.0 h(P<0.001)。这表明异槲皮苷可以缓解Aβ蛋白沉积对线虫的毒性作用。因此后续实验选用6.25 μg·mL-1作为异槲皮苷给药质量浓度。
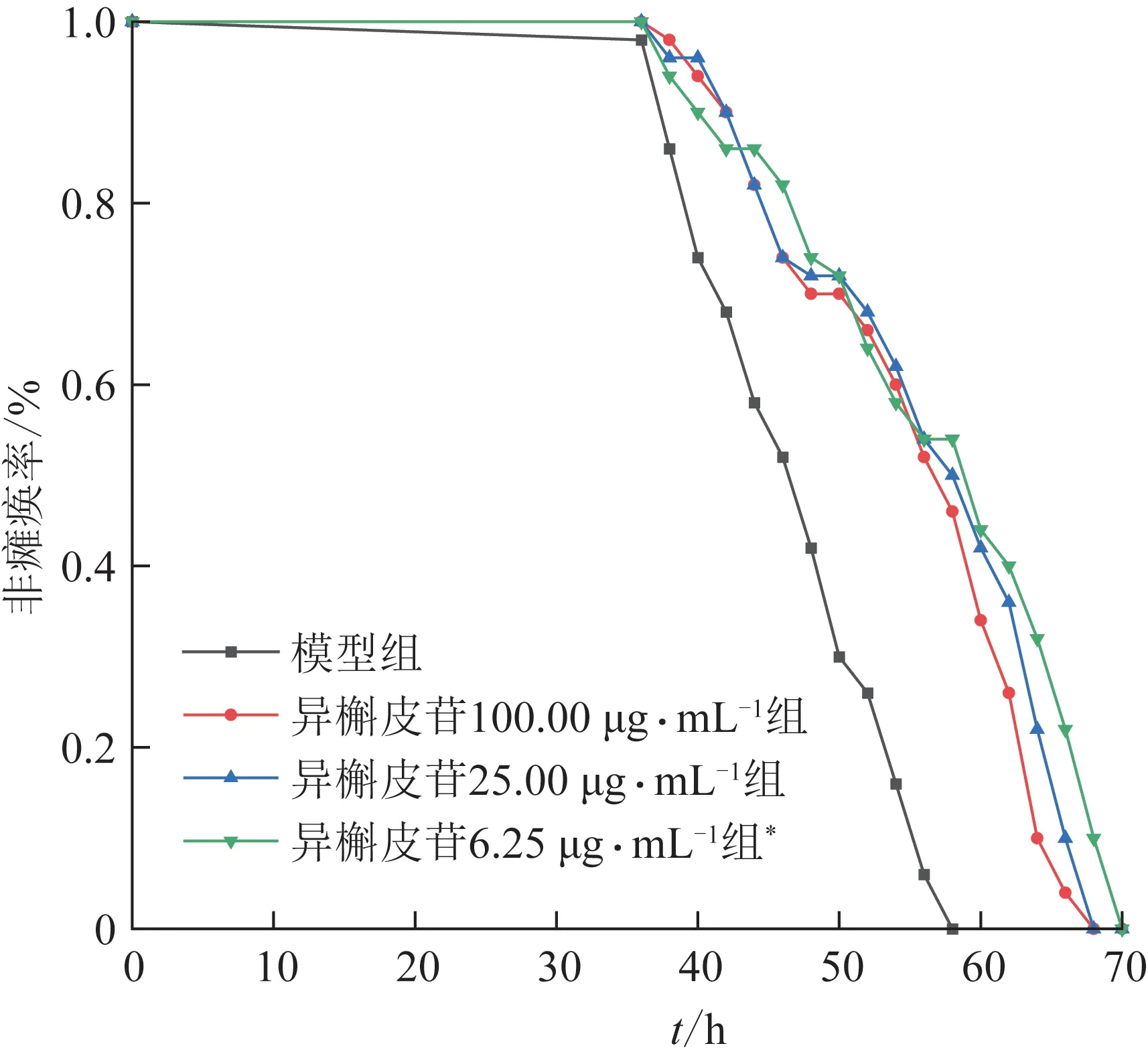
图1 异槲皮苷对线虫非瘫痪率的影响
3.2 寿命实验
结果显示,模型组线虫的平均寿命为(7.556±0.667)d,最长寿命为11 d(图2)。异槲皮苷组线虫平均寿命为(9.956±0.583)d,最长寿命为14 d;与模型组相比,异槲皮苷给药能显著延长线虫寿命,延长率为31.7%(P<0.01)。

图2 异槲皮苷对线虫生存率的影响
3.3 运动能力
运动能力下降说明线虫本身的机体功能受到影响,其整体活跃程度能够通过运动能力这一重要指标反映出来[8]。模型组线虫30 s 内身体弯曲次数为18.30±2.36,异槲皮苷给药4 d后,线虫身体弯曲次数为25.40±1.89,与对照组比较增加了38.79%(P<0.001)。
3.4 吞咽频率
线虫的吞咽速率在正常生理状况下能够反映出线虫进食的能力,进而间接反映线虫的机体功能是否衰退[9]。实验第4 天,模型组线虫20 s 内吞咽次数为38.70±2.45、异槲皮苷组线虫20 s 内吞咽次数为40.90±1.91;第6 天模型组线虫20 s 内吞咽次数为32.30±4.01、异槲皮苷组线虫20 s 内吞咽次数为35.50±1.96。与模型组比较,异槲皮苷组线虫吞咽频率差异无统计学意义,说明异槲皮苷并未对线虫的摄食能力产生影响。
3.5 ROS含量
极高ROS 水平会导致氧化应激,这是诱导AD神经退行性级联反应的主要机制之一[10]。模型组线虫体内相对荧光强度为2.645±0.188,异槲皮苷组线虫体内相对荧光强度为0.676±0.043。与模型组比较,异槲皮苷组线虫体内ROS 水平明显降低(P<0.001),荧光图见图3。这表明异槲皮苷在线虫体内能够表现较强的抗氧化能力,可能通过改善氧化应激发挥抗AD的作用。

图3 线虫体内ROS水平荧光图
3.6 抗氧化酶活性
抗氧化酶在减少氧化损伤中起着重要作用[11]。模型组与异槲皮苷组线虫体内SOD 活力分别为(13.376±0.162)、(24.451±0.216)U·mg-1;CAT活力分别为(1.540±0.005)、(8.895±0.014)U·mg-1;MDA 含量分别为(14.558±0.022)、(6.421±0.016)nmol·mg-1。由于SOD、CAT 是线虫体内主要的抗氧化酶,线虫抗氧化能力的变化可以通过酶活力的升高或降低来表现。异槲皮苷处理能使CL4176 线虫体内的SOD、CAT 活力显著提高(P<0.01,P<0.001)。MDA 的堆积具有一定的细胞毒性,是脂质过氧化终产物。MDA 含量可以反映生物体内脂质过氧化的程度,间接反映出细胞受损情况。实验研究结果表明,给药组线虫体内MDA的含量相较于模型组显著降低(P<0.001),表明异槲皮苷组在一定程度上能够提高线虫体内抗氧化能力,缓解氧化损伤。
3.7 荧光定量PCR检测
与对照组相比,异槲皮苷给药组线虫的AβmRNA 表达量显著降低,经异槲皮苷处理后线虫体内daf-16转录水平提高了3.2 倍,下游sod-3转录水平提高2.3 倍;热激蛋白基因hsf-1转录水平提高3.9 倍;skn-1转录水平提高3.3 倍,下游gst-4转录水平提高2.1 倍;抗氧化酶基因ctl-1转录水平提高3.1 倍,可见经异槲皮苷处理后,CL4176 线虫应激抗性能够有所增强(图4)。

图4 异槲皮苷对相关基因的qRT-PCR检测结果(±s,n=3)
4 讨论
AD 是一种常见的与衰老相关的神经退行性疾病,其主要致病因素是Aβ寡聚体的错误折叠和形成,导致不溶性聚集体,最终导致神经元损伤[12]。线虫是筛选和发现抗AD 药物的理想模式生物,因为其具有简单但有代表性的神经系统、生命周期短、遗传特征较为完善和药物消耗剂量低[13]。此外,通过构建转基因线虫的AD 模型,可以研究Aβ参与病理行为的直接影响[14]。
Aβ基因表达会导致线虫出现僵化表型,本研究通过线虫瘫痪实验筛选出异槲皮苷最佳活性质量浓度,实验结果表明,异槲皮苷处理后能够延缓线虫CL4176僵化,最佳质量浓度为6.25 μg·mL-1。异槲皮苷处理后,能够显著延长在25 ℃条件下诱导产生Aβ的CL4176 线虫的生存时间,同时线虫PT50延长了11.0 h(P<0.001)。异槲皮苷对线虫吞咽速率并没有显著影响,不存在饮食限制问题,但能够增强线虫的运动能力。并且异槲皮苷能够显著降低线虫体内ROS 含量,提高SOD、CAT 活性,降低线虫体内MDA 含量,说明异槲皮苷能够显著增强其氧化抗性。
有研究表明,突变导致的胰岛素受体功能丧失能够延长线虫寿命[15]。其中,与胰岛素/胰岛素样生长因子1 信号通路(IIS)相关的DAF-16、SKN-1 和HSF-1 转录因子至关重要。DAF-16 作为IIS/IGF-1 通路的下游靶标,是发育、繁殖、新陈代谢、应激反应和寿命的中央调节因子,并且能正向调节SKN-1和HSF-1的活性[16]。HSF-1是调节热应激和蛋白质折叠稳态的关键转录因子。HSF-1 和DAF-16/FoxO 通过与编码小热休克蛋白的基因启动子中的热休克元件(HSEs)和DAF-16/FoxO 结合元件(DBEs)结合延缓衰老[17]。转录因子SKN-1 是抗氧化活性和异源防御的重要调节因子,通过饮食限制或抑制TORC1或TORC2途径延长线虫寿命[18]。研究结果表明,异槲皮苷依赖并能够通过激活中央调节因子DAF-16,同时激活关键的氧化应激调节剂SKN-1 并依赖于SKN-1 来延长线虫的寿命。且异槲皮苷还通过激活HSF-1提高了抗热应激能力。
总体而言,上述结果表明,异槲皮苷依赖并作用于IIS,通过增加应激抵抗力,尤其是抗氧化能力,延长了线虫模型的寿命并延缓了神经退行性疾病的进展。
综上,本研究为异槲皮苷抗AD 的深入研究提供了一定的理论依据。但本研究尚有不足之处,线虫体内Aβ蛋白的表达水平及其聚集形态的观察指标还需要进一步研究。
