汗孔角化症三例散发患者基因突变分析
2023-11-21侴梦微郝阳阳连炜炜杨建强
侴梦微 郝阳阳 连炜炜 陈 茜 杨建强
湖州市第一人民医院皮肤科,浙江湖州,313000
汗孔角化症(porokeratosis,PK)是一种少见的遗传异质性疾病,多为常染色体显性遗传,以具有堤状边缘隆起的萎缩性斑块或斑块为特征,称为角状板层[1-3]。根据皮损大小、部位、数量等可分为斑块型汗孔角化症、浅表播散型汗孔角化症、光化性播散性浅表性汗孔角化症、角化过度型汗孔角化症、线性汗孔角化症等多种类型。汗孔角化症确切的发病机制尚不清楚,可能与MVK、MVD、PMVK、FDPS、SSH1、ARPC3、SLC17A9、SART3共8个基因的突变有关,紫外线照射和免疫抑制、药物、感染、创伤等可诱发或加重本病[2-4]。本研究针对3例汗孔角化症患者进行基因检测分析突变基因。
1 资料与方法
1.1 临床资料 患者1,女,34岁,面部散在环状褐色斑块(图1a)10余年,诊断为斑块型汗孔角化症。患者2,男,54岁,患者儿时起躯干即出现散在圆形或类圆形褐色斑块(图1b、1c),逐渐累及躯干、面部、四肢,诊断为播散性浅表性汗孔角化症。患者3,女,21岁,四肢等暴露部位散在环形皮损(图1d)5年,诊断为光化性播散性浅表性汗孔角化症。诊断均经临床和组织病理、皮肤镜检查确诊(图2、3)。患者1、2无其他系统疾病,患者3合并银屑病(轻度,外用药物控制可,未经紫外线光疗)。3例患者为散发病例,直系亲属未发现汗孔角化症。本研究均经患者知情同意。

1a:患者1面部散在环状褐色斑块;1b、1c:患者2躯干散在圆形或类圆形褐色斑块;1d:患者3下肢散在环形皮损
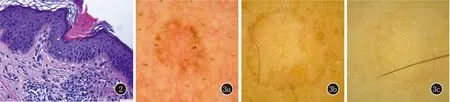
图2 局灶鳞状上皮细胞角化不全柱,角化不良细胞,真皮浅层慢性炎细胞浸润(HE,×100) 图3 皮肤镜(偏振模式,×50) 3a~3c:均可见双轨征;3a、3b:黑褐色色素颗粒沿皮损边缘分布
1.2 方法
1.2.1 DNA提取 采集患者外周血5 mL进行基因组DNA提取,基因组DNA经Covaris超声波破碎仪随机打断成长度为150~250 bp的片段,经末端修复和加A尾后在片段两端连接上Y字型接头制备成DNA文库。带有不同index标记的DNA文库pooling后与带有生物素标记的探针进行液相杂交,然后用包被有链霉亲和素的磁珠将待测基因的全部外显子捕获下来,经PCR线性扩增后进行文库质检,合格的文库即可进行高通量测序。
1.2.2 探针设计与合成 使用的探针由罗氏合成,平均测序深度达100×以上,Q30>90%。
1.2.3 数据分析与解读 使用BWA、Samtools和Picard软件将测序数据比对到人类参考基因组(GRCh37/hg19)。生成的bam文件采用GATK系列软件进行局部重新比对,去除重复序列后检出变异,使用Annovar对vcf变异文件进行变异注释。致病变异筛选:(1)筛选出ExAC_EAS、1000Genomes等数据库中未见正常人携带或携带率小于1%的变异;(2)筛选出编码区上的非同义突变、剪接突变等;(3)参考dbSNP、OMIM、HGMD、ClinVar等多种数据库对变异位点的评估;(4)参考Scsnv、Revel等软件对变异位点的预测;(5)参考SIFT、LRT、Polyphen2、FATHMM和MutationTaster等软件对变异导致蛋白功能改变的预测;(6)结合先证者的表型根据ACMG遗传变异分类标准与指南进行变异筛选。
1.2.4 Sanger测序验证 针对筛选到的与先证者表型相符的变异位点,设计PCR引物,扩增目的片段测序验证。
2 结果
三例患者均检测MVD基因杂合突变。患者1 MVD基因错义突变(c.875A>G)导致肽链第292个氨基酸由天冬酰胺突变为丝氨酸(p.Asn292Ser)。患者2 MVD基因错义突变(c.746 T>C)导致肽链第249个氨基酸由苯丙氨酸突变为丝氨酸(p.Phe249Ser)。患者3 MVD基因错义突变(c.746 T>C)导致肽链第249个氨基酸由苯丙氨酸突变为丝氨酸(p.Phe249Ser),同患者2。3例患者突变基因及位点均为已报道PK致病基因及位点,未检测到其他PK相关致病基因(图4)。
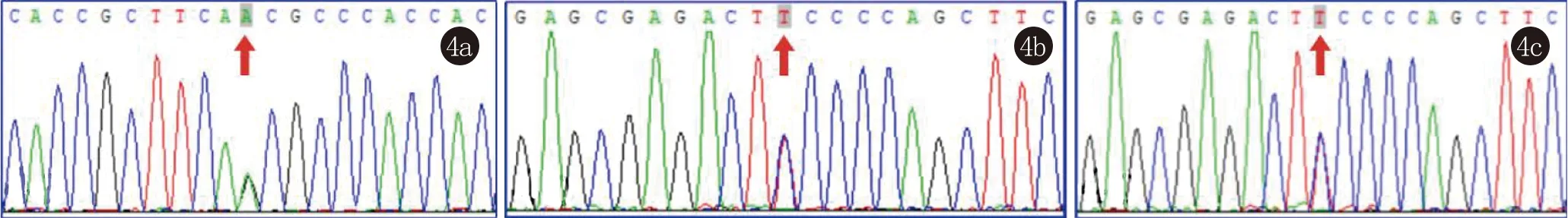
图4 4a: 错义突变(c.875A>G,p.Asn292Ser);4b:错义突变(c.746 T>C,p.Phe249Ser);4c:错义突变(c.746 T>C,p.Phe249Ser)
3 讨论
汗孔角化症(porokeratosis,PK)是一种具有常染色体显性遗传倾向的少见皮肤病,累及小汗腺[5]。PK在男性中更常见,皮损可累及周身任何部位(黏膜受累罕见)[5]。根据PK临床表现和累及部位等不同,可分为多种临床分型。包括经典型(Mibelli型汗孔角化症、浅表播散型PK、光化性浅表播散型PK、线状型PK、点状型PK、掌跖泛发性型PK)和非经典型(巨大汗孔角化症、播散性发疹型PK、疣状汗孔角化症、日光性面部汗孔角化症、汗孔角化瘤)[6]。
汗孔角化症的发病机制目前多认为与局部和全身的免疫抑制导致免疫监视的减少有关,还有角质形成细胞异常凋亡[5]。先天性或获得性免疫缺陷、器官移植、丙型肝炎、肝功能衰竭、慢性肾功能衰竭和其他与免疫抑制相关的疾病,生物疗法、光疗(紫外线照射)、放化疗都和PK的发生、发展相关[2,7]。光疗多导致光线性浅表播散型PK[2],光疗也是银屑病的一种治疗方法。国内外均有PK合并银屑病的报道,PK和银屑病可以同时或先后出现,本文中患者3就是先患银屑病,后出现PK。PK与银屑病发病机制有一定相关性,过度增殖的角蛋白mRNAs(16、6A、6B和17)、S-100钙结合蛋白(A7-A11)和缝隙连接蛋白(连接蛋白26和30)均在两种疾病中表达上调[2,8]。
随着致病基因研究的深入,发现8个基因的突变会导致PK发生,包括甲羟戊酸激酶(MVK)、磷酸甲羟戊酸激酶(PMVK)、异戊二烯焦磷酸异构酶(FDPS)、5 焦磷酸甲羟戊酸脱羧酶(MVD)、肌动蛋白相关蛋白复合物 3(ARPC3)、弹弓蛋白磷酸丝切酶(SSH1)、鳞状细胞癌抗原(SART3)和溶质运载蛋白家族 17 中第 9 成员(SLC17A9)[9,10]。最新研究发现PK患者存在HMGCR基因突变,提示甲羟戊酸代谢途径上的所有基因均可能(MVK、PMVK、MVD、FDPS、HMGCR)与PK有关[11]。
MVD基因编码甲羟戊酸焦磷酸脱羧酶,位于染色体16q24.3。MVD突变导致的PK 皮损直径小于2 cm,年龄跨度大(发病年龄5~70岁),可特异性表现为日光性面部汗孔角化症[6]。c.875A>G和c.746T>C是 MVD 中的热点突变 ,c.746T>C为最常见的突变[3,4,9]。有报道MVD突变 c.746T>C (p.Phe249Ser) 存在不完全外显率,这提示特定的触发因素,如MVD突变的二次打击可能是汗孔角化症发作所必需的[1,3]。
本研究3例PK患者均为MVD基因突变。患者1为MVD基因错义突变(c.875A>G);患者2、患者3均为MVD基因错义突变(c.746 T>C)。再次验证了这两个突变位点为MVD基因中的热点突变。MVD突变导致的PK患者年龄范围很大,本研究中患者年龄为21~54岁,也符合这一特点。
基因型与临床表型有一定关系。30%~50%MVK突变PK患者表现为巨大斑块型疣状PK,MVK突变患者的皮损数量和面积最多,FDPS突变患者一般皮损数量大于500个,直径小于1 cm,既往认为生殖器部位的PK仅与PMVK有关,但有研究报道MVK、FDPS突变也可表现为生殖器PK[9,11]。目前依据已知的突变基因或区域在在线人类孟德尔遗传数据库(OMIM数据库)中将PK分为9个基因型[10],每一型可有不同临床表型。MVD目前被报道有10种突变位点(c.875A>G、c.746T>C、c. 302C>G、c. 383C>T、c. 482G>T、c. 678 + 1G>T等),临床表型可相同或不同[12]。本研究中患者2和患者3突变基因及位点均相同,但临床表型却不同,体现了基因多效性。
皮肤镜也可以用来观察PK。“双轨征”是PK的特征性结构,即皮损外围白色至黄色、褐色不等的环状角化过度结构,对应于临床上堤状隆起边缘和组织病理中的角化不全柱[13,14]。本研究3例患者接受皮肤镜检查,均见“双轨征”,可见黑褐色色素颗粒沿皮损边缘分布,对应病理中真皮浅层色素改变,与以往报道相符[13]。
PK作为少见皮肤病,目前对疾病的认识上有不足,大部分患者呈常染色体显性遗传倾向,可检测到突变基因。但临床中也确有部分PK患者未检测到基因突变。可能是致病基因位于非编码区或为后天获得性免疫抑制所致PK等原因。这都需大样本的研究。本研究3例患者均为散发病例,再次验证了MVD是PK的常见突变基因,c.746 T>C、c.875A>G是其热点突变。有助于今后临床诊断或遗传咨询工作的开展。
