肝细胞癌患者癌组织CK7和Glypican-3表达及其临床意义探讨*
2023-11-18杨婉,丁莉,罗珂,刘美
杨 婉,丁 莉,罗 珂,刘 美
原发性肝癌(PLC)中肝细胞癌(HCC)约占80%~90%,是临床常见的恶性肿瘤类型,发病率在全球常见癌症中居第六位,在癌症死因中居第三位,而我国由于乙型肝炎病毒(HBV)感染率较高,系肝癌高发区,肝癌发病率占全球发病患者近一半[1]。由于起病往往较为隐匿,HCC早期往往症状不明显,确诊时多数患者已达到局部晚期或出现远处转移,预后很差[2]。寻找评估肿瘤状态和判断预后的生物标志物是目前HCC防治研究的热点和难点[3]。细胞角蛋白(cytokeratin,CK)以中间丝蛋白形式参与细胞骨架形成。细胞角蛋白7(cytokeratin 7,CK7)是一种低分子角蛋白标记物,主要标记腺上皮和移行上皮,在不同肝脏发育阶段呈分化性表达差异,与肝细胞恶性程度关系密切[4]。磷脂酞肌醇蛋白聚糖-3(glypican-3,GPC3)是细胞膜表面的一种硫酸乙酰肝素糖蛋白,可通过磷脂酰糖基锚定于细胞膜表面,影响细胞增殖和分化。此外,GPC3可通过结合细胞外基质和生长因子等影响肿瘤的形成及转移[5,6]。本研究检测了HCC组织CK7和GPC3表达水平,分析了它们与组织病理学特征以及预后的关系,现报道如下。
1 资料与方法
1.1 一般资料 2018年4月~2022年1月我院诊治的HCC患者219例,男178例,女41例;年龄为42~79岁,平均年龄为(62.7±8.6)岁。其中乙型肝炎187例,丙型肝炎13例。诊断符合《原发性肝癌规范化病理诊断指南》的标准[7],巴塞罗那(Barcelona Clinic Liver Cancer,BCLA)分期为B期113例,C期106例;术后病理学检查发现血管侵犯78例;门脉癌栓形成81例;肝外转移37例。排除标准:合并其它恶性肿瘤、血液系统疾病,合并心、脑、肺、肾等严重器质性功能异常,合并甲状腺功能亢进症,合并人类免疫缺陷病毒感染。患者及其家属签署知情同意书,本研究经我院医学伦理委员会审核、通过。
1.2 肝叶切除术 常规开展开腹肝叶切除术。
1.3 组织CK7和GPC3表达检测 取肝癌组织和癌旁组织,石蜡包埋、4μm切片,60℃烘烤20 min,二甲苯脱蜡,梯度酒精脱水,PBS清洗,去离子水冲洗,加入H202阻断10 min,PBS清洗,抗原热修复,再次PBS清洗。将切片置于10%BSA下室温孵育5 min,非特异性位点封闭。分别加入抗CK7鼠抗人多克隆抗体或抗GPC3鼠抗人多克隆抗体(美国Immuno Way公司),4℃孵育过夜,PBS清洗。滴加HRP标记的SP(北京中杉金桥生物技术公司),37℃孵育30 min,PBS清洗,DAB显色10 min,PBS清洗,加苏木素复染,盐酸酒精分化,脱水10 min,封片,镜下观察。在高倍镜下随机选择5个视野,CK7主要定位于细胞质,GPC3主要定位于细胞质和细胞膜。依据阳性细胞染色强度和比例进行评估。着色情况:无、淡黄、棕黄和棕褐色分别计为0分、1分、2分和3分;阳性细胞比例:阴性、1%~25%、26%~50%、51%~75%和76%~100%分别计为0分、1分、2分、3分和4分。以着色程度与阳性细胞比例的乘积判定,<6分代表阴性,≥6分代表阳性。
1.4 随访 所有入选患者在接受手术切除治疗后,随访1年。定期检测血清甲胎蛋白(AFP)水平和腹部超声检查。当发现肝内存在可疑性占位性病灶时,则进一步行腹部 CT或/和MR检查。
1.5 统计学方法 应用SPSS 26.0软件进行统计学分析,计数资料以%表示,采用x2检验或Fisher精确概率计算,应用Kaplan-Meier曲线和Log Rank检验分析患者1 a生存率的差异,P<0.05为差异有统计学意义。
2 结果
2.1 癌组织和癌旁组织CK7和GPC3表达阳性率比较 癌组织CK7和GPC3阳性表达率显著高于癌旁组织(P<0.05,图1和表1)。
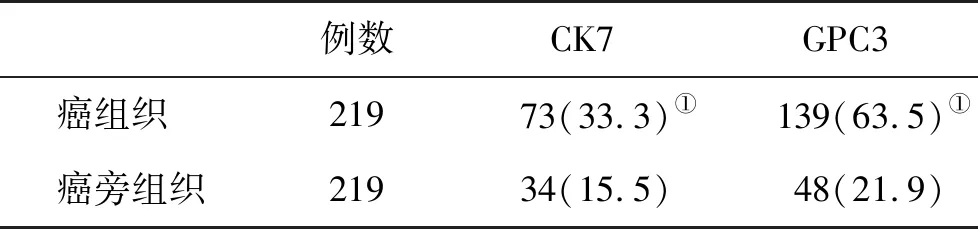
表1 癌组织与癌旁组织CK7和GPC3阳性率(%)比较
2.2 不同临床和病理学特征的癌组织CK7和GPC3表达阳性率比较 不同肿瘤直径、肿瘤数目和肝硬化患者癌组织CK7和GPC3阳性表达率比较,差异无显著性统计学意义(P>0.05);低分化肿瘤、BCLC C期、有血管侵犯、有癌栓形成和有肝外转移患者癌组织CK7和GPC3阳性表达率显著高于中高分化、BCLC B期、无血管侵犯、无癌栓形成或无肝外转移组织(P<0.05,表2)。

表2 不同临床和病理学特征癌组织CK7和GPC3阳性率(%)比较
2.3 癌组织CK7和GPC3阳性与阴性的HCC患者生存分析 随访1年,HCC患者生存166例(75.8%),死亡53例(24.2%);随访发现,癌组织CK7阴性患者1 a生存率为80.1%(117/146),显著高于CK7阳性患者的67.1%(49/73,P<0.05,图2);癌组织GPC3阴性患者1 a生存率为85.0%(68/80),显著高于GPC3阳性患者的70.5%(98/139,P<0.05,图3)。

图2 癌组织CK7阳性与阴性患者1a生存率比较

图3 癌组织GPC3阳性与阴性患者1 a生存率比较
3 讨论
CK是角质细胞主要骨架蛋白,作为中间丝于所有上皮细胞和部分非上皮细胞中存在,维持上皮组织的完整性和连续性,在上皮源性肿瘤异常表达,可作为辅助诊断肿瘤的指标之一[8-10]。CK7是CK的一个亚型,分子量为54 kDa,是一种碱性细胞角蛋白,于正常组织腺上皮和移行上皮细胞表达,如肺、子宫内膜、乳腺等均可呈阳性表达,而一般在非上皮来源细胞,如正常血液和骨髓则无表达[11]。卵圆细胞为肝脏干细胞,其分化过程及其机制复杂,具有多向分化潜能。在正常肝脏,干细胞可迁移进入肝实质,分化为肝细胞,但在致癌环境的作用下可异常分化为HCC[12]。CK7为肝卵圆细胞表达水平相对较高的标志物。本研究显示HCC癌组织CK7阳性表达率显著高于癌旁组织。当卵圆细饱向正常肝细胞分化时,CK7表型被抑制,即呈阴性表达;当细胞癌变时,则可表现出干细胞的某些表型,如CK7阳性表达[13]。此外,本研究显示CK7阳性表达与细胞分化程度、BCLC分期、血管侵犯、癌栓形成和肝外转移均有一定的关系。CK7阳性率随分化程度降低、BCLC分期增高、血管侵犯、癌栓形成和肝外转移呈升高态势,提示CK7参与了HCC进展。 CK7在正常肝细胞中不表达,仅于胆管细胞表达。当发生癌变时,癌细胞重新表达CK7,且其表达水平随细胞分化程度增加而降低。肿瘤细胞在侵袭转移过程中细胞外基质屏障被破坏,CK7分子可与基底膜重要成分层黏连蛋白结合,触发免疫反应,破坏基底膜,可能是CK7高表达下肿瘤侵袭性增加的重要机制之一[14]。本研究结果显示CK7阴性表达的HCC患者术后1 a生存率为80.1%,显著高于CK7阳性表达患者的67.1%。癌组织CK7高表达可在一定程度上预示患者预后不良。既往研究显示[15]影响HCC预后的主要病理学因素有肿瘤大小、肝内和肝外转移、门静脉癌栓形成、包膜侵犯和肝硬化等。CK7阳性表达的肝癌细胞分化程度低,发生门静脉癌栓的几率大,更容易出现肝外转移,导致患者生存期大大缩短。
GPC3是一种硫酸类肝素糖蛋白聚糖,在生物体内分布具有明显的组织特异性和组织分化时相特异性。在成人,除胎盘组织GPC3呈现高表达外,仅于肾脏、心脏、肺脏和卵巢等少数组织呈现低水平表达,正常肝组织则无GPC3表达。GPC3在肿瘤细胞生长、分化和转移过程中发挥重要作用[16,17]。研究显示[18],GPC3在HCC组织表达明显强于肝硬化、不典型增生和局灶性结节性增生组织。本研究采用免疫组化法检测了手术切除的肝癌组织和其对应的癌旁组织,结果显示肝癌组织GPC3蛋白表达较为广泛,其表达阳性率为63.5%,显著高于癌旁组织的21.9%。GPC3参与Wnt信号转导。经典Wnt信号通路激活与HCC发生发展关系密切。GPC3增加细胞膜上Wnt水平,促进 Wnt与卷曲蛋白受体结合,增强Wnt信号转导,诱导转录因子β-联蛋白迁移到细胞核,驱动多个基因表达,促进细胞增殖,刺激肝癌细胞生长,促进恶性转化。GPC3参与HCC组织胰岛素样生长因子、转化生长因子β、刺猬刺激分子、成纤维细胞生长因子和骨形成蛋白等,上调生长因子及其受体间的作用,引起肝细胞持续增殖,导致肝细胞恶性转化[19,20]。经Kaplain-Maier法描绘生存曲线,比较GPC3阳性与阴性表达患者生存率的差异,结果显示阳性表达患者1 a生存率显著低于阴性表达患者。GPC3可能是HCC发生发展过程中的关键分子,细胞表面锚定的GPC3可作为某些生长因子的辅助因子,促进信号转导的高效运行,促进了细胞转化。
