ICIs联合TKIs治疗HBV相关肝细胞癌患者疗效研究*
2023-11-18于双杰李元元毕京峰福军亮宓余强
于双杰,李元元,毕京峰,福军亮,宓余强
原发性肝癌(PLC)是常见的消化系统恶性肿瘤。根据GLOBOCAN2020研究估计和相关文献分析,PLC在全球和我国是第6位最常见的恶性肿瘤,是第2位导致癌症死亡的原因[1,2]。 到2040年,PLC发病和死亡人数可能仍会增加,给全球带来极大的疾病负担[3]。根据病理学划分,肝细胞癌( HCC) 占 PLC的75%~85%[4]。由于肝癌起病隐匿,乙型肝炎病毒(HBV)感染引起的肝硬化是我国肝癌最为重要的危险因素[5]。首次诊断时只有不到30%肝癌患者适合接受根治性治疗,系统抗肿瘤治疗在中晚期肝癌的治疗过程中发挥重要的作用。目前,应用信迪利单克隆抗体联合贝伐珠单克隆抗体类似物已在我国被批准用于既往未接受过系统抗肿瘤治疗的HCC患者的一线治疗方案[4]。程序性死亡-1(PD-1)免疫检查点抑制剂(ICIs)和酪氨酸激酶抑制剂(TKIs)联合治疗HCC患者显著延长了生存期,但究竟哪些因素会影响预后成为临床关注的焦点。已有相关研究探讨了影响HCC患者治疗疗效的因素包括患者年龄、性别、美国东部肿瘤协作组(ECOG)评分[6,7]、不同Child-Pugh分级、腹水、乙型肝炎相关HCC、血清AFP水平、白蛋白(ALB)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、总胆红素( TBIL)和淋巴结转移等[8-10]。在先前探索血清AFP变化预测索拉非尼治疗晚期HCC患者疗效效能的多因素分析发现[11],治疗后血清AFP水平降低与更好的无进展生存期(PFS)显著相关。在接受过一线索拉非尼治疗后应用雷莫芦单抗(ramucirumab,REACH-2)治疗HCC患者的3期临床试验显示,血清AFP应答被证明能预测疗效[12]。对于ICIs联合TKIs治疗不可切除的HCC患者预后的因素研究报道还较少。我们应用ICIs联合TKIs治疗HBV相关的不可切除的HCC患者,观察了血清AFP水平变化及其对预后的影响。
1 资料与方法
1.1 病例来源 2019年9月~2022年1月解放军总医院第五医学中心北院区住院治疗的HCC患者44例,男性36例,女性8例;年龄为 32~73岁,平均年龄为55±6岁。经组织病理学或动态增强磁共振成像(MRI)、动态增强电子计算机断层扫描(CT)和超声造影(CEUS)等检查诊断,并符合HCC的诊断标准[5]。病理学诊断参照WHO发布的2010年版标准,在慢性肝病背景评估基础上,重点分析肿瘤细胞分化、特殊细胞类型、生长方式等,明确诊断为HCC。动态增强MRI、CT或CEUS显示有动脉期病灶明显强化、门脉或延迟期强化减退的“快进快出”肝癌典型特征,血清HBsAg或HBV DNA阳性,AFP升高或正常。纳入存在门脉癌栓或骨转移行放射治疗或对HCC病灶行姑息性肝动脉栓塞治疗、巴塞罗那临床分期(BCLC)C期或不适合根治性手术或局部治疗B期[13]、基线ECOG评分为0分或1分、Child-Pugh A级或B级患者。排除标准: ①合并自身免疫性肝病、丙型肝炎病毒(HCV)感染及酒精性肝病;②有肝移植史;③内窥镜评估发现严重的静脉曲张或因门静脉高压伴出血高风险的证据;④细菌性腹膜炎等感染或肝性脑病;⑤在第1次给药前曾接受过任何单克隆抗体、放射、免疫抑制剂或局部治疗或中药治疗。本研究获得解放军总医院第五医学中心医学伦理委员会批准(伦理号:KY-2023-7-45-1)。所有患者已签署知情同意书。
1.2 治疗方法 给予所有患者ICIs抑制剂信迪利单抗注射液[信达生物制药(苏州)有限公司,批号:S20180016]200 mg 加入0.9%氯化钠溶液100 ml中静脉滴注,于每个周期第1 d应用,每3周为一个治疗周期;卡瑞利珠单抗注射液(苏州盛迪亚生物医药有限公司,批号:S20190027)3 mg.kg-1,加入0.9%氯化钠溶液100 ml中静脉滴注,于每个周期第1 d应用,每3周为一个治疗周期;替雷利珠单抗注射液[百济神州(上海)生物科技有限公司,批号:S20190045] 200 mg加入0.9%氯化钠溶液100 ml中静脉滴注,于每个周期第1 d应用,每3周为一个治疗周期;给予患者仑伐替尼(卫材药业有限公司,批号: H20180052)8 mg(<60千克体质量)或12 mg(≥60 千克)口服,1 次/d。观察治疗过程中的不良反应,直至疾病进展,患者无法耐受其不良反应而停止联合治疗。同时,给予恩替卡韦或替诺福韦酯或丙酚替诺福韦治疗[14]。
1.3 疗效评定 采用改良的实体肿瘤疗效评价标准(mRECIST标准)评价疗效[15,16],完全缓解(CR):所有目标病灶动脉期增强扫描显影均消失;部分缓解(PR):目标病灶动脉期增强显影直径总和缩小≥30%;疾病进展(PD):目标病灶动脉期增强显影直径总和增加≥20%或出现新病灶;疾病稳定( SD):缩小未达PR或增加未到PD。客观缓解率(ORR)= (CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%
1.4 血清AFP检测 使用德国罗氏Cobas 801全自动电化学发光免疫分析仪检测血清AFP(罗氏诊断公司)。
1.5 统计学分析 应用SAS 9.4软件处理数据,对不符合正态分布的计量资料以M(IQR)表示,采用Wilcoxon秩和检验。计数资料采用卡方检验或Fisher精确概率计算。应用Log-Rank检验比较生存曲线。采取双侧检验,P<0.05为有显著性统计学差异。
2 结果
2.1 两组基线肿瘤资料比较 本组44例HCC血清AFP水平为396.5±78.3 ng/ml。以血清AFP≤20 ng/ml为正常组,AFP>20 ng/ml为升高组分组,结果血清AFP升高组存在下腔静脉癌栓[17,18]比例显著高于血清AFP水平正常组(P<0.05),两组其他肿瘤指标占比比较无统计学意义(P>0.05,表1)。
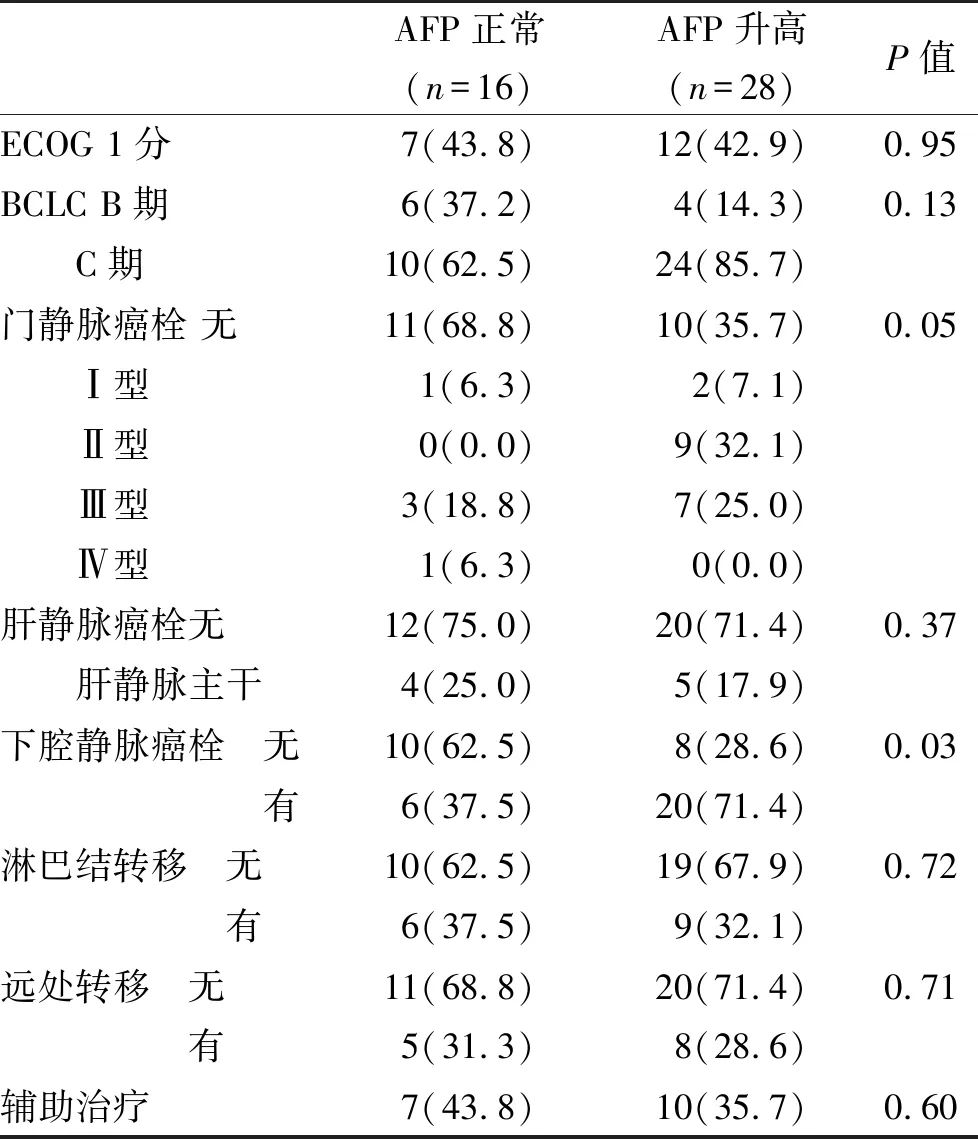
表1 两组基线肿瘤资料(%)比较
2.2 两组疗效情况 本组44例HCC患者治疗2~24个月,中位治疗时间为8(6,26)个月。血清AFP正常组和升高组各失访2例。截止到2023年7月,随访24(10,36)个月。两组疗效见表2。14例血清AFP正常组死亡4例,中位生存时间(mOS)为17.1(14.0,24.0)个月,血清AFP升高组死亡18例,中位生存时间为8.6(4.8,18.1)个月(P=0.01)。在血清AFP正常组中,1例死于肝性脑病和急性肾损伤,1例死于上消化道出血,1例死于上消化道出血和感染性休克,1例死于梗阻性黄疸和肝功能衰竭;在血清AFP升高组中,死于上消化道出血6例(胃溃疡出血3例、食管胃曲张静脉破裂出血3例),肝癌破裂出血3例,腹腔感染和感染性休克5例,肝性脑病和肺真菌感染1例,慢性肝衰竭2例,颅内出血1例。到目前为止,血清AFP正常组生存10例(71.4%),AFP升高组生存8例(30.8%,Log-Rank检验x2=8.54,P<0.001)。AFP升高组中1例PR患者肝内和肺部转移灶完全消失,纵隔旁转移淋巴结缩小(图1);AFP升高组中另1例CR患者巨块型肝癌明显缩小,16个月后对肝右叶上段前后交界处(S7/8)边缘两处小病灶行局部微波消融治疗并继续接受ICIs联合TKIs治疗7月,肝癌病灶呈坏死灶表现,门脉主干及其左右支癌栓强化充盈缺损消失,病情稳定(图2)。
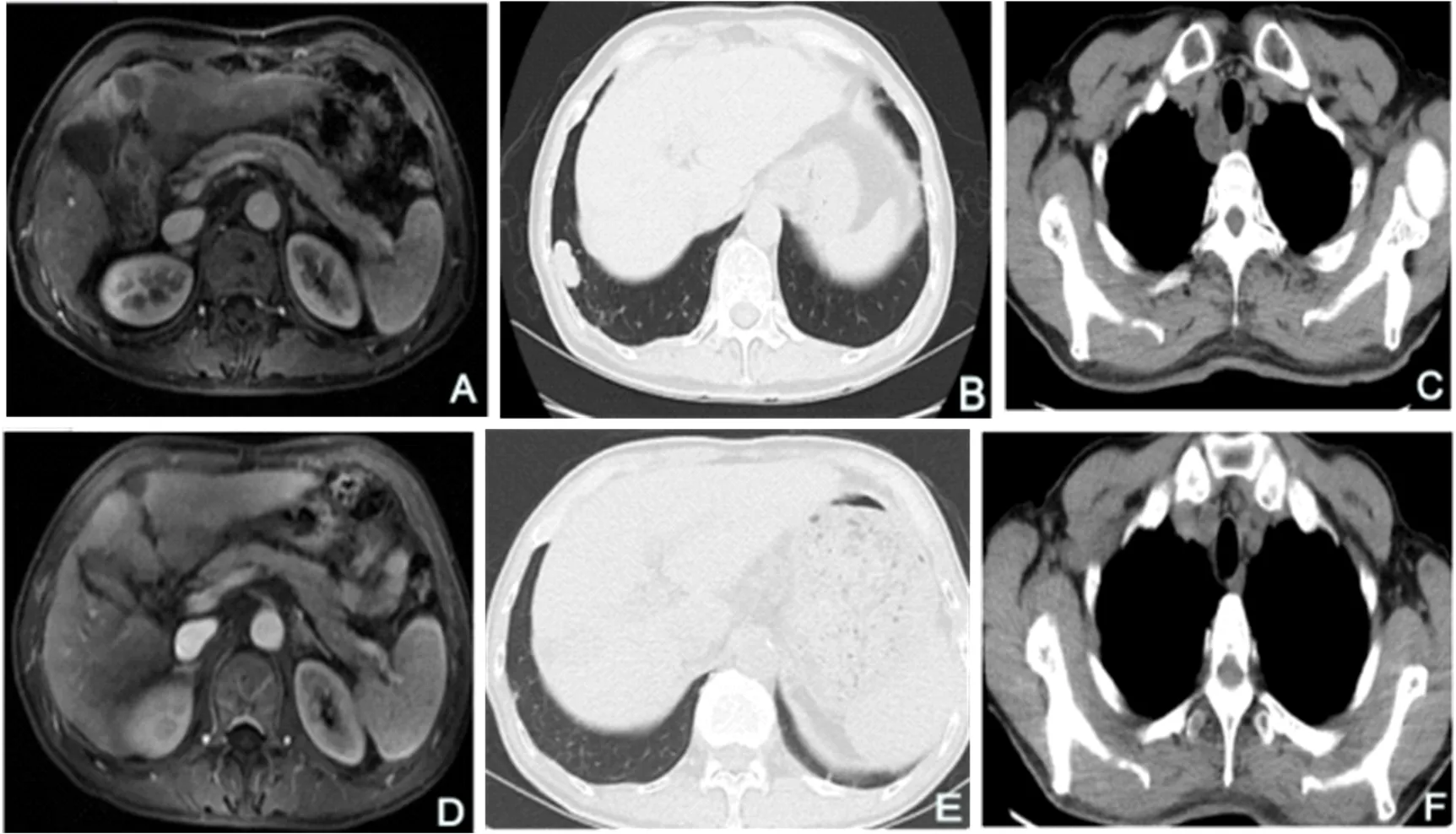
图1 HCC患者腹部MRI和肺部CT平扫表现
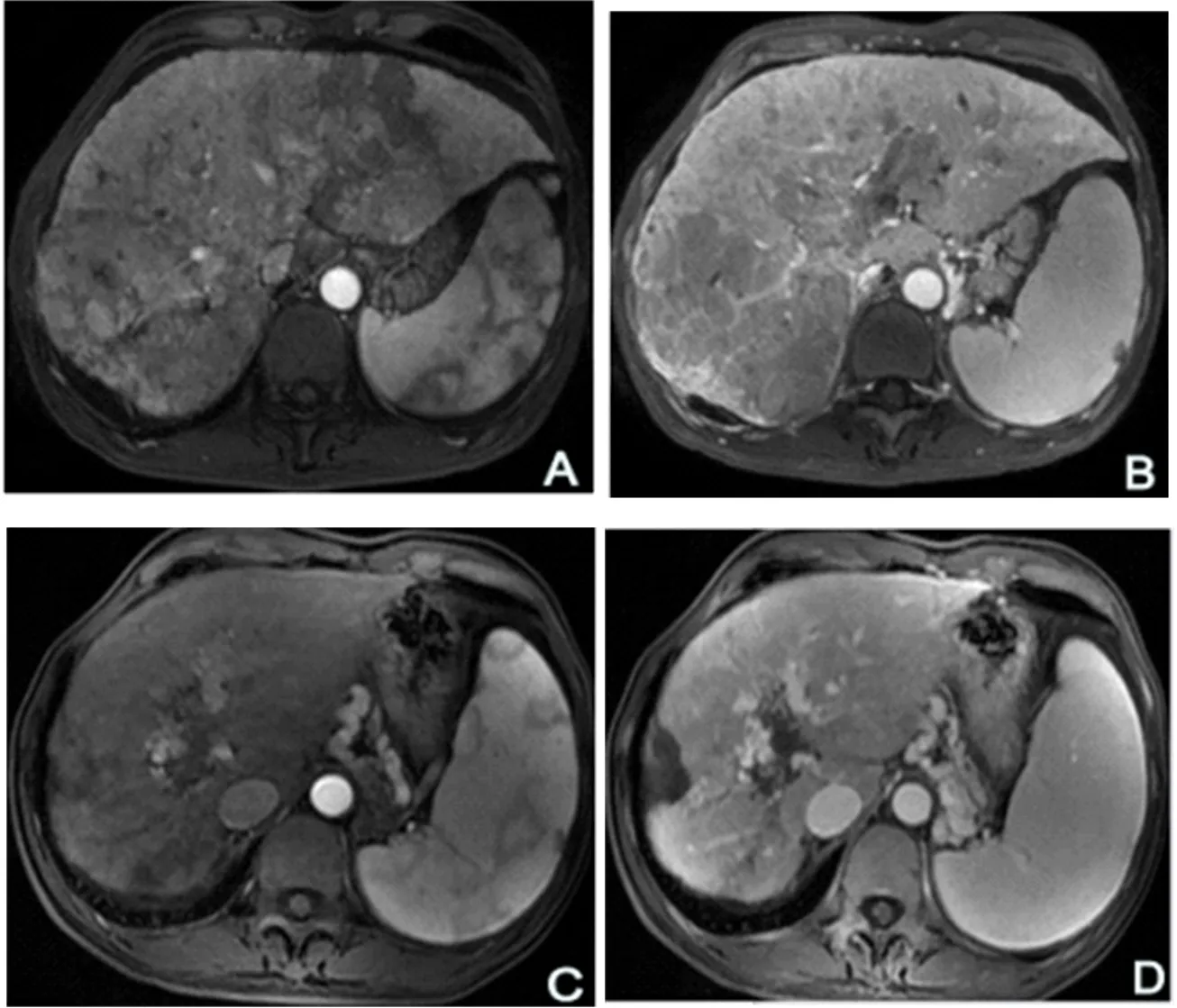
图2 HCC患者腹部MRI表现 实现CR
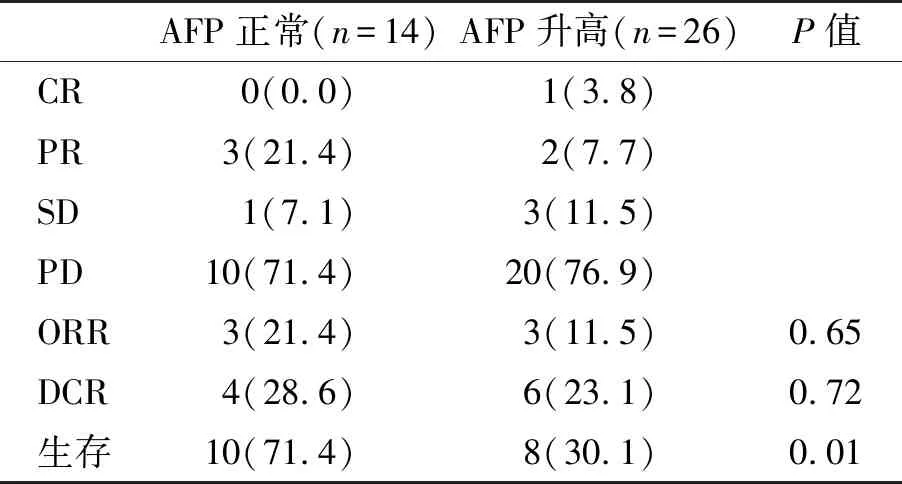
表2 两组疗效(%)比较
3 讨论
有报导以血清AFP水平分层有利于预测乙型肝炎相关HCC患者治疗预后[14]。应用仑伐替尼治疗基线AFP水平升高的晚期HCC患者,大多数在治疗4周时血清AFP水平持续降低,表现出更高的客观影像学应答[15]。在一项接受瑞戈非尼(regorafenib)治疗的HCC患者,基线AFP低于400 ng / ml与较长的OS和PFS独立相关[16]。48例基线AFP≥20 ng/ml的HCC患者接受索拉非尼联合卡瑞利珠单抗治疗后,AFP早期应答在预测疗效和预后方面具有较高的临床价值[17]。AFP早期应答组OS 为13.8个月,AFP早期无应答组为11.1个月。我们评估了基线AFP水平对应用ICIs联合TKIs治疗无法手术切除的HBV相关HCC患者预后的影响,结果提示血清AFP升高组病死率较高。
既往报道认为晚期HCC患者中位生存期较短,一般为确诊后 6~20个月[18]。对于晚期HCC患者存在骨转移、静脉癌栓、肾上腺转移等,经局部放疗等治疗,其生存期从5.5~10月不等[19,20]。在105例HCC伴有肺转移患者,在肝动脉栓塞化疗术、支气管动脉灌注化疗术、局部放疗和射频消融等治疗后,基线血清AFP水平升高对生存不利[21]。应用阿替利珠单抗联合贝伐珠单抗治疗晚期HCC患者中位总生存期为19.2个月,其中中国亚群患者中位总生存期达到24.0个月[22,23]。本研究采用ICIs联合TKIs治疗晚期HCC患者,获得了更长时间的生存获益,但血清AFP水平对治疗疗效的影响还需要进一步观察。