外源性马立克氏病病毒荧光定量PCR检测方法的建立
2023-11-18苏佳赵炜刘丹王嘉白洪旭吴华伟薛青红陈晓春
苏佳,赵炜,刘丹,王嘉,白洪旭,吴华伟,薛青红,陈晓春
外源性马立克氏病病毒荧光定量PCR检测方法的建立
苏佳,赵炜,刘丹,王嘉,白洪旭,吴华伟,薛青红,陈晓春
中国兽医药品监察所,北京 100081
【目的】为解决现有兽用生物制品外源性马立克氏病病毒(Marek’s disease virus, MDV)检验方法灵敏度低、检测时间长、鉴别性不强的问题,研究分别建立MDV血清1型(MDV serotype 1,MDV 1)和MDV血清3型(MDV serotype 3,MDV 3)毒株的实时荧光定量PCR检测方法,用于禽用生物制品纯净性控制。【方法】从NCBI下载MDV 1、MDV血清2型(MDV serotype 1,MDV 2)和MDV 3各毒株序列,进行核苷酸和氨基酸序列比对分析;分别针对MDV 1 CVI988毒株、MDV 3 FC126毒株的设计特异性引物和相应的Taqman探针,建立实时荧光定量PCR检测方法;分别构建相应的重组质粒作为阳性标准品,建立标准曲线,并评价所建立方法基因拷贝数检测的灵敏度;分别对其他禽用病毒类生物制品、毒种、MDV 2 SB-1毒株的全长质粒及生产原材料(SPF鸡胚尿囊液、胚体、尿囊膜、鸡胚成纤维细胞)进行检测,评价检测方法的特异性;分别对600、60、6、0.6、0.06、0.006、0.0006 PFU的CVI988毒株和FC126毒株进行检测,评价所建立方法检测活病毒粒子的灵敏度;分别以不同稀释度的阳性标准品质粒为模板,进行3次重复性检测,计算变异系数,分析所建立检测方法的可重复性。【结果】MDV在同一血清型内核苷酸和推导的氨基酸同源性达99.99%,具有很高的保守性,在不同血清型间核苷酸同源性只有约75%,推导的氨基酸同源性只有约85%;分别建立了MDV 1和MDV 3两种实时荧光定量PCR检测方法;MDV 1检测方法标准曲线的扩增效率E=98.8%,相关系数2=0.992,标准曲线方程=-3.351+38.828(=Ct,=lg(拷贝数)),MDV 3检测方法标准曲线的扩增效率E=95.0%,相关系数2=0.998,标准曲线方程=-3.447+36.496(=Ct,=lg(拷贝数));所建立的两种检测方法特异性好,MDV 1或MDV 3毒株扩增曲线良好,其他禽用病毒类生物制品、毒种、MDV 2 SB-1毒株的全长质粒及生产原材料未出现特异性扩增曲线;灵敏度高,MDV 1基因拷贝数检出限度为32.8拷贝/μL,至少可检出0.006 PFU的CVI988毒株,MDV 3基因拷贝数检出限度为10 拷贝/μL,至少可检出0.006 PFU的FC126毒株;重复性好,MDV 1检测方法重复性试验的变异系数小于1%,MDV 3检测方法重复性试验的变异系数小于1.5%。【结论】所建立的实时荧光定量PCR检测方法可分别用于禽用生物制品中外源性MDV1、MDV3毒株的检测。
马立克氏病病毒;实时荧光定量PCR;外源病毒;检测
0 引言
【研究意义】生物制品生产过程中涉及的动物源性原辅材料,如生产用动物、细胞、培养基、血清、胰酶等,都容易引入外源微生物,特别是病毒[1-2],而外源病毒的污染,不仅给生物制品生产企业带来重大经济损失,还会影响疫苗免疫效力,甚至引发新的疫情,给下游生物制品使用企业造成灭顶之灾[3-4]。实时荧光定量PCR是近年来发展起来的新型PCR技术,不仅可以定性分析,还可以对检测样品进行定量分析,具有灵敏度高、特异性强、检测迅速、重复性好等优点,已广泛应用于多种病原的检测[5-8]。建立MDV实时荧光定量PCR检测方法,进而用于禽源生物制品外源性MDV的检测,对于禽源生物制品质量控制、MDV实验室分子生物学诊断等将有重要的实际临床价值。【前人研究进展】马立克氏病是鸡的一种常见的恶性淋巴细胞增生性疾病[9-10],该病的病原MDV属于α疱疹病毒亚类的属,根据病毒的血清学反应,分为MDV 1、MDV 2和MDV 3合计3个血清型(https://talk.ictvonline.org/ taxonomy/),其中MDV 1是指具有不同致病性的野毒株,MDV 2为从健康鸡只分离得到的非致病毒株,MDV 3则是从健康火鸡分离得到的非致病毒株,又称为火鸡疱疹病毒[11-13]。现有外源性MDV检验方法主要是通过鸡胚法观察尿囊膜病变、细胞法检查细胞病变、鸡检查法通过琼脂扩散试验测定抗体[14]。但随着兽用生物制品品种的不断增加和生物技术的不断进步,现有的外源性MDV检验国家标准已不能完全满足检验、检测的需求。主要表现在两个方面:一是方法灵敏度问题,如鸡检查法中MDV采用琼脂扩散试验进行抗体检测,灵敏度低、稳定性差、检测时间长、不同来源检测抗原反应性差异较大;二是方法的鉴别性不强,如不同血清型MDV相互污染时,无法进行外源性MDV的鉴别。分子生物学相关检测技术已广泛应用于多种病原的检测,欧洲药典已将PCR方法描述为参考技术,并对待检材料类型、检测过程及结果判定做了详细的质量要求,只要符合相关质量要求,便可使用PCR作为替代检测方法[15-17]。而在国际贸易指定试验中,PCR方法也已经广泛使用,如世界动物卫生组织已将检测蓝舌病病毒、非洲猪瘟病毒、牛传染性鼻气管炎病毒等病毒的PCR方法列为国际贸易指定试验方法[18]。此外,国家市场监督管理总局、国家标准化管理委员会最新发布的中华人民共和国国家标准,将普通PCR方法、实时荧光定量PCR方法及荧光RAA方法等分子生物学检测技术纳入非洲猪瘟诊断技术[19]。【本研究切入点】目前禽用生物制品中,外源性MDV检测国家标准中并无分子生物学相关的检测技术。MDV编码的蛋白与、和分别编码的VP23、preVP22a和VP19c蛋白是病毒核衣壳的重要组成成分[20],不同血清型内MDV毒株的在核苷酸和氨基酸序列上具有很高的保守性[21]。【拟解决的关键问题】以MDV的基因为靶标设计特异的引物和相应的探针,建立快速、灵敏、特异的MDV 1、MDV 3毒株实时荧光定量PCR检测方法,用于禽用生物制品外源性MDV污染的纯净性控制、MDV的快速诊断和定量检测。
1 材料与方法
本研究于2020年2月至2022年6月在中国兽医药品监察所完成。
1.1 试验材料
1.1.1 病毒 试验所涉及的禽用病毒类生物制品及毒种的来源见表1。
1.1.2 质粒 由于无MDV 2毒株,因此根据MDV 2 SB-1毒株全基因(序列号:HQ840738.1)合成其,连接至pMV载体,构建pMV-SB-1(UL19)质粒,作为特异性研究材料。
1.1.3 实验动物 8日龄SPF鸡胚,购自北京勃林格殷格翰维通生物技术有限公司。
1.1.4 主要试剂与仪器 病毒基因组DNA/RNA提取试剂盒(DP 315)购自天根生化科技有限公司,TaqMan™ Fast Advanced Master Mix(4444557)购自美国ABI公司,E.Z.N.A胶回收试剂盒(D 2500)购自OMEGA公司,质粒中量提取PureYield TM Plasmid Midipre System试剂盒(A 2492)购自Promega公司,2×TransStart® GoldPfu PCR SuperMix(AS 401)、2×EasyTaq® PCR SuperMix (+dye )(AS 111)、pEASY- Blunt Cloning Kit(CB 101)、Trans1-T1 Phage Resistant Chemically Competent Cell(CD 501)购自北京全式金生物技术有限公司,CFX 96型荧光定量PCR仪购自美国BIO-RAD公司,NANORDROP LITE超微量核酸蛋白检测仪购自美国Thermo公司。
1.2 试验方法
1.2.1 不同血清型MDV序列比对分析及引物设计 下载GenBank上公布的MDV各血清型毒株序列,经核苷酸和氨基酸序列比对分析,针对MDV 1和MDV 3分别设计特异性引物及探针(表2)。引物和探针由北京六合华大基因科技有限公司合成。

表2 引物和探针
1.2.2 标准品质粒的制备 取病毒液200 μL,使用病毒基因组DNA/RNA提取试剂盒提取病毒核酸,进行PCR扩增,50 μL反应体系:上、下游引物(10 μmol·L-1)各1 μL,2×TransStart® GoldPfu PCR SuperMix 25 μL,模板3 μL,ddH2O 20 μL。PCR反应条件:94 ℃预变性5 min;94 ℃变性20 s,60 ℃退火20 s,72 ℃延伸20 s,35个循环;72 ℃终末延伸10 min。PCR产物经琼脂糖凝胶电泳鉴定,切胶纯化、回收目的DNA片段,将目的片段连接至pEASY-Blunt载体,转化Trans1-T1感受态细胞,通过菌液PCR鉴定获得阳性单菌落,提取质粒经测序验证正确后用作阳性标准品质粒。
1.2.3 实时荧光定量PCR方法的建立
①实时荧光定量PCR反应体系与反应条件的优化 参考TaqMan® Fast Advanced Master Mix推荐的反应体系和反应条件,将探针和引物分别稀释至终浓度为10 μmol·L-1,取0.2 μL以及0.4 μL的探针和0.2 μL、0.4 μL以及0.6 μL的引物棋盘式组合,进行实时荧光定量PCR试验,筛选出最优的探针浓度以及引物浓度;分别以55 ℃、60 ℃作为退火温度,进行实时荧光定量PCR试验,确定反应最优退火温度。
②标准曲线的建立及灵敏度测定 使用超微量核酸蛋白检测仪测定标准品质粒浓度,根据公式N=(质粒浓度(ng·μL-1)×10-9×6.02×1023)/(重组质粒碱基数×660)计算重组质粒拷贝数,其中MDV 1重组质粒拷贝数为3.28×108拷贝/μL,MDV 3重组质粒拷贝数为1×108拷贝/μL。分别将重组质粒10倍系列稀释后作为标准阳性模板,以优化的反应条件进行实时荧光定量PCR检测,确定其检测基因拷贝数的灵敏度,绘制标准曲线,并得出反应的扩增效率和曲线的相关性系数。
此外,分别取600、60、6、0.6、0.06、0.006、0.0006 PFU的MDV 1 CVI988病毒液和MDV 3 FC126病毒液,提取病毒基因组作为模板,用建立的相应实时荧光定量PCR检测方法进行检测,确定所建立方法检测活病毒粒子的灵敏度。
③特异性试验 对特异性研究样品,包括其他禽用病毒类生物制品、毒种(表1)、质粒pMV-SB-1 (UL19)及生产原材料(SPF鸡胚尿囊液、胚体、尿囊膜、鸡胚成纤维细胞)分别进行处理,方法如下:尿囊液、细胞、胚体、尿囊膜生产毒:用一定体积的生理盐水将样品溶解至100羽份/200 μL,12 000 r/min 4 ℃离心10 min,取上清;SPF鸡胚尿囊液:12 000 r/min 4 ℃离心10 min,取上清;鸡胚成纤维细胞(按照现行《中国兽药典》附录进行制备):取生长7d以上、面积75 cm2以上的鸡胚成纤维细胞,反复冻融3次后,12 000 r/min 4 ℃离心10 min,取上清;SPF鸡胚胚体、尿囊膜:剪取一定体积SPF鸡胚胚体或尿囊膜,加入5倍体积的生理盐水,在生物安全柜中研磨,将获得的匀浆反复冻融3次后,12 000 r/min 4 ℃离心10 min,取上清;取上述各样品200 μL,使用病毒基因组DNA/RNA提取试剂盒提取病毒基因组,质粒pMV-SB-1 (UL19)直接作为反应模板,同时用双蒸水作为阴性对照,采用所建立的实时荧光定量PCR方法进行检测。
④重复性试验 针对MDV 1以3.28×107—3.28×101拷贝/μL 10倍系列稀释的标准品质粒为模板,针对MDV 3以1×107—1×101拷贝/μL 10倍系列稀释的标准品质粒为模板,每个浓度的样品做3次重复性检测,计算变异系数,分析所建立的实时荧光定量PCR检测方法的可重复性。
2 结果
2.1 不同血清型MDV UL19序列比对分析
对不同血清型MDV的核苷酸和氨基酸序列进行MegAlign比对分析(表1),结果可见,MDV在同一血清型内核苷酸和推导的氨基酸同源性达99.99%,具有很高的保守性,在不同血清型间核苷酸同源性只有约70%,推导的氨基酸同源性只有约40%。因此,可以为靶标,设计不同血清型特异性检测引物和探针。
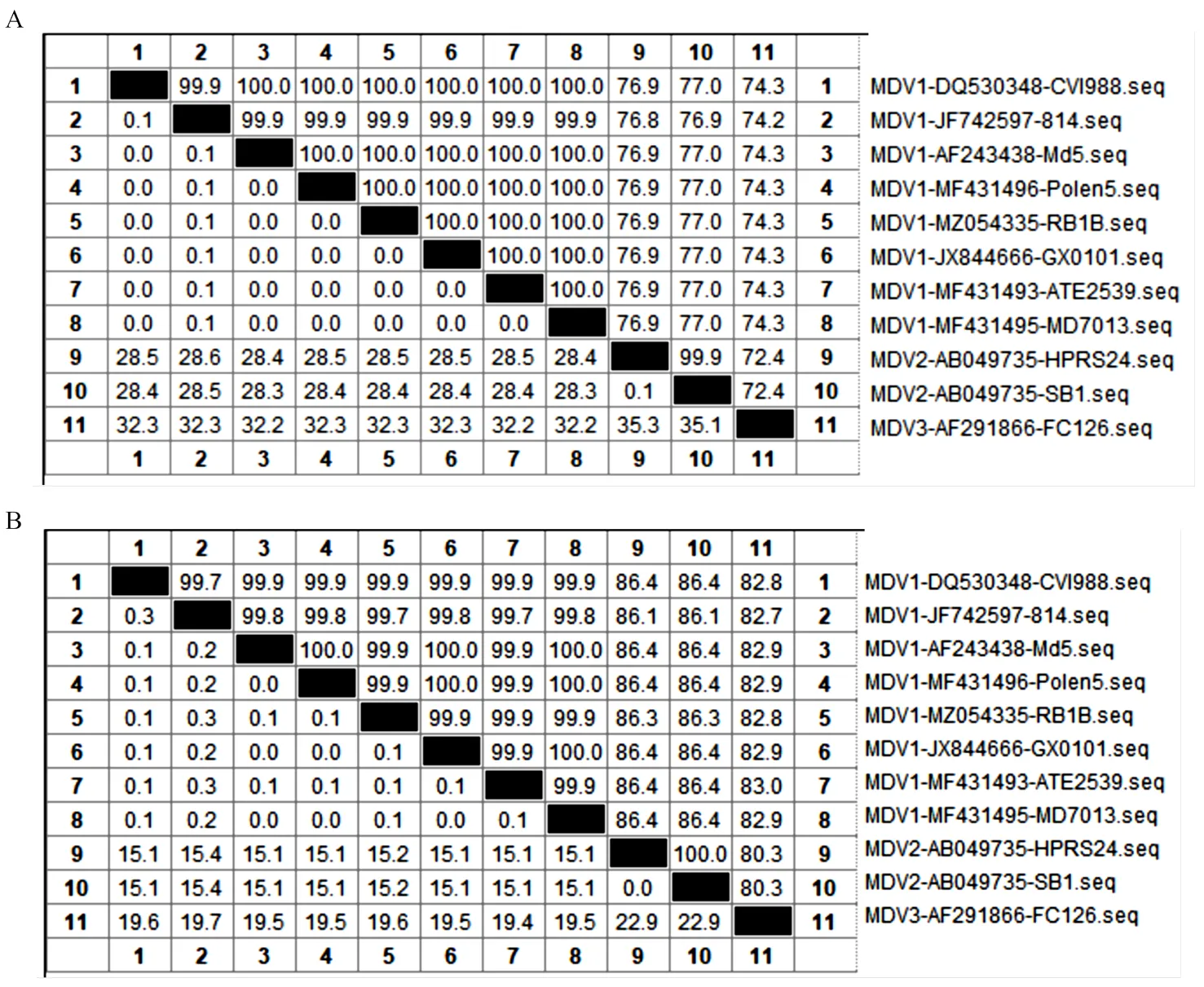
A:不同血清型MDV UL19基因核苷酸同源性分析;B:不同血清型MDV UL19基因推导的氨基酸同源性分析
2.2 实时荧光定量PCR方法反应体系与反应条件的建立
MDV 1及MDV 3实时荧光定量PCR方法中,探针(10 μmol·L-1)添加量为0.2 μL、上、下引物(10 μmol·L-1)添加量各为0.4 μL时,特异性扩增曲线效果最佳,Ct值也相对较小(图2-A和B红色扩增曲线所示);退火温度为55 ℃与60 ℃所产生的扩增曲线形态差异较小,退火温度为60 ℃时的Ct值略小于退火温度为55 ℃时(图2-C和D红色扩增曲线所示)。综合考虑Ct值、荧光强度,确定反应体系20 μL:TaqMan™ Fast Advanced Master Mix(2×)10 μL,上下游引物(10 μmol·L-1)各0.4 μL,探针(10 μmol·L-1)0.2 μL,模板2 μL,ddH2O 7 μL。反应条件:50 ℃ UNG酶孵育2 min,95 ℃聚合酶激活20 s;95 ℃变性3 s,60 ℃退火/延伸30 s,40个循环,收集荧光信号。
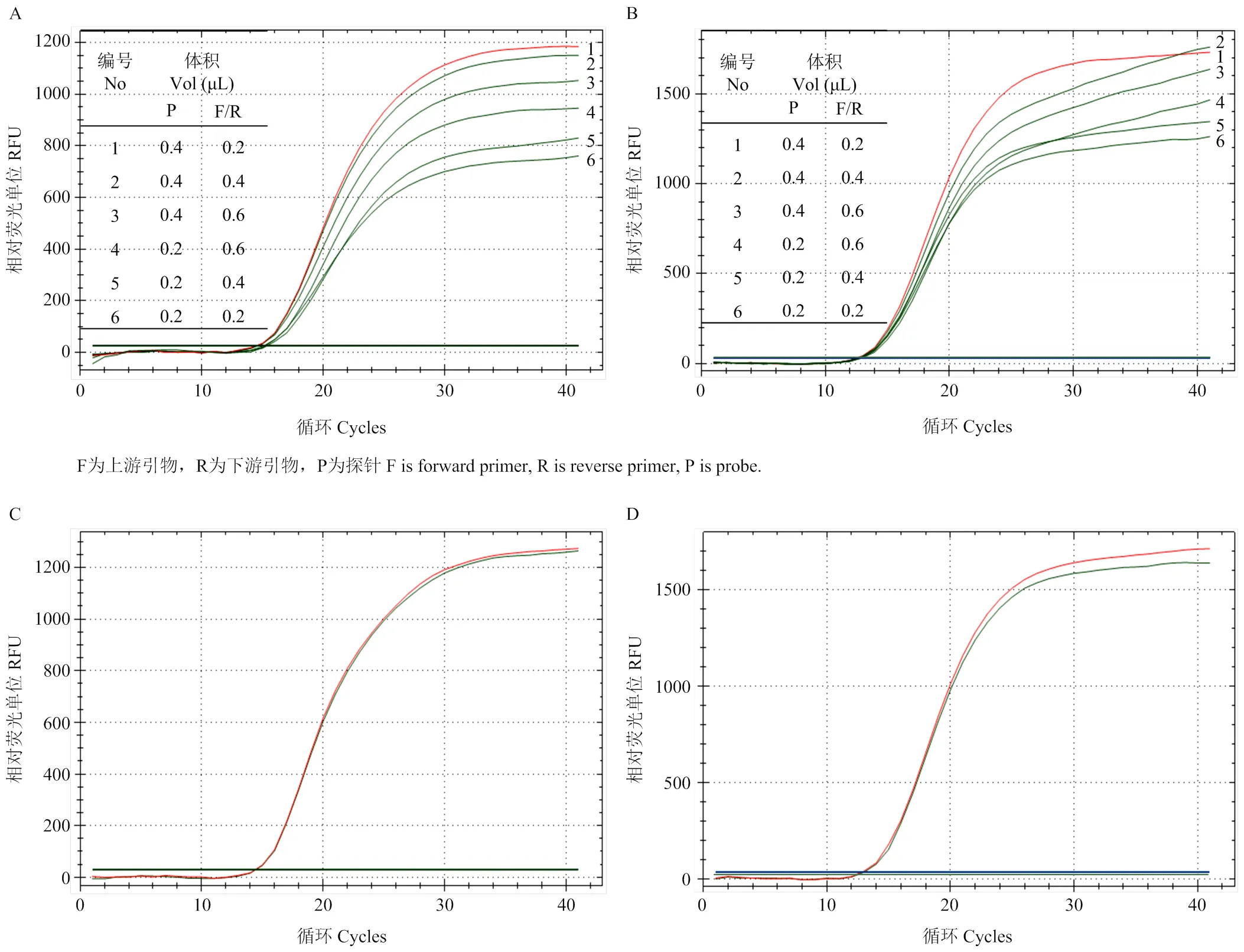
A:MDV 1实时荧光定量PCR方法引物和探针浓度优化;B:MDV 3实时荧光定量PCR方法引物和探针浓度优化;C:MDV 1实时荧光定量PCR方法退火温度优化;D:MDV 3实时荧光定量PCR方法退火温度优化
2.3 实时荧光定量PCR标准曲线的建立
通过实时荧光定量PCR,得到各标准阳性模板的Ct值,以log(拷贝数)为横坐标、Ct值为纵坐标绘制标准曲线。MDV 1标准曲线如图3-A,B所示:扩增效率E=98.8%,相关系数2=0.992,标准曲线方程=-3.351+38.828(=Ct,=log(拷贝数));MDV 3标准曲线如图3-C,D所示:扩增效率E=95.0%,2=0.998,标准曲线方程=-3.447+36.496(=Ct,=log(拷贝数))。
2.4 灵敏度检测
经检测,MDV 1、MDV 3实时荧光定量PCR方法基因拷贝数检测灵敏度分别可达到32.8,10 拷贝/μL(结果见图3-A,C),MDV 1、MDV 3实时荧光定量PCR方法活病毒粒子检测灵敏度均可达到0.006 PFU(图4),灵敏度高。
2.5 特异性检测
特异性试验结果显示,MDV 1实时荧光定量PCR对MDV 1的3个疫苗株(CVI988株、SC9-1株和814株)及1个强毒株(Md5株)均可检测到特异性扩增信号,而对其他特异性研究样品(包括禽用疫苗、生产用毒、MDV 3 FC126毒株、MDV 2 pMV-SB-1(UL19)质粒、双蒸水和生产原材料)检测结果为阴性(图5-A);MDV 3实时荧光定量PCR仅可特异性扩增出血清3型MDV毒株,而对包括MDV 1毒株和MDV 2 pMV-SB-1(UL19)质粒在内的其他特异性研究样品扩增结果为阴性(图5-B);说明所建立的MDV 1和MDV 3实时荧光定量PCR检测方法的特异性好。
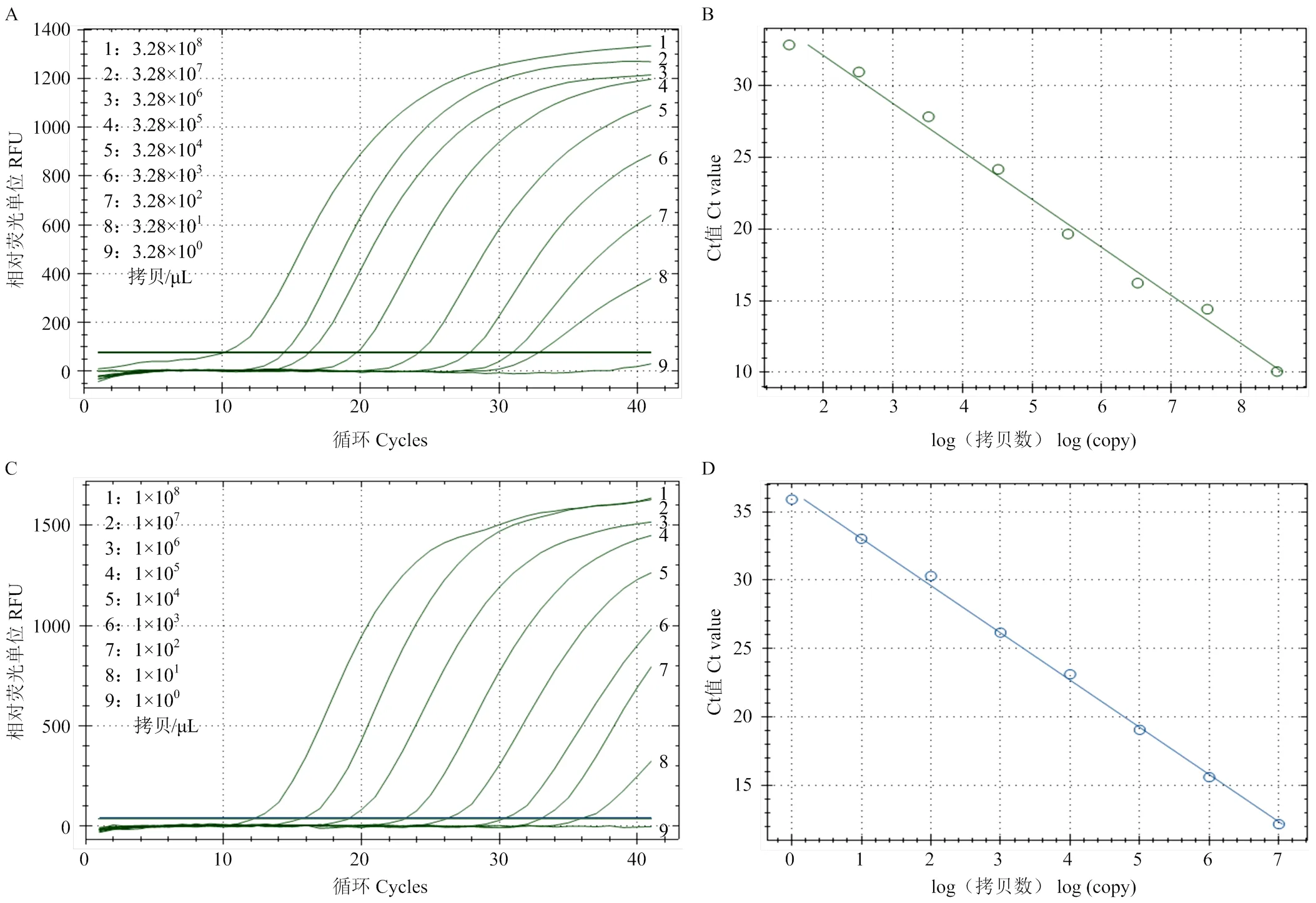
A:MDV 1实时荧光定量PCR方法基因拷贝数灵敏度的检测;B:MDV 1实时荧光定量PCR方法标准曲线的建立;C:MDV 3实时荧光定量PCR方法基因拷贝数灵敏度的检测;D:MDV 3实时荧光定量PCR方法标准曲线的建立

A:MDV 1实时荧光定量PCR方法的活病毒粒子检测灵敏度;B:MDV 3实时荧光定量PCR方法的活病毒粒子检测灵敏度
2.6 重复性检测
取7个10倍梯度稀释的标准品质粒做3次重复性检测,结果如表3、表4所示,两种实时荧光定量PCR检测方法的变异系数均低于1.5%,表明所建立的实时荧光定量PCR检测方法有较好的可重复性。
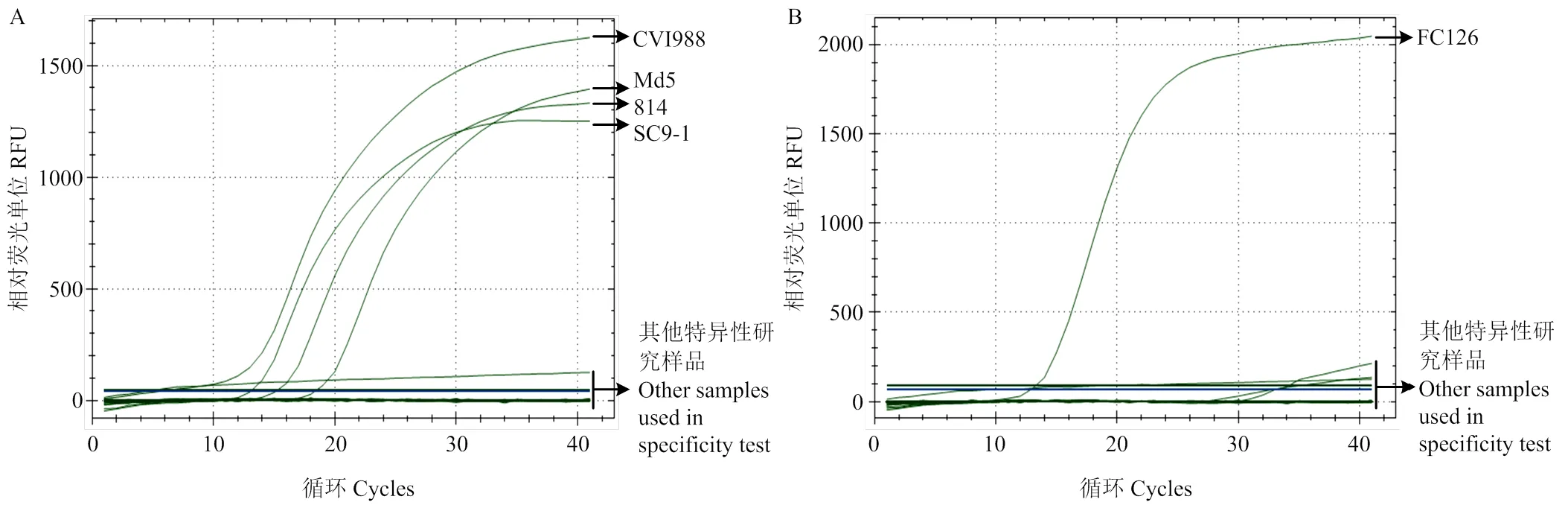
A:MDV 1实时荧光定量PCR方法特异性检测;B:MDV 3实时荧光定量PCR方法特异性检测

表3 MDV 1实时荧光定量PCR重复性的检测
3 讨论
3.1 分子生物学技术可作为现有外源性MDV检验方法的补充
2009年,Merrimack公司在一次性生物反应器进行CHO细胞培养时,通过PCR方法检测到鼠细小病毒污染,从原辅料、工厂环境、生产人员及生产工艺等方面进行快速调查,最终锁定在培养基或添加物上,但是通过PCR方法,仍未得到确认,该公司委托第三方,通过实时荧光定量PCR方法,最后确定培养基添加物为罪魁祸首[22]。LI等[23]建立了液滴数字PCR检测技术,用于减毒活疫苗中鸡传染性贫血病毒污染的检测。MOTITSCHKE等[24]将PCR检测新城疫病毒、禽呼肠孤病毒、禽流感病毒和禽传染性支气管炎病毒的灵敏度与欧洲药典中相应血清学的灵敏度进行了比较,发现PCR检测技术完全可以替代血清学技术。实时荧光定量PCR相比普通PCR具有更高的灵敏度,如果实时荧光定量PCR检测阳性,在不确定是否为假阳性的情况下,可对该样品进行基因测序[25],同时可将该样品在敏感细胞系或动物上继代后再进行检测,避免误判。

表4 MDV 3实时荧光定量PCR重复性的检测
目前2020年版《中华人民共和国兽药典》(三部)外源病毒检测法中针对禽源制品及其细胞中外源性MDV病毒的检验,主要是通过鸡胚法观察尿囊膜病变、细胞法检查细胞病变、鸡检查法测定MDV特异性抗体[14]。鸡胚检查法是将样品接种9—11日龄鸡胚,连续7日观察是否出现尿囊膜病变,细胞法是将样品接种制备的SPF鸡胚成纤维细胞,培养5—7日观察是否出现细胞病变,两种方法均无法进行鉴别检验,且细胞法试验过程中所使用的原材料(如鸡胚、胎牛血清、胰酶等)都可能引入外源病毒[26],可采用更灵敏的分子生物学方法来排除试验过程中引入的外源病毒,以保证试验结果的准确性。鸡检查法是将样品接种SPF鸡,21日后进行第二次接种,第一次接种后42日采血通过琼脂扩散试验测定MDV特异性抗体,灵敏度低、稳定性差、检测时间长、不同来源检测抗原反应性差异较大,且无法进行不同血清型MDV的鉴别,而分子生物学技术的引入可高效解决上述问题。因此,本研究拟通过建立快速(3 h可完成核酸提取及检测)、灵敏、特异的MDV实时荧光定量PCR检测方法解决上述问题。
3.2 实时荧光定量PCR检测方法的靶基因选择
靶基因选择上,为MDV 1毒株特有的致瘤基因,大量学者建立了以为靶标的普通PCR[27-29]及荧光定量PCR[30-34]鉴别检测方法,特异性良好,灵敏度各异,但是,随着MDV的变异与演化,缺失毒株层出不穷,国内[35]及国外(包括伊拉克[36]、意大利[37]、日本[38-39]、沙特阿拉伯[40]和印度[41]等)都有相关报道;GIMENO等[42]与BAIGENT等[43]针对MDV 1建立了可有效区分CVI988疫苗株与其他致瘤性MDV 1毒株的实时荧光定量PCR方法,特异性较好;CORTES等[44]以MDV 1 Md5株糖蛋白为靶标建立了可检测家禽血液和羽毛囊样本中MDV 1含量的实时荧光定量PCR方法,但未在其他多种MDV 1毒株上进行验证。为建立可涵盖所有MDV 1毒株的检测方法,本研究选择编码MDV核衣壳蛋白的为靶基因(目前无缺失毒株的相关报道)建立MDV 1实时荧光定量PCR检测方法,经验证该方法可有效用于缺失毒SC9-1株及其他血清1型毒株的检测,为禽用生物制品外源性血清1型MDV污染纯净性控制提供了技术支持。血清3型毒株方面,ISLAM等[45]以为靶标建立了检出限度为75拷贝的实时荧光定量PCR方法,李冬冬[46]以为靶标建立的重组火鸡疱疹病毒rHVT-VP2 实时荧光定量PCR检测方法的灵敏度为540拷贝/μL,我们以为靶基因建立的MDV 3 qPCR检测方法检出限度达10拷贝/μL,可见,针对不同基因建立的实时荧光定量PCR检测方法其灵敏度存在差异。
目前我国MDV疫苗主要是MDV 1 CVI988株、814株和MDV 3 FC126株,考虑到MDV 2为从健康鸡只分离得到的非致病毒株,因此本研究针对MDV 1及MDV 3分别建立了鉴别检测实时荧光定量PCR方法,以期用于外源性MDV的检测。
4 结论
本研究所建立MDV 1、MDV 3实时荧光定量PCR检测方法特异性好,灵敏度高,重复性好,可作为现有外源性MDV检测方法的有效补充,用于禽用生物制品纯净性控制。
[1] 范学政, 李翠, 宁宜宝, 曲鸿飞. 病毒类疫苗中外源病毒污染、检测方法与控制措施. 中国兽药杂志, 2014, 48(11): 57-61.
FAN X Z, LI C, NING Y B, QU H F. Contamination of extraneous virus in viral vaccine and detection methods, purification control strategies. Chinese Journal of Veterinary Drug, 2014, 48(11): 57-61. (in Chinese)
[2] PASTORET P P. Human and animal vaccine contaminations. Biologicals, 2010, 38(3): 332-334.
[3] SU Q, LIU X F, LI Y, MENG F F, CUI Z Z, CHANG S, ZHAO P. The intracorporal interaction of fowl adenovirus type 4 and LaSota strain significantly aggravates the pathogenicity of one another after using contaminated Newcastle disease virus-attenuated vaccine. Poultry Science, 2019, 98(2): 613-620.
[4] SU Q, MENG F, LI Y, ZHANG Y, ZHANG Z, CUI Z, CHANG S, ZHAO P. Chicken infectious anemia virus helps fowl adenovirus break the protection of maternal antibody and cause inclusion body hepatitis-hydropericardium syndrome in layers after using co-contaminated Newcastle disease virus-attenuated vaccine. Poultry Science, 2019, 98(2): 621-628.
[5] 张帆帆, 宋德平, 周信荣, 黄冬艳, 李安琪, 彭棋, 陈燕君, 吴琼, 何后军, 唐玉新. 新现猪Delta冠状病毒RT-PCR检测方法的建立及其应用. 中国农业科学, 2016, 49(7): 1408-1416.doi: 10.3864/j. issn.0578-1752.2016.07.016.
ZHANG F F, SONG D P, ZHOU X R, HUANG D Y, LI A Q, PENG Q, CHEN Y J, WU Q, HE H J, TANG Y X. Establishment and application of a RT-PCR assay for detection of newly emerged. Scientia Agricultura Sinica, 2016, 49(7): 1408-1416. doi: 10.3864/j.issn.0578-1752.2016.07.016.(in Chinese)
[6] 王涛, 韩玉, 潘力, 王冰, 孙茂文, 王翌, 罗玉子, 仇华吉, 孙元. 针对非洲猪瘟病毒MGF360-13L基因的TaqMan荧光定量PCR的建立. 中国农业科学, 2021, 54(5): 1073-1080.doi: 10.3864/j.issn. 0578-1752.2021.05.018.
WANG T, HAN Y, PAN L, WANG B, SUN M W, WANG Y, LUO Y Z, QIU H J, SUN Y. Development of a TaqMan real-time PCR targeting the MGF360-13L gene of African swine fever virus. Scientia Agricultura Sinica, 2021, 54(5): 1073-1080. doi: 10.3864/j.issn.0578- 1752.2021.05.018.(in Chinese)
[7] YIN D, GENG R H, LV H, BAO C H, SHAO H X, YE J Q, QIAN K, QIN A J. Development of real-time PCR based ongene for the detection of African swine fever virus. Frontiers in Veterinary Science, 2021, 8: 753967.
[8] BANKO A, PETROVIC G, MILJANOVIC D, LONCAR A, VUKCEVIC M, DESPOT D, CIRKOVIC A. Comparison and sensitivity evaluation of three different commercial real-time quantitative PCR kits for SARS-CoV-2 detection. Viruses, 2021, 13(7): 1321.
[9] SWAYNE D E, GLISSON J R, MCDOUGALD L R, NOLAN L K, SUAREZ D L, NAIR V L. Diseases of Poultry. 13th edition. New Jersey: Wiley-Blackwell, 2013
[10] ROZINS C, DAY T, GREENHALGH S. Managing Marek’s disease in the egg industry. Epidemics, 2019, 27: 52-58.
[11] 崔治中, 苏帅, 罗俊, 钱琨, 庄国庆, 孙爱军, 滕蔓. 鸡马立克病毒的研究进展. 微生物学通报, 2019, 46(7): 1812-1826.
CUI Z Z, SU S, LUO J, QIAN K, ZHUANG G Q, SUN A J, TENG M. Progress in Marek’s disease virus. Microbiology China, 2019, 46(7): 1812-1826. (in Chinese)
[12] SHI M Y, LI M, WANG W W, DENG Q M, LI Q H, GAO Y L, WANG P K, HUANG T, WEI P. The emergence of a vv + MDV can break through the protections provided by the current vaccines. Viruses, 2020, 12(9): 1048.
[13] AFONSO C L, TULMAN E R, LU Z, ZSAK L, ROCK D L, KUTISH G F. The genome of Turkey herpesvirus. Journal of Virology, 2001, 75(2): 971-978.
[14] 中国兽药典委员会. 中华人民共和国兽药典-三部: 2020年版. 北京: 中国农业出版社, 2020.
Chinese Veterinary Pharmacopoeia Commission. People’s republic of China (PRC) veterinary medicine code-part III: 2020 edition. Beijing: China Agriculture Press, 2020. (in Chinese)
[15] European Pharmacopoeia Commission. European pharmacopoeia (6th Edition), 2007.
[16] BRUCKNER L, OTTIGER H P. Pre-validation study for testing of avian viral vaccines for extraneous agents by PCR. Pharmeuropa Bio, 2007, 2007(1): 15-18.
[17] OTTIGER H P. Development, standardization and assessment of PCR systems for purity testing of avian viral vaccines. Biologicals, 2010, 38(3): 381-388.
[18] 世界动物卫生组织. OIE陆生动物诊断试验和疫苗手册(哺乳动物、禽鸟与蜜蜂)第五版. 农业部兽医局译, 北京: 中国农业出版社, 2017.
World Organization for Animal Health. OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals (Mammals, Birds and Bees) 5th Edition. Veterinary Bureau of the Ministry of Agriculture translate, Beijing: China Agriculture Press, 2017. (in Chinese)
[19] 国家市场监督管理总局,国家标准化管理委员会. 中华人民共和国国家标准GB/T 18648-2020.
State Administration for Market Regulation, Standardization Administration. National standards of People's Republic of China GB/T 18648-2020. (in Chinese)
[20] KUT E, RASSCHAERT D. Assembly of Marek’s disease virus (MDV) capsids using recombinant baculoviruses expressing MDV capsid proteins. The Journal of General Virology, 2004, 85(Pt 4): 769-774.
[21] BARFOED A M, ØSTERGAARD E, FRANDSEN P L, NIELSEN E B, SANDBERG E, RASMUSSEN T B. Development of a primer-probe energy transfer based real-time PCR for detection of Marek’s disease virus. Journal of Virological Methods, 2010, 165(1): 21-26.
[22] MOODY M, ALVES W, VARGHESE J, KHAN F. Mouse minute virus (MMV) contamination: a case study: detection, root cause determination, and corrective actions. PDA Journal of Pharmaceutical Science and Technology, 2011, 65(6): 580-588.
[23] LI Q C, ZHANG Y B, MENG F F, JIANG H, XU G L, DING J B, ZHANG Y W, DONG G W, TIAN S B, CHANG S, ZHAO P. A new strategy for the detection of chicken infectiousvirus contamination in attenuated live vaccine by droplet digital PCR. BioMed Research International, 2019, 2019: 2750472.
[24] MOTITSCHKE A, OTTIGER H P, JUNGBÄCK C. Evaluation of the sensitivity of PCR methods for the detection of extraneous agents and comparison withtesting. Biologicals, 2010, 38(3): 389-392.
[25] 尚宏华, 郭建平, 谢秋梅. 猪瘟活疫苗外源病毒BVDV细胞培养与PCR检测的比较. 江西畜牧兽医杂志, 2014(6): 8-10.
SHANG H H, GUO J P, XIE Q M. Comparison of BVDV cell culture and PCR detection of classical swine fever live vaccine. Jiangxi Journal of Animal Husbandry & Veterinary Medicine, 2014(6): 8-10. (in Chinese)
[26] MACKAY D, KRIZ N. Current challenges in viral safety and extraneous agent testing. Biologicals, 2010, 38(3): 335-337.
[27] 吕红超, 张艳萍, 孙国荣, 高玉龙, 李志杰, 郑惠文, 包珂岩, 王笑梅, 刘长军. 鸡马立克氏病强弱病毒株PCR鉴别检测方法在诊断中的应用评价. 中国预防兽医学报, 2016, 38(7): 567-571.
LÜ H C, ZHANG Y P, SUN G R, GAO Y L, LI Z J, ZHENG H W, BAO K Y, WANG X M, LIU C J. Assessments of a PCR method for detection and identification of virulent Marek’s disease virus and vaccine strain for Marek’s disease diagnosis. Chinese Journal of Preventive Veterinary Medicine, 2016, 38(7): 567-571. (in Chinese)
[28] 周冬玉, 李国红, 靳泽华, 徐巧霞, 徐蓉, 张安定. 鸡马立克氏病病毒和疫苗毒株PCR诊断方法的建立及其应用. 现代畜牧兽医, 2022(8): 50-54.
ZHOU D Y, LI G H, JIN Z H, XU Q X, XU R, ZHANG A D. Establishment and application of PCR diagnosis method for chicken Marek’s disease virus and vaccine virus. Modern Journal of Animal Husbandry and Veterinary Medicine, 2022(8): 50-54. (in Chinese)
[29] 李学伍, 刘媛, 王丽, 邓瑞广, 赵东, 杨继飞, 柴书军. 鸡3种主要DNA病毒多重感染复合PCR检测方法的建立. 河南农业科学, 2017, 46(7): 101-105.
LI X W, LIU Y, WANG L, DENG R G, ZHAO D, YANG J F, CHAI S J. Establishment of multiplex PCR detection method for three kinds of main DNA viruses in chicken. Journal of Henan Agricultural Sciences, 2017, 46(7): 101-105. (in Chinese)
[30] 屈素洁, 施开创, 胡杰, 张步娴, 尹彦文, 粟艳琼, 莫胜兰, 李军, 邹联斌. 荧光定量PCR检测鸡马立克氏病血清1型病毒方法的建立及应用. 上海畜牧兽医通讯, 2015(4): 19-21.
QU S J, SHI K C, HU J, ZHANG B X, YIN Y W, SU Y Q, MO S L, LI J, ZOU L B. Establishment and application of fluorescence quantitative PCR method for detecting Marek’s disease serum type 1 virus in chickens. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2015(4): 19-21. (in Chinese)
[31] 闫彩虹. 江苏地区家禽4种免疫抑制病病原检测及致瘤病毒三重荧光定量PCR检测方法的建立与应用[D]. 扬州: 扬州大学, 2020.
YAN C H. Establishment and application of triple fluorescence quantitative PCR method for detection of pathogens of four immunosuppressive diseases in poultry in Jiangsu Province[D]. Yangzhou: Yangzhou University, 2020. (in Chinese)
[32] 汪最, 李丽, 刘鹏, 刘丽娜, 汪琛, 周康, 罗青平. ALV-J、REV和MDV多重荧光定量PCR检测方法的建立. 中国动物传染病学报, 2020, 28(6): 73-78.
WANG Z, LI L, LIU P, LIU L N, WANG C, ZHOU K, LUO Q P. Establishment of a triple real-time pcr for detecting alv-j, rev and mdv. Chinese Journal of Animal Infectious Diseases, 2020, 28(6): 73-78. (in Chinese)
[33] LÓPEZ-OSORIO S, VILLAR D, PIEDRAHITA D, RAMÍREZ- NIETO G, NAIR V, BAIGENT S, CHAPARRO-GUTIÉRREZ J. Molecular detection of Marek’s disease virus in feather and blood samples from young laying hens in Colombia. Acta Virologica, 2019, 63(4): 380-391.
[34] ZHANG Z J, LIU S Q, MA C T, ZHAO P, CUI Z Z. Absolute quantification of a very virulent Marek’s disease virus dynamic quantity and distributions in different tissues 1. Poultry Science, 2015, 94(6): 1150-1157.
[35] SU S, CUI N, ZHOU Y, CHEN Z M, LI Y P, DING J B, WANG Y X, DUAN L T, CUI Z Z. A recombinant field strain of Marek’s disease (MD) virus with reticuloendotheliosis virus long terminal repeat insert lacking the meq gene as a vaccine against MD. Vaccine, 2015, 33(5): 596-603.
[36] WAJID S J, KATZ M E, RENZ K G, WALKDEN-BROWN S W. Prevalence of Marek’s disease virus in different chicken populations in Iraq and indicative virulence based on sequence variation in the ecoRI-q (meq) gene. Avian Diseases, 2013, 57(2 Suppl.): 562-568.
[37] MESCOLINI G, LUPINI C, FELICE V, GUERRINI A, SILVEIRA F, CECCHINATO M, CATELLI E. Molecular characterization of thegene of Marek’s disease viruses detected in unvaccinated backyard chickens reveals the circulation of low- and high-virulence strains. Poultry Science, 2019, 98(8): 3130-3137.
[38] MURATA S, HASHIGUCHI T, HAYASHI Y, YAMAMOTO Y, MATSUYAMA-KATO A, TAKASAKI S, ISEZAKI M, ONUMA M, KONNAI S, OHASHI K. Characterization of Meq proteins from field isolates of Marek’s disease virus in Japan. Infection, Genetics and Evolution, 2013, 16: 137-143.
[39] MURATA S, YAMAMOTO E, SAKASHITA N, MAEKAWA N, OKAGAWA T, KONNAI S, OHASHI K. Research Note: characterization of S-Meq containing the deletion in Meq protein’s transactivation domain in a Marek’s disease virus strain in Japan. Poultry Science, 2021, 100(11): 101461.
[40] MOHAMED M H A, EL-SABAGH I M, AL-HABEEB M A, AL-HAMMADY Y M. Diversity of Meq gene from clinical Marek’s disease virus infection in Saudi Arabia. Veterinary World, 2016, 9(6): 572-578.
[41] GUPTA M, DEKA D. Sequence analysis of Meq oncogene among Indian isolates of Marek’s disease herpesvirus. Meta Gene, 2016, 9: 230-236.
[42] GIMENO I M, DUNN J R, CORTES A L, EL-GOHARY A E G, SILVA R F. Detection and differentiation of CVI988 (Rispens vaccine) from other serotype 1 Marek’s disease viruses. Avian Diseases, 2014, 58(2): 232-243.
[43] BAIGENT S J, NAIR V K, LE GALLUDEC H. Real-time PCR for differential quantification of CVI988 vaccine virus and virulent strains of Marek’s disease virus. Journal of Virological Methods, 2016, 233: 23-36.
[44] CORTES A L, MONTIEL E R, LEMIERE S, GIMENO I M. Comparison of blood and feather pulp samples for the diagnosis of Marek’s disease and for monitoring Marek’s disease vaccination by real time-PCR. Avian Diseases, 2011, 55(2): 302-310.
[45] ISLAM A, CHEETHAM B F, MAHONY T J, YOUNG P L, WALKDEN-BROWN S W. Absolute quantitation of Marek’s disease virus and Herpesvirus of turkeys in chicken lymphocyte, feather tip and dust samples using real-time PCR. Journal of Virological Methods, 2006, 132(1/2): 127-134.
[46] 李冬冬. 重组火鸡疱疹病毒rHVT-VP2实时荧光定量PCR检测方法的建立及应用[D]. 南京: 南京农业大学, 2017.
LI D D. Establishment and application of real-time fluorescence quantitative PCR detection method for recombinant Turkey herpesvirus rHVT-VP2[D]. Nanjing: Nanjing Agricultural University, 2017. (in Chinese)
Establishment of Real-Time PCR Method for Detection of Extraneous Marek’s Disease Virus
SU Jia, ZHAO Wei, LIU Dan, WANG Jia, BAI HongXu, WU HuaWei, XUE QingHong, CHEN XiaoChun
China Institute of Veterinary Drug Control, Beijing 100081
【Objective】 In order to solve the problems of low sensitivity, long detection time, and poor discrimination of existing exogenous Marek’s disease virus (MDV) testing methods, this study was designed to establish two real-time PCR detection methods for the identification of MDV serotype 1 (MDV 1) and MDV serotype 3 (MDV 3) strains, which could be used for purity control of poultry-derived biological products. 【Method】Thesequences of MDV 1, MDV serotype 2 (MDV 2) and MDV 3 strains were downloaded from the NCBI database and were used for nucleotide and amino acid homology comparison. A pair of specific primers and corresponding Taqman probe was designed from the known sequence of conservedof MDV 1 CVI988 strain and MDV 3 FC126 strain, respectively, and two real-time PCR detection methods were established. The corresponding recombinant plasmids were constructed and used as positive standards to make standard curves, and the sensitivity of gene copy number of the methods were evaluated. Other avian virus-associated biological products, virus, the full-length plasmid ofof MDV 2 SB-1 strain and the raw materials for production (SPF chicken embryo allantoic fluid, embryonic body, allantoic membrane, chicken embryo fibroblasts) were detected to evaluate the specificity of the established methods. 600, 60, 6, 0.6, 0.06, 0.006 and 0.0006 PFU of CVI988 or FC126 strains were detected, respectively, and the sensitivity of the established two methods for detecting live virions was evaluated. Three repeatability tests were performed using corresponding recombinant plasmids of different dilutions, and the correlation coefficient were calculated to analyze the reproducibility of the two established detection methods. 【Result】 The nucleotide and the derived amino acid homology of MDV=-3.351+38.828 (= Ct,= lg ( copy number)). About the MDV 3 real-time PCR detection method, the amplification efficiency was 95%, the correlation coefficient was 0.998, and the standard curve:=-3.447+36.496 (= Ct,= lg ( copy number)). The established detection methods could specially detect MDV 1 or MDV 3 without detecting any other avian virus-associated biological products, virus, the full-length plasmid ofof MDV 2 SB-1 strain, along with production materials for poultry. The sensitivity of MDV 1 real-time PCR detection method was high, with the gene copy number detection limit of 32.8 copies/μL, which could detect at least 0.006 PFU of CVI988 strain. The sensitivity of MDV 3 real-time PCR detection method was high, with the gene copy number detection limit of 10 copies/μL, which could detect at least 0.006 PFU of FC126 strain. The coefficient of variation of the repeatability test was less than 1% in MDV 1 real-time PCR detection method, and less than 1.5% in MDV 3 real-time PCR detection method, respectively. 【Conclusion】 The established real-time PCR detection methods would be beneficial for detecting exogenous MDV 1 and MDV 3 strains in poultry-derived biological products.
Marek’s disease virus; real-time PCR; extraneous virus; detection

10.3864/j.issn.0578-1752.2023.20.016
2022-11-11;
2023-04-04
兽药行业公益性重点项目(GY202105)
苏佳,E-mail:hnzk912@163.com。通信作者陈晓春,E-mail:chunxiao1981@126.com
(责任编辑 林鉴非)
