葡萄糖转运蛋白4 在鱼类糖代谢中的作用研究进展
2023-11-16吴杉杉邓瑶霍欢欢彭墨
吴杉杉,邓瑶,霍欢欢,彭墨
(江西农业大学动物科学技术学院,江西 南昌 330045)
硬骨鱼比哺乳动物不耐受葡萄糖,尤其是肉食性鱼类[1]。在哺乳动物中,葡萄糖从血液运输到细胞内由葡萄糖转运蛋白家族(GLUTs)完成[2],目前已报道了14 种不同的葡萄糖转运蛋白,即GLUT1~12、HMIT 和GLUT14[3]。GLUT1~4 主要介导葡萄糖的转运,其他GLUTs 主要介导果糖转运等功能[3]。GLUT1、GLUT2 和GLUT3 分别广泛分布于红细胞、胰腺[4],肝、胰[5]和神经组织中[3],GLUT4 则在骨骼肌和脂肪组织中高度表达[6],介导组织细胞摄取葡萄糖。
GLUT4 协助葡萄糖通过细胞膜脂质双层进入细胞,形成组织葡萄糖动态供给平衡,维持机体正常的糖代谢[7]。自发现GLUT4 以来,深入研究了其结构、储存部位、功能以及参与葡萄糖转运的相关信号途径等[8-11],在哺乳动物中发现GLUT4 参与了PI3K/Akt、AMPK、PKC 等信号通路调节葡萄糖转运[12-14]。
目前在鱼类中多研究GLUT4 的基因序列分析、组织表达。Li 等[15]分析了卵形鲳鲹(Trachinotus ovatus)、军曹鱼(Rachycenton canadum)和尼罗罗非鱼(Oreochromis niloticus)GLUT4 的表征;刘含亮[16]研究了罗非鱼GLUT4 的组织表达,但缺乏长期以来涉及葡萄糖转运机制的研究。本文综述了GLUT4在鱼类中的发现历程、结构、功能和转运方式以及相关信号通路的最新研究成果,为进一步了解鱼类中GLUT4 的作用和机制提供理论基础。
1 鱼类中GLUT4 的发现历程
最初,广泛研究了鱼类不耐受葡萄糖的机理。Wright 等[17]研究指出,罗非鱼外周组织中缺乏GLUT4,是一种自然发生的GLUT4 基因缺失。Legate 等[18]在虹鳟(Oncorhynchus mykiss)、美洲鳗鲡(Anguilla rostrata)、黑(Ameiurus melas)的白肌和红肌以及心脏中都没有检测到哺乳动物类型的GLUT4,因此,猜测硬骨鱼体内缺乏GLUT4 是鱼类不耐受葡萄糖的一大原因。随后Josep 实验室[19]从褐鳟(Salmo trutta)肌肉中克隆了一种葡萄糖转运蛋白(btGLUT)。它与哺乳动物的GLUT4 具有很高的序列同源性,主要在红肌和白肌中表达,这是褐鳟摄取葡萄糖的两个主要部位,在鳃、肾脏和脂肪组织中也有较高表达。进一步研究发现,btGLUT 在红肌中的表达与胰岛素水平直接相关,相比之下,白肌中btGLUT 的表达似乎不受胰岛素水平变化的影响[20]。随后的研究结果显示,btGLUT4 蛋白水平的变化与转录水平呈一致的相关性,表明褐鳟鱼体内btGLUT4 的调节主要发生在红肌中[21]。该实验室后期的研究确定了褐鳟鱼红肌中的转运蛋白为GLUT4,即在褐鳟原代骨骼肌细胞中,胰岛素促进内源性GLUT4 移位到质膜,促进葡萄糖转运[22]。Díaz 等[23]对虹鳟的研究表明,虹鳟骨骼肌中的GLUT4 在转录和蛋白水平上受胰岛素的调节,同时胰岛素和胰岛素样生长因子1(insulin-like growth factors-1,IGF-1)可能直接作用于虹鳟的肌肉细胞,调节GLUT4 的表达。因此,鱼类GLUT4 和哺乳动物的GLUT4 功能一致,是葡萄糖进入骨骼肌的重要介质,对膳食葡萄糖的利用非常重要。
在鱼类骨骼肌中发现GLUT4 的同时,其他组织也有GLUT4 的分布。Capilla 等[24]从银大麻哈鱼(Oncorhynchus kisutch)的脂肪组织克隆出okGLUT4,发现其与哺乳动物GLUT4 具有高度的序列同源性。尽管这两者之间的蛋白质基序存在差异,当okGLUT4 在银大麻哈鱼脂肪细胞中表达时,却能响应胰岛素的刺激从细胞内转运至质膜,这表明okGLUT4 是哺乳动物GLUT4 的结构性和功能性同源物,但对葡萄糖的亲和力较低。Capilla 等[24]的研究在一定程度上可以解释鱼类对葡萄糖不耐受的原因。陈强[25]和刘含亮[16]的研究发现,罗非鱼、卵形鲳鲹和军曹鱼的GLUT4 与其他物种相比较具有很高的同源性。罗非鱼骨骼肌中克隆出了GLUT4,在肌肉和心脏中的表达量很高[16];将卵形鲳鲹和军曹鱼的GLUT4 进行多序列比较分析发现,FQQI、TELEY 等基因序列的突变可能导致GLUT4 功能、转运方式的改变,影响鱼类对葡萄糖的吸收和利用[25]。这与先前Wright 等[17]提出罗非鱼体内缺失GLUT4的结论相冲突。除此之外,大西洋鳕(Gadus morhua)、龙胆石斑鱼(Epinephelus lanceolatus)的GLUT4 相应在心脏和肌肉[26]、肌肉和眼睛[27]中有较高的表达。综上研究,鱼类的GLUT4 与哺乳动物相比存在较高的保守性,推测鱼类GLUT4 具备转运葡萄糖的功能,对研究鱼类摄取葡萄糖的机制提供理论依据。
2 GLUT4 的结构、功能与转运模式
GLUT4 由12 个跨膜结构域蛋白组成[8],在基础条件下,当GLUT4 从质膜移动到早期内吞体(early endosome,EE),在返回质膜之前从EE 移动到循环内吞体(recycling endosome,RE)时,GLUT4通过内吞和胞吐进行结构性循环。还对RE 和反面高尔基网(trans-golgi network,TGN)中的GLUT4 进行了动态分选,以生成GLUT4 储存囊泡(GSVs)[12]。正常胰岛素敏感状态下通过将胰岛素响应的GSVs易位到细胞表面来促进葡萄糖摄取,这种囊泡群体既不同于RE,也不同于TGN,它的形成可能支持GLUT4 的独特特性,这些特性只有在胰岛素敏感细胞中表达时才明显[9,28]。
胰岛素刺激的GSVs 转位较为复杂,可溶性NFS 附着蛋白受体(soluble N-ethylmaleimide-sensitive factor attachment protein receptor,SNARE)是介导GSVs 与细胞膜融合的核心分子,Sec1p/Munc 18类蛋白(Sec1/Munc18-like proteins,SM)和SNARE协同作用调控膜融合过程,存在靶膜上的SNAP 受体(target-SNARE,t-SNARE)以及囊泡膜上的SNAP受体(vesicle-SNARE,v-SNARE)[29],t-SNARE 包含突触融合蛋白4(syntaxin-4,Stx4)和23 kDa 突触关联蛋白(synaptosomal associated protein 23 kDa,SNAP23)[12],囊泡相关膜蛋白2(vesicle associated membrane protein 2,VAMP2)是胰岛素敏感组织中主要的v-SNARE[30]。基础状态下Munc18c 与Stx4的结合使其处于“关闭”状态,从而抑制GSVs 与细胞膜的融合过程,经胰岛素刺激Munc18c 同Stx4 解离,Stx4 转变为“开放”状态[31],通过双C2 域蛋白-β(double C2-like domains beta,DOC2B)和扩展突触结合蛋白1(extended synaptotagmin-like protein 1,ESYT1)等一些Ca2+敏感蛋白调节Stx4、SNAP23 和VAMP2 形成三元复合物[12],Stx4 和SNAP23 足以将囊泡拴在细胞膜上,而VAMP2 促进两者的融合[32],释放GSVs 中的GLUT4,转运葡萄糖。
在不同鱼类中GLUT4 蛋白相对保守,不同鱼种类间GLUT4 的外显子数目和基因长度不同:河鲀(Tetraodontidae)、绿河鲀(Tetraodon nigroviridis)、罗非鱼、刺鱼(Gasterosteus)、青鳉(Oryzias latipes)和花斑剑尾鱼(Xiphophorus maculatus)分别有12、13、13、11、12 和15 个外显子,基因长度分别为4.5 kb、4.5kb、10.2kb、4.9kb、12.7kb 和14.1kb[33]。人类GLUT4基因外显子VI~X 在鱼类中高度保守(图1)。
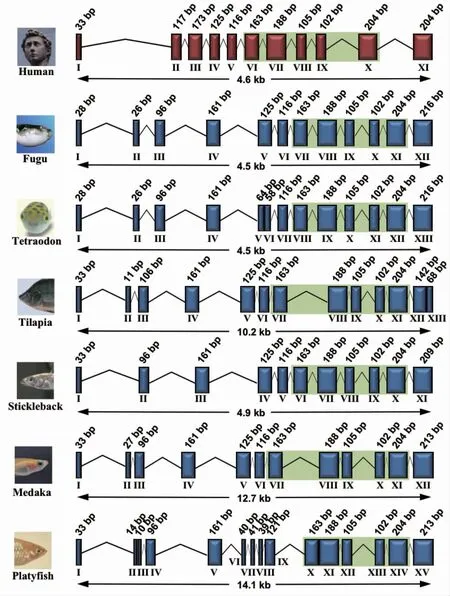
图1 鱼类GLUT4 的基因组结构[33]Fig.1 Genomic structure of GLUT4 in fish
目前,已通过外源性(哺乳动物L6 肌肉细胞或3T3-L1 脂肪细胞)和内源性(鳟原代肌肉细胞)成功研究了鲑体内两种葡萄糖转运蛋白(btGLUT4 和okGLUT4)的细胞内转运特性,并与哺乳动物的GLUT4 进行了比较。当btGLUT4 在L6 肌肉细胞中稳定表达时,btGLUT4 在PM 中的表达水平(20%~25%)高于大鼠GLUT4(10%~15%)[22]。这不仅在肌肉细胞中观察到,因为在稳态条件下分别瞬时表达btGLUT4 或okGLUT4 的3T3-L1 脂肪细胞中,btGLUT4 在PM的蛋白水平(30%~40%)显著高于大鼠GLUT4(10%~15%),也显著高于okGLUT4(15%~20%)[24,34]。重要的是,鳟原代肌肉细胞中GLUT4在质膜上的基础定位也相对较高[22]。因此,在基础状态下,鱼类和哺乳动物在细胞内保留GLUT4 的机制不同。如前所述,哺乳动物细胞中的GLUT4 主要分布于GSVs,而研究表明,btGLUT4 在两种细胞类型中均可以通过胰岛素刺激转位至PM。除此之外,当btGLUT4 和大鼠GLUT4 在3T3-L1 脂肪细胞[34]或L6 肌肉细胞[22]中共表达时,btGLUT4 仅显示出部分共同定位。表明btGLUT4 可能分布在独特的储存室中,在储存室与PM之间进行结构性循环。根据鱼类与哺乳动物GLUT4 在基础状态下PM 定位的差异,okGLUT4 比btGLUT4 更类似于哺乳动物对应蛋白的转运方式。有人认为这两种GLUT4 的不同转运方式可能与GLUT4 蛋白序列(即N-端和C-端蛋白质基序)的不同调控特征有关[34]。因此,证明了鱼类的GLUT4 与哺乳动物同源物一样具有胰岛素反应性,即使它们在稳态时具有更高的PM定位。
3 与GLUT4 有关的信号通路
GLUT4 介导的葡萄糖转运涉及PI3K/Akt、AMPK、PKC 等信号通路,目前有关哺乳动物的各种信号通路调控GLUT4 转运葡萄糖的机制已有广泛研究,而在鱼类中,GLUT4 转运葡萄糖的具体机制还不明确。
3.1 PI3K/Akt 信号通路在葡萄糖转运中的作用
PI3K/Akt 信号通路参与胰岛素刺激GLUT4 转位[35]。PI3K 是一种二聚体,由一个催化亚基P110 和一个调节亚基P85 组成。根据序列的相似度和底物的特异性哺乳动物的PI3K 分为3 种亚型,I 型以磷脂酰肌醇(phosphatidylinositol,PI)、磷脂酰肌醇磷酸(phosphatidylinositol phosphate,PIP)、磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5 -bisphosphate,PIP2)为底物;II 型以PI 及PIP 为底物,III 型以PI 为底物[36]。Akt 包括Akt1、Akt2 和Akt3 三个亚型,每个亚型都有一个PH 区域能够被磷脂酰肌醇-3,4,5-三磷酸(phosphatidylinositol-3,4,5-trisphosphate,PIP3)识别。
胰岛素刺激后,磷酸化的胰岛素受体(insulin receptor,IR)与胰岛素受体底物(insulin receptor substrate,IRS)结合,激活IRS,让活化的PI3K 促使PIP2 磷酸化,产生PIP3[12],随后3-磷酸肌醇依赖性蛋白激酶1(3-phosphoinositide-dependent protein kinase 1,PDK1)磷酸化Akt[37],导致TBC1(tre-2/USP6、BUB2、cdc16)结构域家族成员1(TBC1D1)和TBC1(tre-2/USP6、BUB2、cdc16)结构域家族成员160 kDa 蛋白激酶B 底物(TBC1D4/AS160)失活,抑制了其GTP 酶激活蛋白(GTPase-activating protein,GAP)活性,从而允许Rab 家族的GTP 酶负载GTP[38,39],最终由Rab10 的激活刺激3T3-L1 脂肪细胞中的GLUT4 转位[40],骨骼肌细胞中的GLUT4 转位通过Rab8A、Rab10、Rab13 和Rab14 的激活[41-43]。胰岛素单独刺激脂肪细胞后,经Cbl-CAP-APS-TC10 信号通路介导GLUT4 转运葡萄糖(图2)[44]。
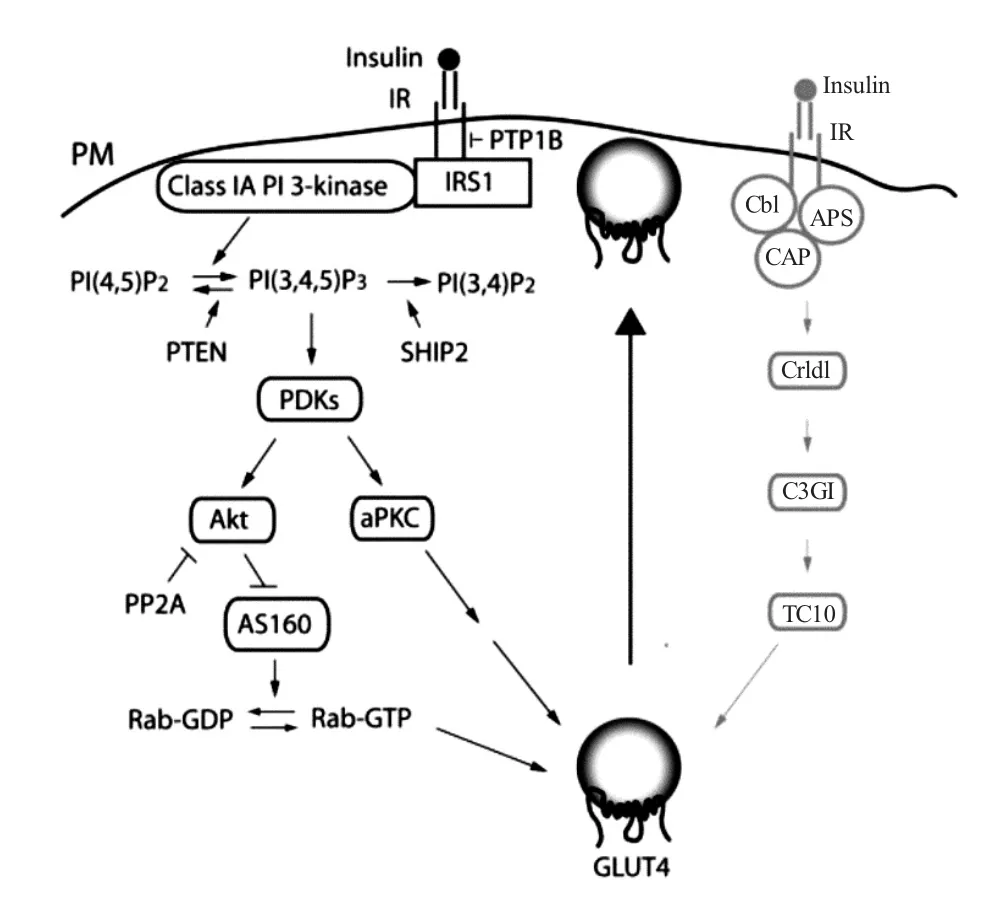
图2 PI3K/Akt 信号通路和胰岛素刺激产生的Cbl-CAPAPS 复合物调控GLUT4 转运葡萄糖[54]Fig.2 The PI3K/Akt pathway and the Cbl-CAP-APS complex produced by insulin stimulation enhances GLUT4 translocation,eventually resulting in an increase of glucose uptake
目前的研究发现,PI3K/Akt 基因广泛分布在斑马鱼(Brachydanio rerio var)、黄颡鱼(Pelteobagrus fulvidraco)和草鱼(Ctenopharyngodon idella)等鱼类组织中[45-47]。有研究指出,锌可以通过上调矛尾复虎鱼(Synechogobius hasta)肝细胞中IR、IRS 和PI3K 的mRNA 表达,激活胰岛素信号通路[48]。Gu等[49]的研究显示,胰岛素介导的PI3K/Akt 信号途径能够影响大黄鱼(Larimichthys crocea)的葡萄糖利用,其是否通过GLUT4 转运来影响葡萄糖吸收还未知。Yang 等[50]的研究表明,注射胰岛素能够上调鲤(Cyprinus carpio L.)肌肉中GLUT4 的mRNA 表达水平。除此之外,有研究探讨了通过PI3K/Akt 信号通路调控团头鲂(Megalobrama amblycephala)的抗氧化机制以及胰岛素激活IRS-PI3K/Akt 信号通路调控黄颡鱼和团头鲂脂肪代谢的分子机制[51-53]。
3.2 AMPK 信号通路在葡萄糖转运中的作用
在哺乳动物中已证实,AMPK 为一种能量传感器,能影响GLUT4 细胞内转位和葡萄糖吸收[14]。AMPK 是一种异源三聚体复合物,由一个催化亚基(α-亚基)和两个调节亚基(β-亚基和γ-亚基)组成,又分为两个α 亚基异构体(α1 和α2),两个β 亚基异构体(β1 和β2)和三个γ 亚基异构体(γ1,γ2 和γ3)。α-亚基包含N 端的丝氨酸/苏氨酸蛋白激酶的残基Thr172,AMPK 的激活离不开Thr172 的磷酸化[55]。AMPKα1 在肾、肝、肺、心和脑中大量表达,AMPKα2 在骨骼肌、心脏和肝脏中表达最为显著[56]。
在哺乳动物中,除二甲双胍、白藜芦醇、AICAR等AMPK 激活剂可以激活AMPK 之外[57],运动也能够激活AMPK[58]。在能量改变即AMP/ATP 比率变化的情况下,通过肿瘤抑制因子肝激酶B1(liver kinase B1,LKB1)的响应磷酸化AMPKα 的Thr172位点[59]。钙离子/钙调蛋白依赖性蛋白激酶激酶β(Ca2+/calmodulin-dependent protein kinase kinase β,CaMKKβ)也是AMPK 的替代上游激酶,增加细胞内Ca2+浓度后,促使CaMKKβ 磷酸化并激活AMPK[60]。研究显示,二甲双胍以AMPK 依赖的方式增加Src 的磷酸化,Src 抑制可阻断二甲双胍介导的Cbl 磷酸化。二甲双胍可以刺激c-jun 氨基末端激酶(c-jun N-terminal kinases,JNK)及其下游分子c-jun 的磷酸化。c-jun 是Cbl 相关蛋白(Cbl-associated protein,CAP)转录的关键分子,然后通过Cbl/CAP 相关复合体的形成来调节GLUT4 的转位[61]。除此之外,还可以通过AMPK/TBC1D1 信号通路刺激GSVs 转运上膜(图3)。
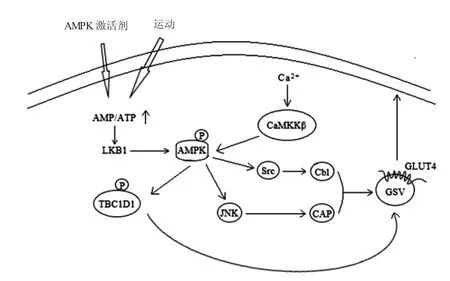
图3 AMPK 信号通路调控GLUT4 转运葡萄糖[58,60]Fig.3 The AMPK pathway enhances GLUT4 translocation,eventually resulting in an increase of glucose uptake
TBC1D1 作为TBC1D4/AS160 的类似物,TBC1D1 的GAP 结构域具有功能性,并且具有与TBC1D4/AS160 高度相似的GAP 结构域几乎相同的Rab 特异性[41]。AMPK 是TBC1D1 磷酸化的触发器,通过磷酸化TBC1D1 Ser231 位点抑制其Rab-GAP 活性,然后相关的Rabs 被解除抑制,促进GSVs 转运至细胞膜并嵌入脂质双分子层释放GLUT4,介导非胰岛素依赖的骨骼肌摄取葡萄糖[62]。
3.3 PKC 信号通路在葡萄糖转运中的作用
PKC 是一组依赖Ca2+和磷脂激活的丝氨酸/苏氨酸蛋白激酶。哺乳动物的传统PKC 信号途径参与非胰岛素调控的葡萄糖转运,同时非典型PKC 与PI3K/Akt 信号途径相关联。传统PKC 信号途径中,胞外信号分子与其相应的G 蛋白偶联受体结合后,激活的G 蛋白介导磷脂酶C(phospholipase C,PLC)的激活,导致带有PIP2 的脂质水解。该反应产生了两个第二信使二酰甘油(diacylglycerol,DAG)和1,4,5-三磷酸肌醇(inositol-1,4,5-triphosphosate,IP3),后者诱导内质网释放Ca2+。由于DAG/Ca2+的作用,将PKC 募集至内膜可缓解酶的相互抑制,激活其激酶功能[69],之后Rab13 参与Ca2+介导的肌细胞GLUT4 胞吐过程(图4)[13]。非典型PKC 信号途径中,对3T3L1 脂肪细胞给予外源性PIP3,随后会增加下游信号蛋白PKCζ/λ 的磷酸化,上调GLUT4 蛋白表达量,促进葡萄糖摄取(图2)[70]。研究表明诸多PKC 亚型如PKCβ、PKCγ、PKCε 和PKCι/λ 的表达促进GLUT4 的转位[71]。
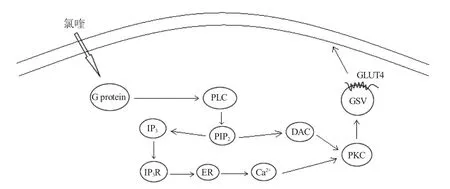
图4 PKC 信号通路调控GLUT4 转运葡萄糖[71]Fig.4 The PKC pathway enhances GLUT4 translocation,eventually resulting in an increase of glucose uptake
有关鱼类PKC 的研究大多停留在基因序列分析、组织表达以及亚型层面上,是否通过PKC 信号通路影响鱼类GLUT4 转运及葡萄糖吸收目前尚不清楚。鱼类组织中分布的PKC 亚型较为广泛,如在虹鳟脑中发现的PKCα、PKCβ 和PKCγ[72],同时在美国红鱼(Sciaenops ocellatus)白细胞中鉴定出多种PKC 亚型[73]。传统型的和非典型PKC 亚型存在于金鱼(Carassius auratus)的垂体内[74]。PKCε 和PKCζ 广泛分布于斑马鱼中枢神经系统,PKCθ 和PKCβII 在骨骼肌中表达[75]。PKC 信号通路在鱼类中的研究涉及免疫和脂肪代谢等方面。PKCθ 在草鱼宿主免疫防御机制中起重要作用[76],以及PKC 信号通路在虹鳟禁食期间被激活,介导脂质分解过程[77]。
4 小结
目前对鱼类糖代谢主要专注于糖异生、糖酵解等方面,而鱼类葡萄糖转运体的机制研究十分有限。重要的是,葡萄糖转运蛋白4(GLUT4)在鱼类中的研究有较大的进展。已经证明鱼类GLUT4 与哺乳动物具有较高的同源性,至少在进化上是保守的。其次,鱼类GLUT4 的结构和转运方式与哺乳动物存在一定的差异。GLUT4 的信号通路在哺乳动物中研究的广泛且深入,鱼类GLUT4 的信号通路研究还有许多空白。在胰岛素依赖途径影响鱼类葡萄糖的吸收方面得到初步探究。已经证明,AMPK 作为非胰岛素依赖性葡萄糖转运途径影响鱼体吸收葡萄糖的进程,了解对葡萄糖不耐受的鱼类的AMPK 刺激葡萄糖摄取的具体机制,为改善鱼类糖耐受能力具有重要的意义。然而,目前PKC 信号通路未涉及到鱼类GLUT4 介导的葡萄糖代谢。因此针对哺乳动物和鱼类在不同信号通路上的作用差异以及不同信号通路中上游因子对鱼类GLUT4 转运的具体调控机制等的研究还需深入探讨。
