稳定同位素技术在水生动物食性研究的应用
2023-11-16田金龙李俊伟董宏标曾祥兵张家松
田金龙,李俊伟,董宏标,曾祥兵,张家松
(1.河北农业大学海洋学院,河北 秦皇岛 066000;2.中国水产科学研究院南海水产研究所,农村农业部南海渔业资源开发利用重点实验室,广东 广州 510300;3.中国水产科学研究院南海水产研究所深圳试验基地,广东 深圳 518121)
食性研究能够分析动物与环境之间的联系,是生态学中一项重要的研究内容[1]。常规的动物食性研究方法有直接观察、胃内容物分析、食物残留物分析以及排泄物分析等[2]。这些方法有较大的局限性,如样品只能够反映动物近期的摄食情况,无法客观反映中远期的摄食情况以及发育过程中食性的转变;短暂而非长期的摄食对象影响研究结果的准确性[3];而对于珍稀和微小物种的研究存在着样品损伤程度高、研究周期长、劳动强度大和技术要求高等特点[4]。
水生生态系统具有复杂的营养结构,传统水生动物食性研究方法效果较差。同位素示踪技术将观察与识别水平上升至分子层次[5],广泛应用在地球化学、农业化学、环境化学等研究领域,是科学研究的精确手段。国际原子能机构年报指出:同位素示踪技术的影响广度可能只有现代电子学和数据处理才能与同位素相比[6]。其具有示踪与指示等功能,以检测快捷、结果准确等特点,可以判断动物食物来源、摄食偏好、栖息地环境、分布格局以及洄游路线等关键信息[7,8]。面对水生动物复杂的营养级结构,稳定同位素技术不仅能反映出实时的营养级位置与能量流动,还可用于研究养殖生物生长过程中食性的转换和食物链中捕食者与被捕食者的相互关系。本文介绍了稳定同位素技术原理以及在水生动物体内的分布、影响因素和食性案例,为稳定同位素在水生生物食性研究中的应用提供参考。
1 稳定同位素技术的原理
自然界中大多数元素都存在两个或者两个以上的同位素,不同同位素之间的细微化学差异是由中子的数量决定[9]。在食物流动中,较重的同位素在摄食动物中具有累积的倾向,以重同位素形式(13C和15N)保留在组织中,而轻同位素形式(12C 和14N)则被排泄出机体。这种代谢效应导致动物消费者与生长者之间的同位素差异,称为同位素分馏效应,导致自然环境中某一物种在食物网位置越高,其组织中的重同位素就越多[10-13]。因此,同位素差异为稳定同位素作为生物标志物或者示踪剂在水生动物食性研究中的应用提供了条件[14]。目前水生态系统应用较多的同位素是碳(13C/12C)、氮(15N/14N)和硫(34S/32S)[15]。碳稳定同位素的分馏程度小,可用于检测水生动物的摄食种类;氮稳定同位素则存在一定程度的同位素分馏,可以检测个体的生长代谢过程,或者群体状态下食物网的结构和营养级;硫同位素则在微生物的代谢规律、环境污染、气候变化的响应中有重要作用。因此,分析动物组织的稳定同位素可以得出所处特定时间段的食物来源、生存环境、分布特征及洄游路线等关键信息[16]。
一般来说,稳定同位素值用符号δ 来表示,其定义为:
式中,X 表示所测定元素,如:C、N、O、H 和S等,R 为元素重同位素和轻同位素的比值,R 标准品为国际统一标准品的同位素比值。
2 影响水生动物体内稳定同位素组成和分布的因素
2.1 食物来源对水生动物体内稳定同位素的影响
稳定同位素是一种基于生产力的定量方法,不同的食物来源会影响动物体内的同位素组成,可通过测定水生动物与其摄食物的稳定同位素值来判断食物来源、量化食物比例和同化物质的速率、探究长期食性及生命活动规律[17]。水生动物组织中碳同位素反映了光合途径中有机质的来源,例如C3植物(Calvin 途径)通过RUB 羧化酶固定CO2,而C4植物(Hatch-Slack 途径)以PEP 羧化酶固定CO2。两种羧化酶的不同途径,导致13C 在不同植物之间分布差异,C3植物δ13C 值介于-34‰~-25‰,平均值约为-27‰;而C4植物的δ13C 值介于-17‰~-11‰,平均值约为-13‰[18]。因此,在海洋环境中稳定碳同位素比值δ13C 可以显示底栖和中上层、近岸和近海、淡水和海水摄食者之间的差异。氮同位素的分馏效应使得δ15N 能够反映水生动物机体营养水平,消费者的稳定氮同位素比值δ15N 在营养同化过程中高于生产者,可以反映出数周至数月内的摄食行为[19]。通常情况下,用稳定同位素混合模型来估计同化食物来源对动物组织的相对贡献。早期Saito 等[20]建立同位素质量平衡方程,能够采用一种同位素定量计算对两种食物的来源。
式中,C 表示测定的稳定同位素种类,δ13Cm为消费者同位素比值,δ13Cx、δ13Cy则代表食源x 和y的校准后的稳定同位素比值。
水生动物的食源往往多样化,当食源超过n+1时,方程组不确定,无法使用模型。Phillips 和Gregg等[21]改进了同位素质量平衡方程与编写了IsoSource应用程序,可以在食源数量超过n+1 的情况下计算潜在食源贡献的频率和范围。
式中,f1、f2、f3表示三个未知的比例食源贡献,m表示混合物,X、Y 表示测定的稳定同位素种类,δXm和δYm则代表稳定同位素种类X 和Y 校准后的消费者稳定同位素值。
稳定同位素技术在研究生态问题时也有局限性,尤其是当某些食源的比例很不稳定,特定值的选择,例如最大值与最小值的选取会造成结果难以解释。贝叶斯模型将概率模型拟合到同位素数据中,涵括各种不确定性源、鉴别因子、大于n+1 的源、以及直观的估计框架中的分层结构,减少了分析水生生物食源的不精确性[22,23]。贝叶斯混合模型表达式为:
式中:Xij表示混合食源i 同位素j 的δ 值;Pk表示食物来源k 的比例;Sjk表示第k 个食物来源的第j 种同位素的δ 值,服从均值为m 方差的正态分布;Cjk表示第k 个食物来源的j 同位素的分馏系数,服从均值为λ 方差为τ 的正态分布;ε 是残余误差,表示其他各个混合物间无法量化的方差,其均值和标准差在通常情况下均为0。
2.2 代谢过程对稳定同位素富集的影响
生物体内稳定同位素值的变化不仅取决于反应物的同位素组成,而且反应动力学的途径以及物理化学条件也影响稳定同位素的富集。例如机体营养状况、体型、饮食质量、同化效率、排泄形式、蛋白质周转率等代谢影响因素[24,25]。由于稳定同位素的物理化学差异而显得高度规律,可以跟踪宏观化学反应的分子通量来计算生物体内稳定同位素的通量。如分子发生在合成和分解代谢亚通量分配过程中的同化、生长以及转换合成和原子在转化过程中的重新构建。这为研究水生动物食性微观过程与宏观现象提供一种新的方法,使得生物体与所处环境之间的质量通道连通(图1)。
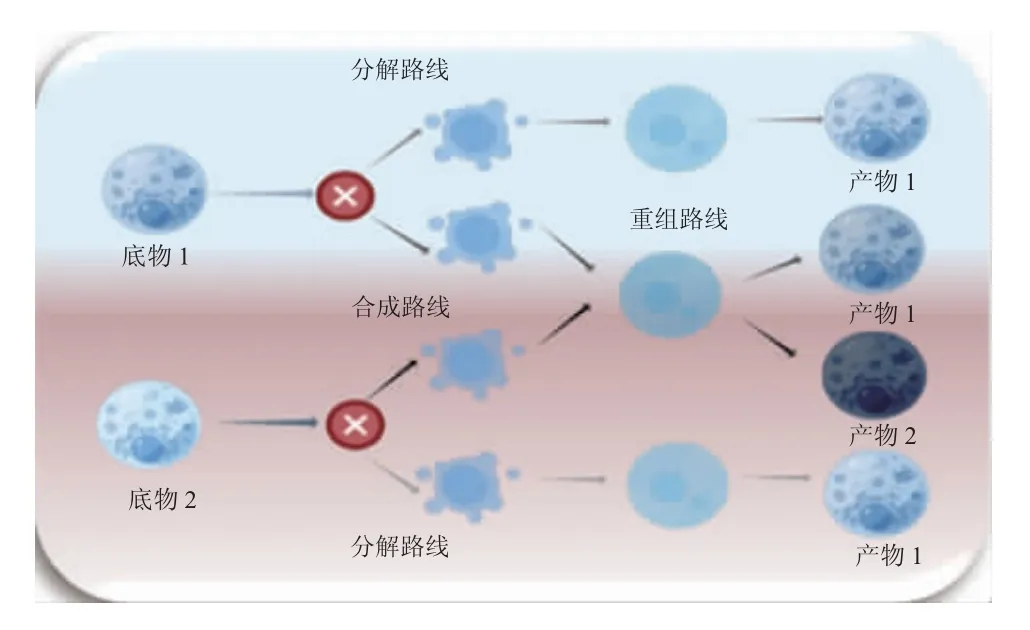
图1 同位素视角下细胞产物合成示意图Fig.1 Schematic diagram of cell product synthesis from isotope perspective
机体细胞中一种广义化合物转化为其他化合物的几个步骤不会改变剩余化合物的同位素组成。如果只有一个底物参与宏化学反应,则产物具有与底物相同的同位素组成:产物1 在分解代谢途径中具有与底物1 相同的同位素组成。如果有两个及以上的底物参与反应,则产物2 的同位素组成取决于底物1 和底物2 的比例(图1)。
3 稳定同位素的应用案例
3.1 食物来源分析
许多水生动物生长过程中往往会伴随着食性的多次转变,尤其是幼鱼阶段,摄食较为复杂。研究水生动物食性有助于人工饲养驯化和集约化生产,提高生产效率。以胃内容物为主的分析方法对摄食习性与营养级的鉴定中,虽然对短期饵料生物的判别与鉴定直观与精准,但面对消化度高的饵料生物以及有机碎屑多的情况下,不能客观反映长期的摄食偏好以及食性转变[26]。稳定同位素技术针对水生动物生长中的食性转变与能量流动,长期的捕食与被捕食关系等方面具有一定优势与便利性。
Wild 等[27]结合稳定同位素分析与贝叶斯混合模型,分析来自阿拉斯加湾抹香鲸(Physeter macrocephalus)和七种潜在食源的组织样本。结果表明,δ13C 和δ15N 分馏系数分别为(1.28±0.38)‰和(2.82±0.30)‰,法式角鲨(Squalus suckleyi)、鳐(Rajidae spp)和岩鱼(Sebastes spp)在抹香鲸食源中的比例依次为35%、28%和12%,为渔民和渔业管理人员提供了了解重要渔业物种信息。宁加佳等[28]在研究汕尾红海湾海域口虾蛄(Oratosquilla oratoria)饵料中不同生物的食物贡献比例发现,口虾蛄的δ13C值为-18.1‰~-16.3‰,δ15N 值为10.9‰~13.5‰,δ13C 和δ15N 分馏系数分别为(0.4±1.3)‰和(3.4±1.0)‰,δ13C 和δ15N 值的变化幅度均较大,意味着口虾蛄的食物来源较多,其中各食源贡献占比依次为贝类38.6%、蟹类22.9%、桡足类16.0%和鱼类8.9%。为了确定稻-虾共作养殖模式克氏原螯虾(Procambarus clarkii)对稻田中丰富自然资源的利用效率,李聪等[29]通过稳定同位素分析了不同蛋白含量的饲料(“碳/ 氮”C/N 分别为8、12和16)对养殖克氏原螯虾生长的贡献,发现δ13C 和δ15N 分馏系数分别为(0.96±0.38)‰和(2.12±0.53)‰,人工投喂的饲料占比分别为38.03%~44.17%、22.13%~25.35%和18.85%~19.40%;据此而优化了投喂策略,既避免了饲料浪费与过量投喂,又提高了克氏原螯虾对于稻田天然饵料的利用率,利于实现对稻田资源的合理利用。因此,在水产养殖生产中运用稳定同位素技术分析食性,可以优化饵料种类组成,提高饵料利用率,实现健康高效生产。
3.2 食物网结构和营养级分析
食物网中的能量流动与物质循环可以评估水生动物在所处环境中的适应性变化,阐明不同营养级之间的相互联系。稳定同位素能够分析有关原始营养来源的信息,即追踪从底层生产者到顶级捕食者的能量流动和营养循环,估计营养水平,资源利用和食物来源,为适应性过程、物种瓶颈、种群动态和保护优先物种提供数据支撑[30]。通过稳定同位素构建栖息地选择和利用模型,确定觅食策略和营养分流,评估物种的生存状况和生态系统功能,发现复杂食物网动力学背后的机制过程[31-33]。稳定同位素营养级计算公式为:
式中,TL 表示所测定水生生物的营养级;δ15Nsample为系统消费者氮稳定同位素比值;δ15Nbaseline为该系统基线生物的氮稳定同位素比值;△δ15N 为1 个营养级的富集度;a 代表所选取基线生物的营养级。
在水生态系统中,初级生产者的碳和氮稳定同位素比率随时空变化而变化。初级生产者和初级消费者稳定同位素值的变化规律对研究食物网至关重要。郭承秧等[34]研究了雅浦海沟的底栖生物营养级与食物来源,浮游植物的δ13C 和δ15N 分别为(-22.8±0.4)‰与(5.4±0.4)‰,浮游动物的δ13C和δ15N 为(-21.8±0.8)‰和(6.8±0.2)‰,而巨型底栖生物的δ13C 和δ15N 为-20.1‰~-16.8‰和11.9‰~17.9‰,此差异表明巨型底栖生物的初级食源浮游动物与浮游植物等在向下输送过程历经食物链传递和细菌的降解。而营养级方面则海绵(3.4~4.7)、海参(3.3~3.6)、海蛇尾(3.4~3.5)、海星(3.2~3.7)、钩虾(2.9~3.3)、海葵(3.1),表明了不同物种间食源存在多元化。为了阐明大亚湾珊瑚礁生态系统的简化食物网结构,朱文涛等[35]应用稳定同位素技术测定了大亚湾珊瑚礁区样品的δ13C 和δ15N值,发现食物网δ13C 和δ15N 分别为-23.22‰~-10.76‰、4.32‰~15.82‰;营养级范围分别为腹足类1.84~2.68、双壳类1.70~2.49、鱼类2.45~3.64,结果表明藻类与浮游植物等初级生产者为食物网提供了重要碳源。陆亚楠等[36]采用稳定同位素技术分析了江苏近海不同季节的生物类群,结果表明春季营养级范围为1.52~4.28,夏季营养级范围为1.25~3.52,秋季营养级范围1.34~4.15。春季食源较广,生物营养层次与群落多样性高;夏季食源更丰富,但生态位分化程度底;而秋季食物网结构较单一,营养生态位分布较广。这些稳定同位素的应用研究为近海渔业环境保护和渔业资源恢复与管理提供一定科学依据。
3.3 水生动物洄游路线分析
洄游能使鱼类获得更有利的生存条件,更好地适应环境、繁衍后代[37]。稳定同位素利用个体中不同组织周转率,以跟踪δ13C 和δ15N 随时间的变化,量化鱼类洄游中的食物来源,推断不同的栖息地环境进而得出洄游路线[38-40]。通过洄游路线分析物种内、种群内和个体之间觅食行为的微观栖息地变化,为监测渔业资源、提高渔业生产效率及增殖放流等提供一个新的观察角度,也可为珍惜洄游鱼类的保护提供规划。
为了确定安大略湖大西洋鲑(Salmo salar)种群是否会到大西洋溯河产卵,Guiry 等[41]利用考古发掘的骨骼与历史博物馆存档的鲑鳞片进行碳、氮、硫稳定同位素分析,结果表明来自安大略湖的原始鲑种群其整个生命周期并没有迁移到大西洋溯河产卵。该项研究时间跨度长达500 余年,为后续增殖放流和资源保护提供了重要依据。崔莹等[42]通过采集野生中华绒螯蟹(Eriocheir sinensis)洄游路线上不同时间段的幼体及可能的食物来源,探讨在洄游时期幼蟹的食性转变。结果发现,从大眼幼体到幼蟹,δ13C 值减小,而δ15N 值增加,表明野生绒螯蟹洄游迁徙过程中营养级增高,由摄食浮游生物转变为底栖生物,且逐渐加大摄取陆源性食物。Silva等[43]利用贝叶斯混合模型研究亚速尔群岛蓝鲸(Balaenoptera musculus)、塞鲸(Balaenoptera borealis)、长须鲸(Balaenoptera physalus)的营养生态位和迁移途径。结果表明,长须鲸δ15N 值高于蓝鲸和塞鲸,表明其具有较高营养位的摄食,混合模型则证明蓝鲸和塞鲸主要利用来自非洲西北部上层和中上层热带/亚热带地区的食源,而长须鲸利用伊比利亚半岛周围食源。稳定同位素技术的应用为有效保护物种、迁移过程中的摄食信息起了关键性作用。
4 展望
稳定同位素为水生动物的食性研究提供了新的技术途径,可以从不同的角度开展研究,追踪营养物质的来源去向,在鱼类等开口饵料的选择、食性的转换、营养物质的吸收利用以及捕食的多样性等方面具有重要意义[44-47]。贝叶斯模型的引入可以在一定程度解决稳定同位素的食性研究所面临的方法学限制,但在食物网季节性变化与基线变化方面仍具有一定的挑战[48-51],未来需要对这两点设计新模型和算法。
食物来源相似的同位素比例经常重叠,无法识别特定食源物种,只能分辨大类的官能团,这可能会掩盖数量上次要但营养上重要的食源。通过与DNA 条形码、脂肪酸分析等[52-55]其他检测方法结合,进行饵料丰度分析时,可以提高在物种水平上确定潜在食源的准确性。未来随着稳定同位素检测方法示踪识别能力的提高,例如面对栖息地迁移、季节性食源变化和饵料出现频率时,水生动物同化饵料存在一定的时间滞后性,考虑稳定同位素动力学,量化稳定同位素周转率,建立特定条件下的同位素时钟来提供准确的参数[56],可以更好地定位物质、能量流动,为水生动物的食性研究提供更好的参考依据。
