中国48 个水体象鼻溞夏季种群结构及其与环境因子的相关性
2023-11-16王柳富薛文
王柳富,薛文
(1.上海海洋大学水产与生命学院,上海 201306;2.扬州大学动物科学与技术学院,江苏 扬州 225009)
富营养化程度加剧深刻影响全球淡水系统,特别是在夏季,温度的上升,浮游甲壳动物的世代时间变短,繁殖速率加快,一些耐受力强、特别适宜在富营养条件下生存的种类种群密度迅速增加成为优势种。若这些优势种的优势地位进一步扩大,则致使整个浮游动物种群的物种多样性下降[1-5]。因此,研究淡水浮游甲壳动物的组成结构,特别是一些指示性种群的夏季组成、分布遇见度,可以比较准确地判断水体富营养化的程度、为水体富营养化综合评价及防治提供科学依据[6-8]。
象鼻溞(Bosmina)属隶属节肢动物门,甲壳动物亚门、甲壳动物纲、双甲目、象鼻溞科,是广泛分布于淡水中的浮游甲壳动物。随着全球水体富营养化的加剧,该属在各地夏季浮游动物种群中的优势地位越来越明显,成为水质监测的一类指示性生物[9]。大量研究表明,象鼻溞属的种群结构不仅取决于水质理化因子,还与其他浮游甲壳动物种类有关。然而,这些研究大都局限于围网或单个湖泊的调查,大规模的地区研究相对匮乏,限制了象鼻溞属在不同区域水质监测的作用[10,11]。
本研究夏季高强度的野外采样,调查了中国5大湖区48 个水体中不同象鼻溞种类的丰度,统计了除象鼻溞属外的其他浮游甲壳动物丰度并测定了各水体的理化指标,以分析象鼻溞各种类的夏季空间分布格局及其生态学机制,揭示夏季象鼻溞不同种类与环境因子(水质理化因子和其它浮游甲壳动物)的关系,为淡水生态系统的生物监测提供地区性参考。
1 材料与方法
1.1 研究地区概况及抽样
我国地域辽阔,南北纬度、东西经度差较大,气候迥异,地势复杂,造就了不同的淡水湖泊。根据我国湖泊的地理分布、气候等因素,将我国划分为五大水体群[12]:(1)东部平原地区(EPR)位于长江中下游,水体富营养化程度较高;(2)蒙疆高原(MXP)地处干旱半干旱地区,气候沙尘多,降水少;(3)东北地区(NCR)地处湿润半湿润地区,属大陆性季风气候,该地区湖泊沉积物中含有丰富的有机质和腐殖质;(4)云贵高原(YGP)位于我国西南部,岩溶面积大,低富营养化湖泊较多;(5)青藏高原(QTP)海拔最高,是最近形成的地区,也是污染最轻的地区。2017 年夏季(7 月和8 月)对五个主要区域的水体进行了尽可能多的采样,以代表中国不同的地理水体类型:19 个水体位于EPR 上,7 个水体位于MXP上,4 个水体位于NCR 上,8 个水体位于YGP 上,其余10 个水体分布在QTP 上(图1)。

图1 五大地区采样点分布Fig.1 Distribution of sampling sites in the five regions
1.2 样品采集与处理
每个水体均匀选取3 个采样点,用GPS 定位经度(Lng)、纬度(Lat)和海拔(ASL)。用25#浮游生物网,在不同水层画“∞”字捞取3~5 min,将滤取的样品放入标本瓶中,现场加5%的甲醛溶液固定,标明日期和样点带回实验室,显微镜下鉴定浮游甲壳动物种类。用5 L 采水器在采样点不同水层取50 L,25#浮游生物网过滤,收集于水样瓶中,用5%甲醛固定,带回实验室放入4 ℃冰箱,利用“浮游计数板”定量分析浮游甲壳动物[13,14]。
采集浮游甲壳动物样品的同时,现场用溶氧仪、pH 计、透明度盘分别测量水温(WT)、溶氧量(DO)、pH 和透明度(SD),然后用采水器采集0.5 m深水样带回实验室检测氨态氮(NH4+-N)、亚硝酸氮(NO2--N)、总氮(TN)、总磷(TP)和叶绿素a(Chl.a)含量等水化指标,具体采样及测定方法参照湖泊富营养化调查规范[15]。
1.3 数据统计分析
先将数据(pH 除外)转换为log10(x+1),使其分布更接近正态分布。为了解象鼻溞属不同种类丰度与环境因子(水质理化因子和其他浮游甲壳动物)的关系,用SPSS16.0(SPSS,Inc.,Chicago,IL,USA)进行了Pearson 简单相关性分析。其次,用多元逐步回归分析象鼻溞属不同种类丰度与环境因子数据,消除各环境因子之间的自相关,筛选出相对重要的环境因子。
最后,为评估环境因子对整个象鼻溞属的影响,采用CANOCO 4.5 统计软件统计分析了象鼻溞属所有种类与环境因子的关系[16]。在数据空间排序之前,先对象鼻溞属丰度进行去趋势对应分析(DCA)。结果表明,最大梯度长度为0.339,小于3,表明象鼻溞属各种类对环境因子的响应呈线性,因此选用冗余分析(RDA)线性模型进行排序分析,再对排序结果进行999 次蒙特卡罗(Monte Carlo)置换检验,分析环境因子对浮游动物优势种分布的影响是否具有统计学意义(P<0.05)[17]。
2 结果与分析
2.1 水体理化因子
所采集水体位置范围分别是:Lat 19.24~49.19°N;Lng 86.44~127.24°E;ASL 2~5135 m(图1)。所测的各项理化指标范围如下:WT 13.4~29.8 ℃;DO 5.24~10.53 mg/L;pH 6.67~8.70;SD 0.32~2.92 m;NH4+-N 0.06~0.97 mg/L;NO2--N 0.001~0.067 mg/L;TN 0.02~4.17 mg/L;TP 0.08~0.93 mg/L;Chl.a 0.77~4.85 mg/m3(图2)。

图2 五大采样区域的水质变量箱形图Fig.2 Box plots of water quality variables in the five sampling sites
2.2 浮游甲壳动物丰度
本次调查中,QTP 地区的10 个水体中未发现象鼻溞属的任何种类(图1:灰色圆圈39~48),而在EPR、MXP、NCR 和YGP 4 个地区的35 个水体中,仅发现脆弱象鼻溞(B.fatalis)和长额象鼻溞(B.longirostris),这2 个种类及其他浮游动物丰度见图3。由图3 可知:EPR 和NCR 的长额象鼻溞(B.longirostris)的丰度较MXP 和YGP 水体中的丰度低,而脆弱象鼻溞(B.fatalis)的丰度则呈现相反的分布趋势。EPR 和YGP 的枝角类(Cladocera)丰度较MXP和NCR 高。EPR 和NCR 的桡足类(Copepods)丰度较MXP 和YGP 高。
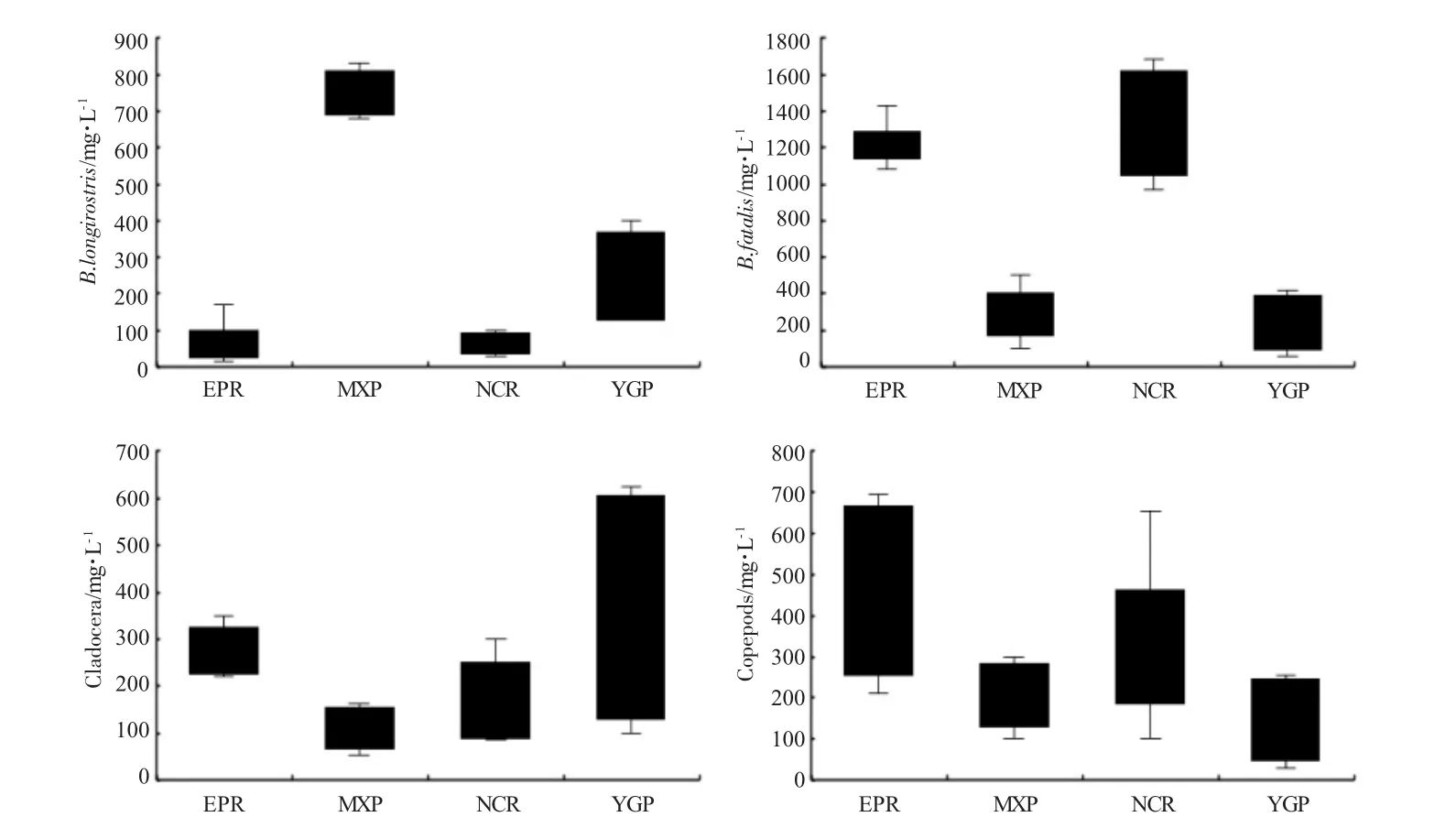
图3 象鼻溞属出现的水体及其中浮游甲壳动物丰度的箱形图Fig.3 Box plots of crustacean zooplankton density in 35 waterbodies where water fleas Bosmina found
2.3 象鼻溞属与环境因子的相关性
象鼻溞属与环境因子(其他浮游甲壳动物与理化因子)的Pearson 相关性分析见表1。从表1 可见,长额象鼻溞与DO、SD 呈显著正相关(P<0.05),而与TN 和TP 呈显著负相关(P<0.05),且与Chl.a 和桡足类呈极显著负相关(P<0.01)。脆弱象鼻溞与SD呈显著负相关(P<0.05),而与TN 和TP 呈显著正相关(P<0.05),且与Chl.a 和桡足类C 呈极显著正相关(P<0.01)。通过多元逐步回归分析,筛选出对象鼻溞属种群结构相对重要的环境因子,建立最优多元逐步线性回归方程,并进行显著性检验(表2)。相关结果表明,长额象鼻溞丰度回归方程共有DO、桡足类和Chl.a 等3 个因子入选,而入选脆弱象鼻溞丰度回归方程的因子为Chl.a 和桡足类。经F 检验,P均小于0.001,表明回归极显著。

表1 象鼻溞属同环境因子的Pearson 相关分析Tab.1 Pearson correlation between the Bosmina and environmental variables(N=35)

表2 象鼻溞属与环境因子的逐步多元回归方程Tab.2 Stepwise multiple regression between water fleas Bosmina and environmental factors
2.4 象鼻溞属与环境因子的RDA 排序
RDA 相关的统计信息如表3 和表4。RDA 排序的全部特征值解释了象鼻溞属种群变异程度的67.9%,前两轴共解释了象鼻溞变异程度的59.4%(表3)。Chl.a 和桡足类是影响象鼻溞属种群结构的最主要因素,DO、SD、TN 对其分布也有一定影响(表4)。从排序图来看(图4),长额象鼻溞与Chl.a、桡足类和TN 呈现负相关,与DO 和SD 呈现正相关;而脆弱象鼻溞则相反,与Chl.a、桡足类和TN 呈现正相关,与DO 和SD 呈现负相关。

表3 象鼻溞属与环境因子间RDA 分析的统计信息Tab.3 Redundancy analysis results for water fleas Bosmina and environmental variables

表4 前两个排序轴与环境因子间的相关系数Tab.4 Correlation coefficient between the first two ordination axes and environmental factors

图4 象鼻溞属与环境因子之间的RDA 排序图Fig.4 Redundancy analysis(RDA)biplot based on water fleas Bosmina density and environmental variables
3 讨论
3.1 青藏高原与象鼻溞属的传播
浮游甲壳动物象鼻溞属可通过水流、鸟类等媒介广泛传播。因此,之前的报道认为该属是一个世界性分布的枝角类[9],但本次研究却未在青藏高原的10 个水体中发现象鼻溞属的任何种类(图1:灰色圆圈39~48),表明象鼻溞属在该地区的传播受到限制,这可能与青藏高原独特的环境有关。青藏高原的水体大都处于贫营养状态,初级生产低,可供浮游动物摄食的食物较少[18],溞属浮游动物(Daphnia)独特的滤膜表型可塑性能够适应低食物浓度的环境[19],能产生对食物资源的有效垄断,限制了其他浮游动物的传播[20],因此,本次调查在青藏高原未发现象鼻溞属可能与该地区溞属浮游动物的广泛分布有关[21]。青藏高原作为世界屋脊(海拔4 000多米,平均高于海平面)被高山环绕,在生态上与中国其他地区隔绝[22]。栖息地越孤立,动物传播的可能性就越小,特别是浮游动物等通过被动方式传播的物种[23],这可能是象鼻溞属在青藏高原的传播受到限制的另一个原因。
3.2 四个区域水体中夏季象鼻溞属的种类组成
蒋燮治等调查认为,中国象鼻溞属有3 类,即长额象鼻溞、脆弱象鼻溞和简弧象鼻溞(B.coregoni)[13],然而本次夏季调查,除了青藏高原地区外,在其他四个地区(EPR、MXP、NCR 和YGP)只发现了长额象鼻溞和脆弱象鼻溞2 个物种,却未调查到简弧象鼻溞(图3)。以往的研究表明,象鼻溞属的种群演替与季节有关,不同季节的环境因子,如浮游植物、捕食者等可能造成象鼻溞属个别物种丰度的急剧下降[24,25],所以本次研究未调查到简弧象鼻溞或许与采样的季节有关,至于哪些环境因子导致这种现象尚需进一步的采样探究。
3.3 环境因子与象鼻溞属不同种类的相关性
虽然Pearson 相关性分析(表1)、多元逐步回归分析(表2)和RDA 排序(表4 和图4)的结果有所差异,但3 种分析均显示长额象鼻溞丰度与Chl.a和桡足类丰度呈显著负相关,而脆弱象鼻溞与Chl.a和桡足类丰度呈显著正相关,这表明Chl.a 和桡足类是影响长额象鼻溞和脆弱象鼻溞的2 个重要环境因子。
Chl.a 可以直接表征浮游植物生物量[26],可以间接推断出浮游植物的生物量与长额象鼻溞丰度呈负相关,与脆弱象鼻溞丰度呈正相关,这与以前的研究结论一致[24]。脆弱象鼻溞的体长略大于长额象鼻溞,摄食效率较高,更适应于高浓度浮游植物的环境,随着浮游植物的增加,其产卵量变大,种群增长率变高。相应地,由于脆弱象鼻溞的竞争优势大于长额象鼻溞,抢占了更多的食物资源,抑制了后者的生长繁殖,这可能是长额象鼻溞丰度与Chl.a呈负相关的原因[27]。本研究结果显示,桡足类丰度是影响象鼻溞种群结构的另一重要因子。以往的研究表明,桡足类中的剑水蚤(Cyclopoide)具有摄食小型枝角类的习性,这可能导致了长额象鼻溞丰度与桡足类丰度呈现负相关,而脆弱象鼻溞可以有效地躲避捕食者的攻击[24]。长额象鼻溞丰度下降,该种可能占据了水体里更多的资源,因而丰度与桡足类呈现正相关。总之,由于各自不同的摄食和躲避机制特点,长额象鼻溞与脆弱象鼻溞应对Chl.a 和桡足类的变化趋势不同[28]。
