发酵桔皮对酿酒酵母生长性能的影响研究
2023-11-14马吉喆吴雨来张林梅叶倩颖陆筑凤李加友
■ 马吉喆 吴雨来 张林梅 叶倩颖 陆筑凤 李加友* 徐 涛
(1.浙江理工大学生命科学与医药学院,浙江杭州 310018;2.嘉兴学院生物与化学工程学院,浙江嘉兴 314001)
随着生物工程技术、畜牧业和饲料工业的发展以及中国居民对高蛋白类食品需求量的增加[1],酵母类产品的开发利用已成为饲料工业的重中之重。中国饲料工业协会明确指出:我国的高蛋白饲料在配方结构、产品创新中更加趋向于酵母培养物类的饲料添加剂[2-3]。酵母饲料是利用酵母的新陈代谢,通过微生物发酵技术制成含有活菌、适口性良好、安全、无污染、无残留的酵母培养物[4-5]。研究报道酵母饲料[6-7]不仅具有原料来源广泛、生产速度快、蛋白质含量高的优点,而且可以调节动物肠道微生物菌群结构、提高饲料利用率、增强动物机体免疫力[8-12],在畜牧养殖业生产中具有广阔的应用前景。但酵母存在的培养产量低、效率差等问题,使得酵母铬、酵母葡聚糖、生物多肽等相关酵母饲料成本过高[13-15]。研究表明,提高酵母的生长性能主要采用添加辅助因子[16]和培养基优化改良[17]等方法。其中,通过添加海藻糖等辅助因子可以增强酵母免疫力,使酵母具有高生物活性,但价格昂贵不便于投入到工业生产应用中。因此有必要进一步研究酵母菌在发酵过程中营养成分之间的相互作用,通过添加发酵桔皮和酵母培养基优化相结合,观测酵母的生长趋势变化,从而在酵母饲料工业中做到降本增效、改善生产工艺、提高产品的市场竞争力。
1 材料与仪器
1.1 试验材料
桔皮,宁波市象山华宇罐头厂;葡枝根霉(Rhizopus stolonifer)1118,嘉兴学院发酵食品开发与分析检测实验室保藏菌种;酿酒酵母(Saccharomyces cerevisiae),安琪酵母股份有限公司;葡萄糖(食品级),浙江一诺生物科技有限公司;酵母浸膏,上海阿拉丁生化科技股份有限公司;尿素(纯度≥99.5%)、无水硫酸镁(纯度≥99.5%)、磷酸二氢钾(纯度99%)、蛋白胨,上海阿拉丁生化科技股份有限公司。
初始发酵培养基(g/L):葡萄糖100、酵母浸膏10、尿素2、无水硫酸镁2 、磷酸二氢钾5。
1.2 仪器与设备
ZHWY-200B 型全温摇床,上海智城分析仪器制造有限公司产品;CT14RD11台式离心机,上海天美生化仪器设备有限公司产品;FR124CN 型分析天平,奥豪斯仪器有限公司产品;紫外分光光度计,上海美谱达仪器有限公司产品。
2 试验方法
2.1 发酵桔皮的制备
称取适量干燥桔皮,研磨过筛(10目筛网)置于发酵桶中,加入桔皮粉干重1.5 倍质量的水,混合均匀,用直径1 cm打孔器从匍枝根霉1118的PDA固体培养基上取2 个菌苔,加入培养基中,使菌种与桔皮粉充分接触。于28 ℃恒温培养15 d。对发酵物进行过滤除渣,制成浸膏状水溶性发酵桔皮(干物质含量21%),4 ℃下冷藏保存,备用。
2.2 酵母培养
菌种活化:将1 g酿酒酵母活性干酵母加入100 mL葡萄糖含量为2%的培养基中,38 ℃、220 r/min 摇床振荡培养30 min,对菌种进行活化,制得种子菌液。
酿酒酵母发酵培养:取1 mL 种子菌液接种至100 mL发酵培养基中,28 ℃恒温培养。
2.3 酵母浓度测定
2.3.1 标准曲线绘制
取酵母发酵培养基中1 mL 的样液于显微镜下计数,将样液分别梯度稀释10、20、30、40、50 倍,并测定OD600,绘制OD600与对应酵母活菌数的标准曲线。
2.3.2 检测方法
参照参考文献[18],采用吸光光度法对发酵液的生物量进行测定。并将发酵液进行梯度稀释至1/20,利用分光光度计于600 nm 处测定吸光度,结果记为OD600,并以此读数作为培养基中的酵母浓度。
2.4 培养基优化试验
2.4.1 单因素试验
以酿酒酵母初始发酵培养基为基础,分别考察发酵桔皮、葡萄糖、蛋白胨、酵母膏等不同添加量对酿酒酵母生长的影响,每次处理只改变初始发酵培养基的一个因子。按1%(W/V)接入活化酿酒酵母,28 ℃下恒温培养24 h检测OD600,确定各单因素的最佳水平。
2.4.2 正交试验
在单因素试验的基础上,以发酵桔皮(A)、葡萄糖(B)、蛋白胨(C)及酵母浸膏(D)为考察对象,采用L8(2)7正交试验设计,对酿酒酵母发酵培养基进一步优化。各因素与水平见表1。
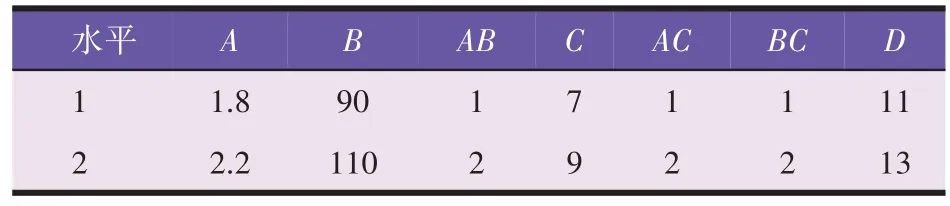
表1 正交试验因素水平(g/L)
2.4.3 Box-Benhnken响应面分析
在正交试验基础上,采用Box-Benhnken 设计结合响应面分析对发酵桔皮(E)、葡萄糖(F)、酵母浸膏(G)等三个主要影响因子进行优化。各因素Box-Benhnken设计方法与水平见表2。

表2 响应面分析各因素与水平(g/L)
2.4.4 桔皮发酵物成分检测
用常规方法检测桔皮发酵物中橙皮苷[19]、黄酮[20]等药效成分含量以及多糖[21]、蛋白质[22]、脂肪[23]等营养成分。
2.5 数据处理
每组试验进行5 次平行测定,借助Minitab 16、Design-Expert 13.0 和Origin 2021 对数据进行统计分析。P<0.05 为差异显著,P>0.05 为差异不显著,0.05≤P<0.10表示具有差异显著趋势。
3 结果与分析
3.1 培养基组分对吸光度指标的影响
见表3,对发酵样液中酵母活菌进行镜检并按梯度进行稀释。记录活菌数与OD600的对应变化绘制标准曲线,见图1,得到标准曲线方程:y=1.201 27x-0.129 62,其中R2为99.157。表明采用OD600作为酵母生物量的测定中,培养基组分对吸光度没有影响。

图1 酵母活菌数对应OD600标准曲线
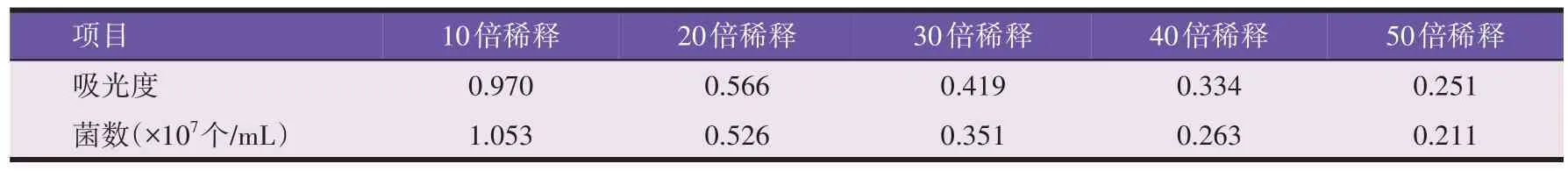
表3 活菌记录结果
3.2 单因素试验结果及分析
3.2.1 发酵桔皮浓度对酿酒酵母生长的影响
通过在发酵过程中添加相关的辅助因子能够促进酵母生长、增强代谢、弥补酵母营养缺失的物质[24]。在实验室对桔皮进行发酵处理后得到其水溶性浸膏状物质,并将其作为生长刺激剂添加到原始培养基中,研究不同浓度的发酵桔皮对酵母生长代谢的影响,结果如图2 所示。结果表明不同浓度的发酵桔皮可以不同程度提高培养体系中的酿酒酵母活菌数量,当发酵桔皮初提物浓度为2 g/L 时效果最好,酵母活菌检测值从0.302 提高到0.561,说明发酵桔皮对酵母的生长代谢具有良好的刺激作用。

图2 发酵桔皮添加浓度对酵母生长的影响
3.2.2 葡萄糖浓度对酿酒酵母生长的影响
葡萄糖是微生物生长的主要营养物质,初始浓度对生长和代谢都有重要影响[25]。在发酵桔皮浓度为2 g/L 的条件下,研究不同浓度的葡萄糖对酵母生长的影响,结果见图3。当葡萄糖浓度为100 g/L 时,酵母浓度提高到0.572;继续添加葡萄糖至160 g/L 时酵母浓度下降明显。说明葡萄糖浓度过高对酵母对生长具有抑制作用。
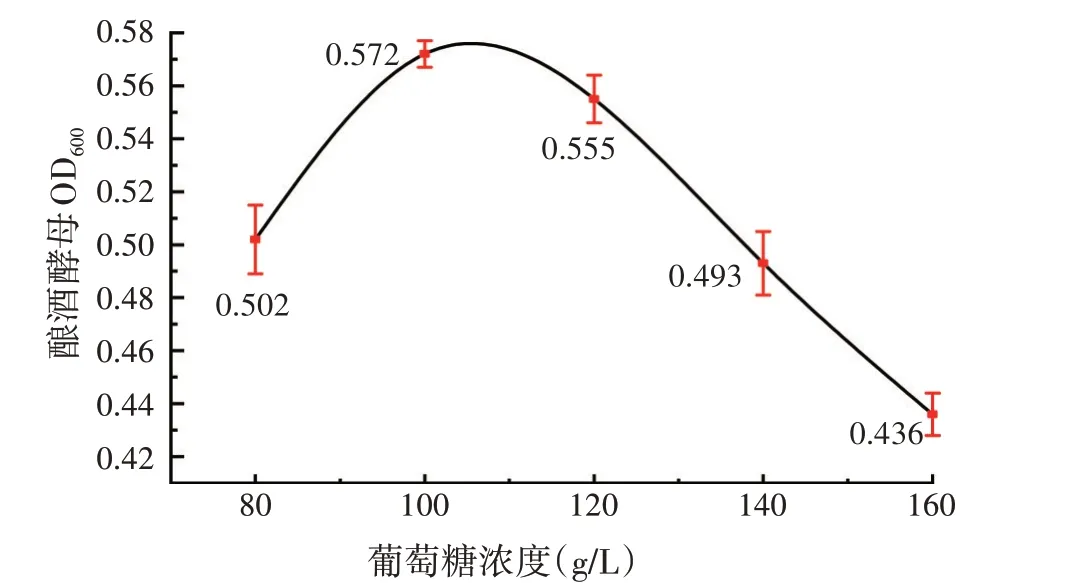
图3 葡萄糖浓度对酿酒酵母生长的影响
3.2.3 酵母浸膏浓度对酿酒酵母生长的影响
酵母浸膏富含丰富的营养物质,是酿酒酵母培养基的常用组分。通过改变原始培养基中酵母浸膏的添加量,考察酵母浸膏对酿酒酵母生长的影响,结果见图4。当酵母浸膏添加量为12 g/L 时,酵母浓度最高可达0.609;酵母浸膏继续增加菌体浓度稍有下降。

图4 酵母浸膏浓度对酿酒酵母生长的影响
3.2.4 蛋白胨浓度对酿酒酵母生长的影响
不同微生物对氮源的需求不尽相同,蛋白胨是酵母生长的常用氮源[26]。蛋白胨添加量对酿酒酵母生长的影响见图5,结果表明:在蛋白胨添加量为8 g/L时,酵母浓度达到最高值0.638。但是,在考察的蛋白胨浓度范围内(7~11 g/L),酵母浓度的最大差异仅为3%,变化并不显著。
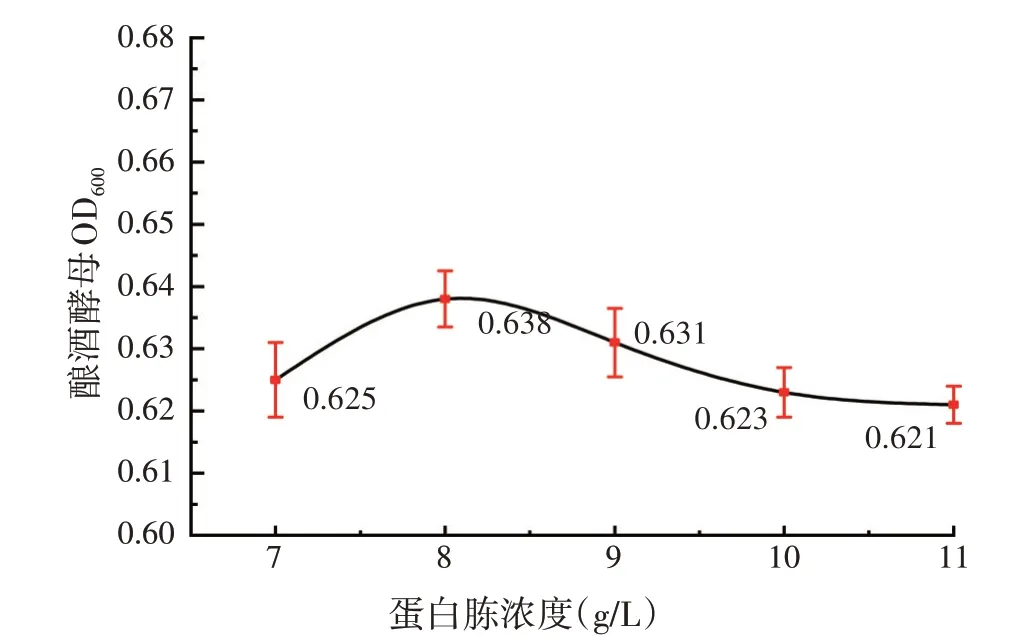
图5 蛋白胨浓度对酵母生长的影响
3.3 正交试验结果及分析
在单因素试验的基础之上,根据各单因素的最佳添加量,并结合不同因素之间的交互影响,采用7因素2 水平进行正交试验,结果见表4。根据极差(R)大小比较不同因素对酿酒酵母生长的影响:发酵桔皮(A)>葡萄糖(B)>葡萄糖与发酵桔皮的交互作用AB>酵母浸膏(D)>蛋白胨(C);另一方面,葡萄糖和发酵桔皮具有交互作用,可能是发酵桔皮有利于促进葡萄糖的代谢,具体机理有待深入研究。从表4 可以看出,培养基各因子的最优组合为A2B2C2D1。但蛋白胨浓度的影响水平只有0.02,相对较小,因此进行单因素最佳水平的响应面分析试验时不作为主要考虑因素。理论最优培养基为(g/L):葡萄糖110、蛋白胨9、酵母浸膏11、发酵桔皮2.2、无水硫酸镁2、尿素2、磷酸二氢钾5。
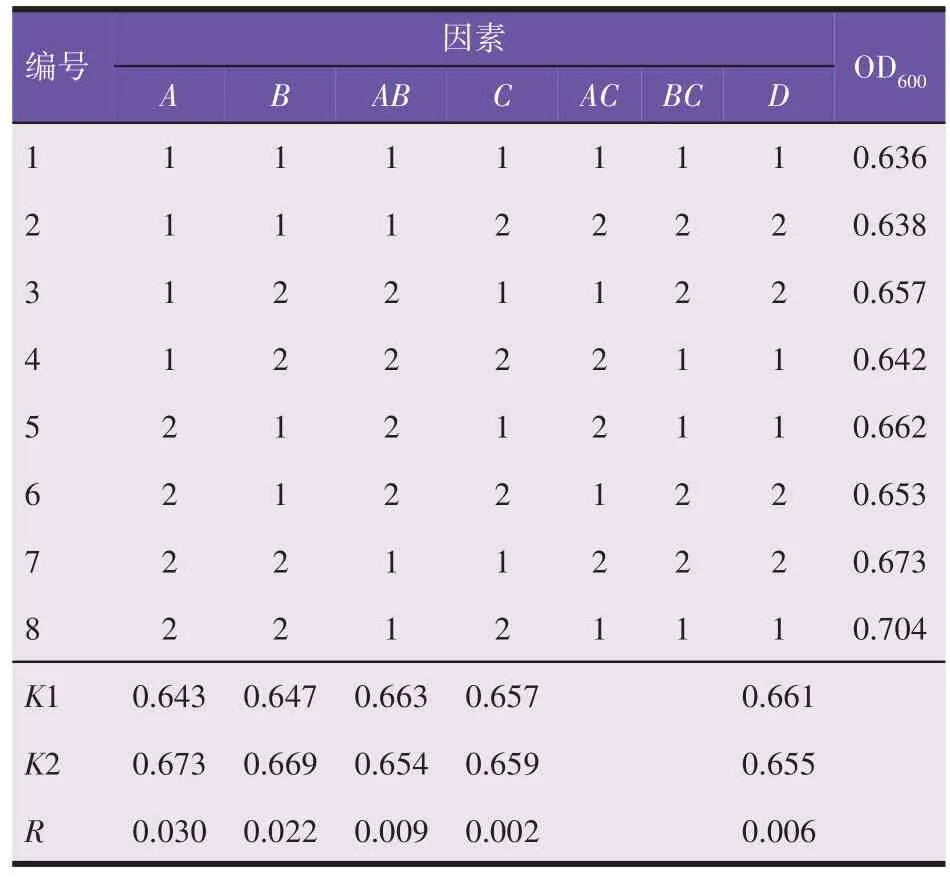
表4 正交试验结果
3.4 Box-Benhnken响应面结果及分析
3.4.1 Box-Benhnken响应面优化试验及结果分析
设OD600读数(Z)为响应值,采用Box-Benhnken响应面优化设计原理,考察发酵桔皮(E)、葡萄糖(F)、酵母浸膏(G)三个因素对OD600读数(Z)的影响。OD600读数响应面试验设计及结果见表5。由表5可以看出,不同添加量的E、F、G对OD600读数(Z)的影响各不相同。

表5 Box-Benhnken响应面优化试验及结果分析
3.4.2 OD600读数响应面优化试验回归模型及方差分析
将OD600读数(Z)响应面结果进行二次响应面回归分析,结果见表6。
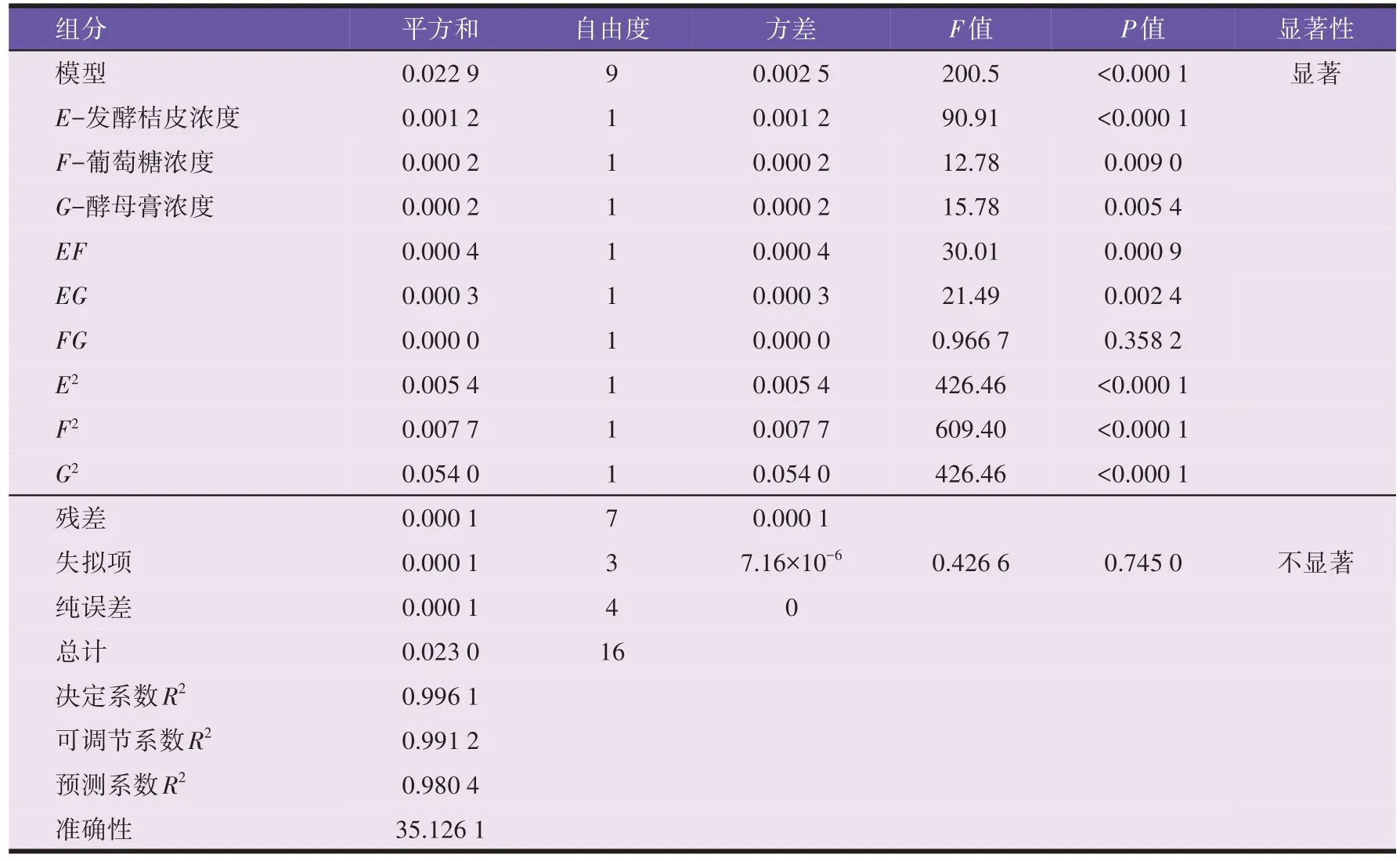
表6 各因素影响的主效应分析
由表6 可以看出,目标函数R的响应面模型P值远小于0.01,表示模型的显著性极好,所得多项回归方程可以准确反映各因素对响应值的影响。模型中的自变量一次项变量E、F、G和二次项EF、EG、E2、F2、G2的P值都小于0.05,说明E、F、G是重要的模型项且具有显著作用。其中预测系数R2与决定系数R2差值为0.015 7 表明该模型的预测结果与实际结果的合理一致性,准确性>4,表示该单因素响应面模型信号充足,可以用于模型预测设计。其决定系数R2为0.996 1,表明99.61%以上的响应值均可由该模型解释。因此可用该回归方程代替试验真实点对试验结果进行分析。
通过Design-Expert 13软件进行二次响应面回归分析,得到多元二次响应面回归模型:
式中:Z——OD600读数;
E——发酵桔皮浓度(g/L);
F——葡萄糖浓度(g/L);
G——酵母浸膏浓度(g/L)。
3.4.3 三维响应面分析
根据二次多项回归方程绘制出响应面,发酵桔皮浓度与葡萄糖浓度的响应曲面如图6,发酵桔皮浓度与酵母浸膏浓度的响应曲面如图7,葡萄糖浓度与酵母浸膏浓度的响应曲面如图8。
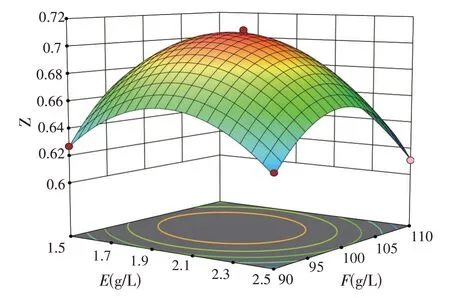
图6 E与F响应面3D建模

图7 E与G响应面3D建模
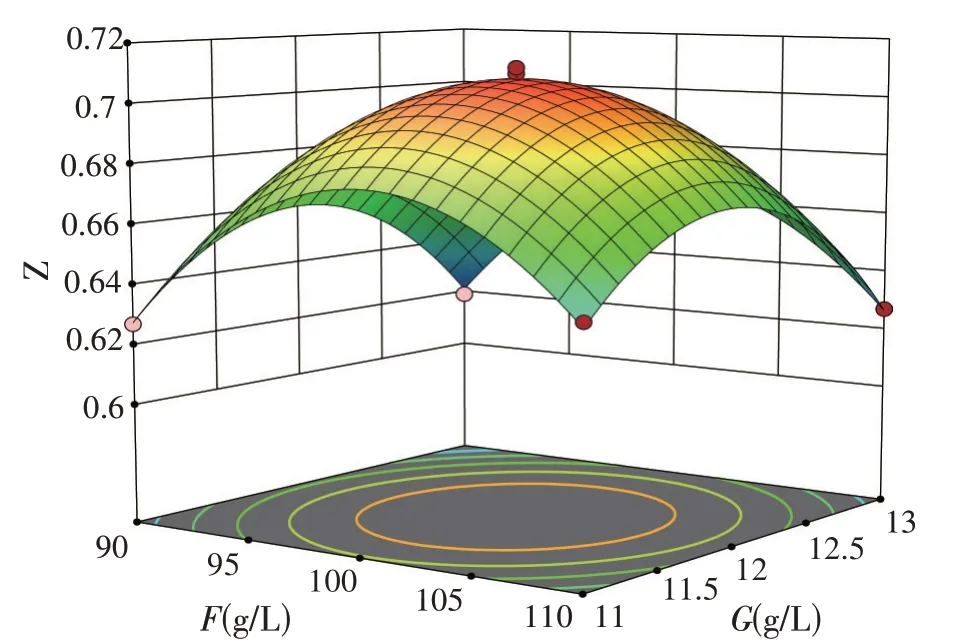
图8 F与G响应面3D建模
根据发酵桔皮浓度、葡萄糖浓度与酵母浸膏浓度两两之间的响应曲面表明,在发酵桔皮浓度E坐标轴上,OD600读数变化最快,而在酵母浸膏浓度G的坐标轴方向,OD600读数变化较慢,说明发酵桔皮浓度的影响水平较大。其中图6 的响应面扭曲最大,说明发酵桔皮浓度与葡萄糖浓度之间是具有明显交互作用;图7 的响应面扭曲程度也是显著的,说明发酵桔皮浓度与酵母浸膏浓度之间是具有交互作用。其中EF的P值小于0.05,证实正交试验中发酵桔皮浓度和葡萄糖浓度之间的交互影响作用,说明发酵桔皮的添加对OD600读数的影响并不是简单的线性关系,其中二次项EF、EG的P值小于一次项E、F的P值,且P值均小于0.05;说明该发酵桔皮对培养基中主要成分的交互影响作用大于其自身,表明发酵桔皮的添加可以刺激酿酒酵母的生长与代谢。
3.5 酵母发酵培养基优化结果
3.5.1 优化前后酵母数量的对比
通过Design-Expert 13软件优化结果见图9,在此预测条件下酵母浓度为0.709,具有97.9%的可信度。通过对酿酒酵母进行培养后酵母浓度为0.695,达到了响应面分析预测值的98.3%;相对于不添加发酵桔皮的优化培养基,酵母浓度提高了37.4%;与不添加发酵桔皮的初始培养基相比,酵母浓度提高了130%(见图10)。

图9 响应面模型优化结果

图10 优化前后酿酒酵母活菌对比
3.5.2 酵母生长曲线绘制
通过Design-Expert 13 软件优化结果,表明酵母发酵最佳培养基为葡萄糖100.756 g/L、蛋白胨8 g/L、酵母浸膏11.906 g/L、发酵桔皮浓度1.906 g/L、无水硫酸镁2 g/L、尿素2 g/L、磷酸二氢钾5 g/L。基于响应面分析得到的最优培养基培养酿酒酵母,以添加发酵桔皮的培养基为试验组,不添加发酵桔皮的培养基为对照组,绘制出酿酒酵母生长曲线,如图11 所示。发现发酵桔皮添加能够在各个时间段明显提高酵母活菌数量,并且缩短酵母进入对数生长期的时间。

图11 酿酒酵母生长曲线
3.6 桔皮发酵物成分检测结果
发酵桔皮与未发酵桔皮中营养成分比较见表7。通过对桔皮进行发酵处理后,发酵桔皮中的脂肪含量下降51.99%,总黄酮含量、橙皮苷含量、多糖、蛋白质含量得到了明显的提高,使得发酵桔皮中含有更多可供酵母吸收和利用的相关物质。
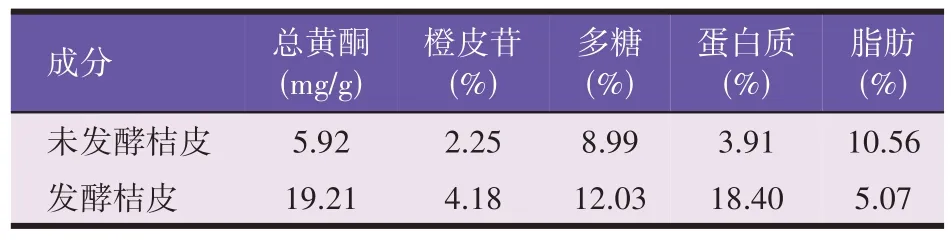
表7 发酵桔皮与未发酵桔皮营养成分
4 讨论
黄酮是一类具有促生长、免疫调节、抗菌的天然植物化合物,其来源广泛并且应用前景广阔。通过对发酵桔皮和未发酵桔皮的成分进行测定,发现经过发酵后桔皮中相关营养物质的含量大幅度提高,其中发酵桔皮中的总黄酮含量是未发酵桔皮的3.24倍,橙皮苷的含量为之前的1.86 倍,蛋白质含量为之前的4.71 倍。说明通过对桔皮进行发酵处理后,不但桔皮中有效的中药成分总黄酮含量得到了提高,而且降低了其中的脂肪含量,提高了多糖以及蛋白质等可供酵母菌生长的小分子营养物质的含量。其中橙皮苷是由橙皮素和芸香糖构成的一种重要的二氢黄酮类物质,具有较高的抗氧化功能。使得酵母细胞的衰老速度下降,更具有生物活力,使得酵母的生长速度提高。左瑞华等[27]研究发现蕨菜黄酮可以提高肉鸡的平均日增重量。杨汝才等[28]在饲料中添加辣木黄酮显著降低了雏鸭血清中丙二醛(MDA)含量。王咏梅等[29]在饲料中添加桑叶黄酮使得虾的抗氧化性能得到提高。因此,桔皮经过发酵后可以凭借其自身无污染、高蛋白、高抗氧化的特性作为酵母的生长刺激因子用于酵母高蛋白饲料的生产中。
5 结论
在单因素试验基础上,经过正交试验选出关键影响因子,结合响应面优化分析获得了酿酒酵母培养基的相关数学模型,推测出最佳培养条件为:葡萄糖100.756 g/L、蛋白胨8 g/L、酵母浸膏11.906 g/L、发酵桔皮浓度1.906 g/L、无水硫酸镁2 g/L、尿素2 g/L、磷酸二氢钾5 g/L。在此条件下酵母浓度为0.695,是初始发酵培养基的1.3倍。与不添加发酵桔皮的检测结果对比,发酵桔皮可以提高酿酒酵母增殖速率,促进酿酒酵母生长,加快酵母进入对数生长期,是一种高效的生长刺激剂。本试验丰富了酵母的繁殖环境,提高了酵母的发酵能力,为酵母饲料工业生产高蛋白饲料、提高相关酵母培养物产量以及降低生产成本提供一种新的途径。
