荚膜甲基球菌蛋白遗传毒性研究和被动皮肤过敏试验
2023-11-14高嫣珺陈秀云张思微卜仕金
■ 高嫣珺 聂 雅 陈秀云 张思微 刘 瑜 卜仕金*
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏高校动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009;3.扬州大学医学院,江苏扬州 225009)
豆粕是当前主流的饲料蛋白质原料,2022年饲料中豆粕用量为6 580 t,占比为14.5%[1]。我国大豆高度依赖进口,2022 年进口量达9 108 万吨,大部分用于生产饲用豆粕,但自然灾害等因素使其进口有很大的不确定性[2]。为了应对外部的不确定性,农业农村部于2023 年4 月12 日印发了《饲用豆粕减量替代三年行动方案》的通知,充分挖掘微生物菌体蛋白,实现2025 年新批准1~2 种微生物菌体蛋白上市,以减少豆粕依赖,是行动的目标之一[3]。荚膜甲基球菌蛋白(Methylococcus capsulatus bacteriameal,MBM)来源于天然存在的非转基因微生物的培养物,粗蛋白含量高达65%,主要由甲烷氧化菌荚膜甲基球菌在发酵过程中使用甲烷、氧气、氨氮和矿物质迅速增殖产生,其生产不占用耕地、不使用动植物性原料且仅耗费极少的水资源,相比于传统的动植物蛋白具有显著的优势[4-6]。研究表明,MBM 不仅可代替鱼粉成为大西洋鲑鱼、虹鳟、罗非鱼等水产动物饲用蛋白质来源,在畜禽(断奶仔猪、育肥猪)养殖业同样具有广阔的应用前景[7-10]。为了将MBM 开发为新饲料原料,本研究进行了包括鼠伤寒沙门氏菌回复突变(Ames)试验、小鼠骨髓细胞微核试验和小鼠精子畸形试验在内的MBM遗传毒性研究和大鼠被动皮肤过敏试验,提供MBM开发为新饲料原料所需的毒理学安全性评价资料[11],为MBM 在我国养殖业作为替代蛋白饲料原料应用奠定基础。
1 材料与方法
1.1 受试物
MBM,粗蛋白含量≥65%,褐色粉末。批号为FNJ012-20210308,由恺迪苏(重庆)有限公司南京中试基地提供。用于Ames 试验的不同浓度MBM 水溶液使用无菌水溶解;用于小鼠骨髓细胞微核和精子畸形试验的不同浓度的MBM 混悬液使用0.5%羧甲基纤维素钠配制;用于被动皮肤过敏试验的MBM 生理盐水溶液使用生理盐水溶解。不同浓度的MBM 溶液均采用2倍递次稀释法配制。
1.2 主要试剂
环磷酰胺购自Halle 公司;Giemsa 染液购自Solorbio 公司;叠氮钠、敌克松、2-氨基芴、2-氨基蒽和1,8-二羟蒽醌购自Sigma公司;羧甲基纤维素钠、磷酸氢钠铵、枸椽酸、磷酸氢二钾、硫酸镁、氯化钠、氯化钾、氯化镁、氢氧化钠、盐酸、磷酸氢二钠、二甲基亚砜、D-生物素、L-组氨酸、葡萄糖、6-磷酸葡萄糖、氧化型辅酶Ⅱ、琼脂粉、牛肉膏、胰胨等购自国药集团化学试剂有限公司。所有试剂均为分析纯。
代谢活化系统(S9)在试验前由多氯联苯在雄性成年Wistar 大鼠诱导制备,活力经诊断性诱变剂鉴定符合试验要求。
1.3 主要仪器
D98-9052B-2 隔水式电热恒温培养箱购自上海一恒科学仪器有限公司;CX2 光学显微镜购自Olympus 公司;Centrifuge 5415R 高速冷冻离心机、微量移液器购自Eppendorf 公司;BCD-251WDGW 购自Haier公司。
1.4 试验动物与菌株
试验动物:清洁级ICR小鼠100只,体重25~35 g,其中75 只为雄性,25 只为雌性;清洁级Wistar 大鼠250 只,体重150~180 g,雌雄各半。试验动物均购自扬州大学比较医学中心,动物生产许可证号为SCXK(苏)2022-0009,使用许可证号为SYXK(苏)2022-0044。
试验菌株:Ames 试验使用的标准测试菌株为组氨酸缺陷型鼠伤寒沙门菌TA97、TA98、TA100、TA102和TA1535,购自Moltox 公司,经生物学特性鉴定合格后用于试验。
1.5 试验方法
1.5.1 Ames试验
参考《兽药Ames 试 验指导 原则》[12]和《GB 15193.4—2014 细菌回复突变试验》[13]进行试验设计,根据点试法进行的预试验结果,设高(10 mg/皿)、中高(5 mg/皿)、中(2.5 mg/皿)、中低(1.25 mg/皿)、低(0.625 mg/皿)共5 个MBM 剂量组,另设阴性对照组(无菌水)及阳性对照组,每个剂量组包括有S9(+S9)和无S9(-S9)两个系列,采用平板渗入法,测试MBM对TA97、TA98、TA100、TA102 和TA1535 的致突变作用,每个MBM剂量组或对照组每种菌株分别设3个平行皿,于37 ℃培养48 h 后计数每皿的回变菌落数。如果MBM 剂量组回变菌落数的增加超过阴性对照组2 倍以上,且满足以下两种情况之一:①有剂量-反应关系;②某一测试点有可重复的阳性结果,则可判定为阳性结果。
1.5.2 小鼠骨髓细胞微核试验
参考《兽药小鼠骨髓细胞微核试验指导原则》[12]和GB 15193.5—2014《哺乳动物红细胞微核试验》[14]进行试验设计,设高(10 000 mg/kg)、中(5 000 mg/kg)和低(2 500 mg/kg)3个MBM 剂量组,另设阳性对照组(环磷酰胺40 mg/kg)和阴性对照组(0.5%羧甲基纤维素钠),每组10 只小鼠,雌雄各半。采用30 h 两次染毒法,即两次染毒间隔24 h,第2 次染毒后6 h 采集骨髓样品制片。MBM 剂量组和阴性对照组经口灌胃染毒,阳性对照组腹腔注射,高、中、低MBM 剂量组染毒药液分别为0.5、0.25、0.125 g/mL 浓度的MBM 混悬液,除阳性对照组外各组均灌胃20 mL/kg。每组采样10 只小鼠,使用胸骨段骨髓,吉姆萨染色,每只小鼠制片2张。阅片时每张涂片计数嗜多染红细胞(PCE)1 000个,观察并计数其中含有微核的PCE 细胞(一个PCE 中含多个微核按一个计),同时计数同一视野下的成熟红细胞(RBC)。计算PCE/RBC 比值和微核率(‰),按照公式计算微核率。
嗜多染红细胞微核率(‰)=含微核的嗜多染红细胞/检查嗜多染红细胞总数×1 000
PCE/RBC应在小鼠的参考值(0.6~1.2)范围内,阴性对照组微核率应小于5‰,如MBM 剂量组微核率与阴性对照组存在统计学差异,并且呈现剂量-反应关系,则可判定MBM微核试验结果阳性。
1.5.3 小鼠精子畸形试验
参考《兽药小鼠精子畸形试验指导原则》[13]和GB 15193.7—2003《小鼠精子畸形试验》[15]进行试验设计,设高(10 000 mg/kg)、中(5 000 mg/kg)和低(2 500 mg/kg)3 个MBM 剂量组和阳性(环磷酰胺40 mg/kg)、阴性对照组(0.5%羧甲基纤维素钠),每组10 只雄性小鼠。MBM 剂量组和对照组连续经口灌胃染毒5 d,高、中、低MBM剂量组染毒药液分别为0.5、0.25、0.125 g/mL浓度的MBM 混悬液,阳性对照组为浓度为2 mg/mL 的环磷酰胺溶液(溶剂为生理盐水),各组灌胃体积均为20 mL/kg。首次染毒后第35天安乐死动物,每组采样10 只小鼠,取双侧附睾制片,2%伊红染色,每只小鼠制片2 张,每只小鼠计数共1 000 个精子中的畸形数,并分类计数(分为无钩、香蕉形、无定性、双头、胖头、尾折叠和双尾),根据公式计算精子畸形率(%)。
精子畸形率(%)=畸形精子数/(正常精子数+畸形精子数)×100
阴性对照组精子畸形率在质控范围(0.8%~3.4%)内,且阳性与阴性对照精子畸形率差异极显著(P<0.01),则表明该试验系统可靠。MBM剂量组小鼠的精子畸形率为阴性的2倍或2倍以上,或有统计学差异,且存在剂量-反应关系,则可判断试验结果为阳性。
1.5.4 被动皮肤过敏试验
参考《化学药物刺激性、过敏性和溶血性研究技术指导原则》[16]进行试验设计,按体重设高(1 000 mg/kg)、中(500 mg/kg)、低(250 mg/kg)3 个MBM 剂量组,另设阳性对照组(牛血清白蛋白15 mg/kg)和阴性对照组(生理盐水)。10只大鼠,雌雄各半,随机均分为5组,对应各组剂量皮下注射,隔日一次,共3次,MBM剂量组和对照组均注射3 mL/kg,MBM和牛血清白蛋白溶剂均为生理盐水。末次致敏后第14天采血,2 000 r/min离心10 min 分离抗血清,使用生理盐水将各组抗血清为1∶2、1∶8、1∶32三个浓度。将240只大鼠分为5组,中、低MBM 剂量组各30 只,其余组各60 只,雌雄各半,在动物背部预先脱毛3 cm×4 cm 的区域,皮内注射各对应组不同浓度的抗血清0.1 mL进行被动致敏,中、低MBM 剂量组被动致敏24 h,其余组不同抗血清浓度分别致敏24 h和48 h,每组每个浓度不同时间均致敏10 只大鼠。到达致敏时间后,皮下注射与致敏剂量相同的激发抗原进行激发,同时静脉注射1.0%伊文思兰染料1.0 mL。30 min 后安乐死各组大鼠,剪取背部皮肤,测量皮肤内层的斑点大小,不规则斑点的直径为长径与短径之和的一半,直径大于5 mm者判定为阳性,计算各组的阳性百分率(%)。
1.6 数据分析
试验结果均采用“平均值±标准差”表示,使用SPSS 26.0软件进行统计学分析,组间统计学显著性比较采用X2检验,显著性水平为0.05,极显著水平为0.01。
2 结果与分析
2.1 Ames试验
Ames 试验结果见表1,MBM 每皿剂量为0.625~10.000 mg,有或无S9 时,5 种鼠伤寒沙门氏菌试验株的每皿平均回变菌落数均在阴性对照的两倍以内,未见剂量-反应关系,两次试验结果均一致。表明MBM对鼠伤寒沙门氏菌无致突变性,MBM 的Ames 试验结果为阴性。

表1 MBM鼠伤寒沙门氏菌回复突变试验结果(n=3)
2.2 小鼠骨髓细胞微核试验
由表2 可知,MBM 剂量组和阴、阳性对照组PCE/RBC 均在参考范围内,雌、雄小鼠MBM 剂量组PCE 微核率与阴性对照组比较无显著差异(P≥0.05),且阳性对照组与MBM 剂量组、阴性对照组比较差异极显著(P<0.01),同一MBM 剂量组内雌、雄小鼠微核率显著的性别差异(P≥0.05)。结果表明,MBM 在2 500~10 000 mg/kg 剂量范围内小鼠骨髓细胞微核试验结果为阴性。

表2 MBM小鼠骨髓细胞微核试验结果(n=5)
2.3 小鼠精子畸形试验
由表3 可知,阴性对照组精子畸形率在质控范围内,MBM 剂量组精子畸形率未达阴性对照组的2倍且与阴性对照组比较无显著差异(P≥0.05),而阳性对照组与MBM 剂量组和阴性对照组比较差异均极显著(P<0.01)。以上结果表明本试验系统可靠,MBM 在2 500~10 000 mg/kg 剂量范围内小鼠精子畸形试验结果为阴性。
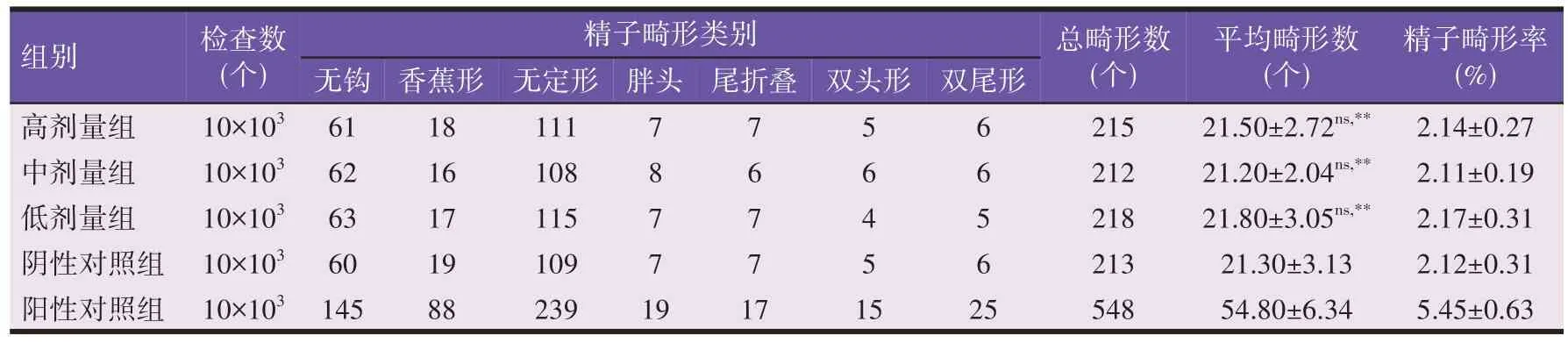
表3 MBM小鼠精子畸形试验结果(n=10)
2.4 被动皮肤过敏试验
由表4 可知,三个MBM 剂量组和阴性对照组在1∶2、1∶8、1∶32抗血清浓度,激发24 h和48 h,所有大鼠皮肤内侧的蓝色反应斑直径均≤5 mm,阳性对照组大鼠皮肤内侧的蓝色反应斑直径均>5 mm。MBM剂量组与阴性对照组比较无显著统计学差异(P≥0.05),与阳性对照组比较差异极显著(P<0.01)。以上结果表明MBM 在250~1 000 mg/kg 剂量范围内对大鼠的被动皮肤过敏试验结果为阴性。

表4 MBM被动皮肤过敏试验结果(n=10)
3 讨论
MBM 作为一种非动植物源性的新型可持续功能性蛋白原料在国外沿用已久,商品名为Feed-KindⓇ,但其首次进入我国市场,尚未批准使用[17]。《新饲料和新饲料添加剂管理办法》[11]中规定,新饲料原料的申请资料必须包括毒理学安全评价资料,因此对MBM 进行全面的毒理学安全性评价对其今后在我国畜禽养殖业的应用具有重大的推动作用。前期已完成的大、小鼠急性经口毒性试验和90 d 亚慢性毒性试验结果显示,MBM 在大、小鼠的LD50均≥10 g/kg,无作用剂量至少达到3 100 mg/kg。本研究所涉及的试验根据前期急性和亚慢性毒性研究结果和相关指导原则要求设置剂量组,保证受试物得到充分暴露。本研究参照《兽药研究技术指导原则》[12]和食品安全国家标准[13-15],进行MBM 的Ames 试验、小鼠骨髓细胞微核试验和小鼠精子畸形试验研究其遗传毒性,其中Ames 试验根据要求设置在最高剂量下设4 个剂量组,共设5 个MBM 剂量组;微核试验和精子畸形试验根据要求均设3 个MBM 剂量组。同时,参照人用药的相关指导原则[16]进行大鼠皮肤被动过敏试验,设3 个MBM 剂量组,在各剂量组设1∶2、1∶8、1∶32 共3 个抗血清浓度。在Ames 试验中,每皿剂量在0.625~10 mg 范围内,在加和不加S9时,各MBM 剂 量 组TA97、TA98、TA100、TA102、TA1535 回变菌落数均与阴性对照接近,远低于阳性的判断标准,表明MBM 对鼠伤寒沙门氏菌无致突变作用。骨髓细胞微核试验通过测量微核率来评价受试物对染色体的损伤,本试验剂量下,MBM 对小鼠骨髓细胞的微核率与阴性对照组无统计学差异且未达两倍,三个MBM 剂量组微核率接近,未呈现明显的剂量-反应关系;同时,小鼠精子畸形试验MBM 剂量组各类精子畸形数和总精子畸形率均符合阴性结果的标准。大鼠被动过敏试验中,三个MBM 剂量组在不同抗血清浓度和激发时间下,所有动物蓝斑直径均≤5 mm,均未出现过敏反应。
4 结论
在本试验条件和剂量下,MBM 未显示遗传毒性和潜在的致敏作用,MBM 作为新饲料原料使用具有较高的安全性。
