中国茶渍属地衣3个新记录种
2023-11-14图尔荪阿依排祖拉热衣木马木提
图尔荪阿依·排祖拉,热衣木·马木提
(新疆大学 生命科学与技术学院,乌鲁木齐 830000)
柳茶渍组是狭义的茶渍属中独特的类群之一,由几个形态密切相关的物种组成,包括Lecanoralbellula(Nyl.) Th. Fr.,L.subravidaNyl.,L.mughicolaNyl.,L.saligna(Schrad.) Zahlbr.,L.subintricata(Nyl.) Th. Fr.,L.sarcopidoides(A. Massal.) Hedl.,L.cf.subcinctulaNyl.,L.subsalignaM. Brand &van den Boom,L.coniferarumPrintzen,L.anoptaNyl.,L.quercicolaCoppins &P. James[3,10],所谓的狭义的茶渍属指的是果托含有色素,皮层含有黑茶渍素(atranorin)或松罗酸(usnic acid)的一类地衣[11]。柳茶渍组主要的分类特征为:通常树栖性和树皮生,无粉芽,地衣体树皮内生或呈表面地衣体,子囊盘茶渍型,孢子呈椭圆形,单胞,具有杆状和略微弯曲的分生孢子,主要的次生代谢产物是异松萝酸或松萝酸,多为生长在1 200 m以上的栖息地[3,10]。
巩乃斯林场位于天山中部伊犁河谷东端,巴音郭楞蒙古自治州西北边缘,东西长约55 km,南北宽约30 km,植被乔木树种以天山云杉为主,年均气温1.27 ℃,年均降水量可达900 mm[12],具有约7.85 hm2天然林资源。该研究材料采自新疆河静县西北部的攻乃斯林场,发现3个中国新记录种,即:亚异茶渍,栎生茶渍,针叶茶渍,研究结果为我国地衣的生物多样性提供科学性资料。
1 材料和方法
1.1 材 料
采自于新疆天山西部巩乃斯林场的20余份柳茶渍组地衣标本,其凭证标本现存于中国西北干旱区地衣研究中心标本室(XJU)。
1.2 方 法
对采自于中国新疆河静县西北部的攻乃斯林场的标本进行形态学-解剖学、化学次生代谢产物的研究和分子系统发育分析。
1.2.1 形态-解剖观察和次生代谢产物的测定
利用体视解剖镜(SZM45)和标准光学显微镜(Nikon Eclipse Ni)进行形态学和解剖学研究。使用解剖镜对地衣体和子囊盘各部位的特征进行观察,如:是否具有前地衣体、地衣体颜色、地衣体形状、子囊盘类型、大小、子囊盘粉霜的有无、分生孢子器的有无等,并做好描述和记录。
通过光学显微镜观察子囊盘特征,其对做好的切片分别用蒸馏水,KOH(K,10%的钾溶液)[13]和HNO3(N,68%的硝酸溶液),观察在子实层和皮层中的颗粒在K溶液和N溶液中的溶解程度和颜色变化。使用化学显色反应法(color test)和薄层色谱法(thin-layer chromatography,TLC)对地衣次生代谢产物进行观察和检测。显色反应操作步骤如下:在解剖镜下,将用KOH [10%的氢氧化钾溶液](K)、次氯酸钙 [次氯酸钙的饱和水溶液](C)、KC [氢氧化钾溶液与次氯酸钙溶液的混合液逐一进行滴加,即先加氢氧化钾溶液随后添加次氯酸钙溶液]、对苯二胺 [对苯二胺的无水乙醇饱和溶液](PD)等化学试剂用毛细管滴到地衣体和子囊盘等不同部位,在显微镜下观察颜色变化(观察颜色变化并记录有无颜色变化情况,若产生颜色变化记录“+颜色”,若无颜色变化记录为“-”);薄层色谱法用标准溶剂系统C(甲苯∶乙酸=200 mL∶30 mL)[14]。根据显色反应结果和薄层层析结果检索资料对照,确定所含地衣酸的种类。
1.2.2 DNA提取,扩增和测序
为了得到高纯度的DNA利用Ezup柱真菌基因组DNA纯化试剂盒,并按照操作指南进行DNA提取步骤。扩增的目的基因片段选取为rDNA-ITS和mtSSU,采用了引物ITS1F[15]5-CTTGTTCATTTAGAGGAAGTAA-3和ITS4[16]5-TCCTCCGCT-TATTGATATGC-3,mrSSU1[17]5-AGCAGTGA-GGAATATTGGTC-3和mrSSUR3[17]5-ATGTGGCACGTCTATAGCCC-3。PCR反应体系为25 μL:2 μL模板DNA、上下引物(10 μmol/L)各0.5 μL、12.5 μL Taq PCR master mix和9.5 μL双蒸馏水。ITS位点PCR扩增反应程序:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,5个循环,94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸60 s,30个循环,72 ℃延伸5 min。mtSSU位点PCR扩增反应程序:94 ℃预变性10 min,95 ℃变性45 s,50 ℃退火45 s,72 ℃延伸90 s,34个循环,72 ℃延伸 10 min。观察电泳结果,条带是否明亮清晰,是否单条,最后将合格的PCR产物由上海生工公司完成测序工作。
1.2.3 系统发育构建
构建柳茶渍组与相关类群的系统发育树。其构建步骤:测序成功的序列的剪切和拼接使用了SeqManII (DNASTAR)软件[4],序列对比使用了NCBI中的Blast进一步确定测序结果是否属于茶渍属,使用Muscle v5.0.1.102进行序列比对[18],通过Gbolocks (PhyloSuite_v1.2.2)进行序列不对齐和模糊区域剪切[19]。在PhyloSuite v1.2.2中,先把每个物种对应的ITS和SSU序列进行拼接,通过贝叶斯推理(BI)方法构建了系统发育树。BI分析在MrBayes v 3.2.7中进行,并且根据Akaike信息标准(AIC)在ModleFinder中选择了最佳模型,其模型为ITS:GTR+F+G4,SSU:GTR+F+I+G4,运行105代数,最后对各分支进行后验概率分析(posterior probability,PP)[20],舍弃树总数的25%,选出最优系统发育树,并其使用Itol(https://itol.embl.de/)在线编辑软件进行可视化和编辑,使用AI和Photoshop(PS,2020)进行进一步的美化。参与分析的序列包括自测序列和GenBank中下载的序列(表1)。
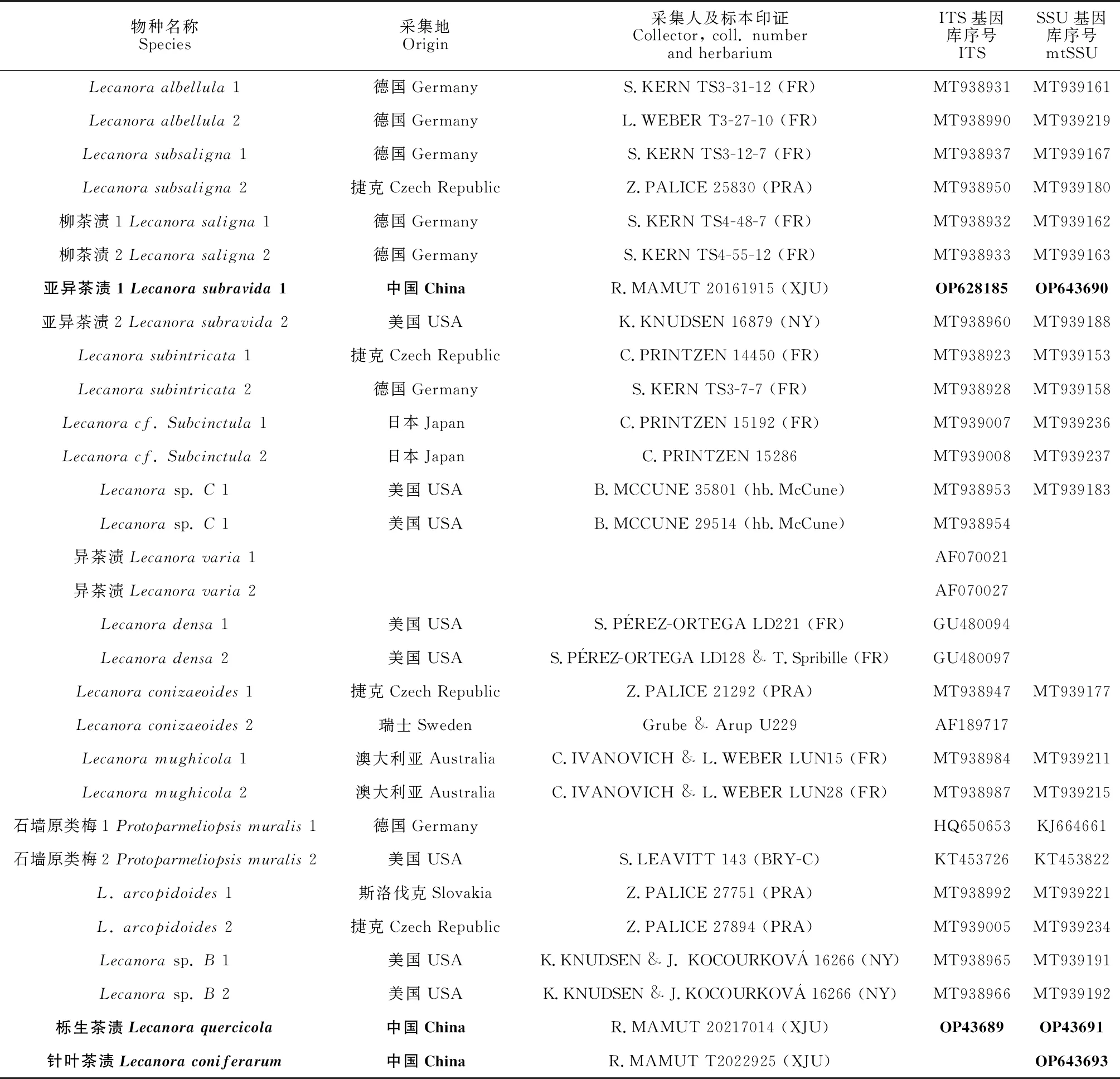
表1 地衣的物种、国家、引证标本和基因库号以及新序列以粗体显示
2 结果与分析
2.1 分类单元
本研究共鉴定出3个柳茶渍组地衣物种,分别为:亚异茶渍,栎生茶渍,针叶茶渍。所获得的物种形态-解剖特征描述如下:
2.1.1 亚异茶渍
亚异茶渍LecanorasubravidaNyl.,Flora, Regensburg 55: 250 (1872),见图1。地衣体发育良好,通常是细颗粒壳状,黄色,灰黄色,黄褐色或完全是灰色,无粉霜,有时地衣体不明显;未发现下地衣体;子囊盘茶渍型,数量众多,圆至不规则,单生或聚生(2~3个子囊盘),无柄,直径0.4~1.0 (-1.2) mm;盘面呈黄色,黄绿色至橙色,褐色,极少黑色,具轻微的粉霜或无粉霜;盘缘存在,光滑、全缘至略微波状,无粉霜,与地衣体同色或稍微苍白;果壳存在,皮层与藻胞层界限明显,藻胞层呈连续;皮层具有颗粒(偏振光可见)且完全溶解于K溶液,向宽度为20~35 μm,纵向高度为45~65 μm,含有丝状的菌丝;子实上层呈褐色至黑棕色,含有明显至不明显的颗粒且完全溶解于K溶液;子实层透明,厚度可达50~75 μm;子实下层透明,厚度可达25~45 μm;囊层基明显,无色,含有众多的菌丝(加K溶液更加明显);侧丝单一,基部稍微分支,不着色;子囊棍棒状,具茶渍型顶器,孢子8孢,单胞,椭圆形,大小在(5~11) μm×(4.5~7.5) μm之间;未发现分生孢子器。
显色反应:地衣体和子囊盘边缘K-或+黄色,C-,KC-,P+黄色;盘面K-, C-, KC-, PD-。
次生代谢产物:松罗酸(usnic acid),茶痂衣酸(psoromic acid)。
生长基物:树皮上。
标本印证:新疆巴音郭楞自治州河静县贡乃斯林场,2016-07-07,2 660 m,43°11′78″N,84°20′14″E,热衣木·马木提,20161915,20138156,2016723,20169889,20163276;新疆巴音郭楞自治州河静县贡乃斯林场,2013-07-06,2 660 m,43°17′58″N,84°11′14″E,热衣木·马木提,20132604,20138159,20138120,20138104,20137322,20137285,20132604,20132646,20132615,20132623,20132636。
世界分布:欧洲、伊朗[3,10]。
讨论:亚异茶渍是树皮上最常见的附生地衣之一。初次于1872年被Nylander报道并进行了简要描述,但未对其命名[15],2001年Printzen[9]认为该种是异茶渍的亚种:L.varia(Hoffm.) Ach. var.subravida(Nyl) Nyl。
该物种由于地衣体和子囊盘颜色变异性较大为特征使其容易被误认为与它密切其他物种,通常与异茶渍组的物种密切相关,它们经常生长在相同的栖息地。因此,在野外观察时,这些物种也经常混淆。亚异茶渍与异茶渍的外部形态密切相关,其亚异茶渍的子囊盘中通常有轻微的粉霜,但后者的子囊盘多为赭色至深棕色或黑色,通常是具厚重的粉霜[21]。它们也可以通过孢子形状区分开来,前者为宽椭圆形,后者多为长椭圆形[21]。该物种由于显色反应和所包含的地衣酸(茶痂衣酸)等特征也常与其他柳茶渍组的其他物种容易区分。
2.1.2 栎生茶渍
栎生茶渍LecanoraquercicolaCoppins &P.James,见图2。地衣体不明显,发育不良或仅在子囊盘基部;子囊盘茶渍型,数量较多,单生,几乎不聚生,贴生,直径0.2~0.5 mm;盘面呈棕色,红棕色或污棕色,具轻微粉霜,幼小时盘面完全不明显,成熟时变扁平;边缘存在,全缘,有时呈不明显的波状,无粉霜,与盘面平齐,黄色或与盘面同色;果壳存在,皮层与藻胞层分层不太明显,藻胞层呈连续;皮层较薄,具有在偏振光下可见的黄色颗粒物种,颗粒溶于K溶液不溶于N溶液;子实上层呈褐色至橄榄色,具有明显至不明显的黄色颗粒,有时可蔓延到子实层部分;子实层透明,厚度可达35~50 μm;子实下层无色,高约达15~35 μm;囊层基无色,厚度可达15~40 μm,含有不规则排列的菌丝;侧丝单一,不分枝或底部稍微分支,顶端稍微平大,顶部不明显着色;子囊8孢,宽棒状至棒状,具茶渍型顶器;孢子单胞,椭圆形,无晕圈,含有2~3个油滴,大小在(4~6.5) μm×(3.5~4) μm之间;未发现分生孢子器。
显色反应:子囊盘盘边缘K+, C-, KC-, PD-; 盘面 K-, C-, KC-, PD-。
次生代谢产物:松罗酸(usnic acid)。
生长基物:朽木上。
标本印证:新疆巴音郭楞自治州河静县贡乃斯林场,2013-07-30,2 660 m,43°11′58″N,84°20′14″E,热衣木·马木提,20217014,20138112。
世界分布:欧洲[10]。
讨论:栎生茶渍与LecanoraalbellulaNyl.形态解剖十分形似,二者的细微特征差异在于栎生茶渍的子囊盘较小(可达0.5 mm),子囊盘边缘和皮层结构较薄,子囊和子囊孢子相当小,子囊孢子大小为(4~6.5) μm×(3.5~4) μm之间,而且通常子囊孢子含有2~3个油滴,然而后者物种具有通常具有疣状地衣体和明显凸起且具轻微粉霜的子囊盘,此外L.albellula主要的次生代谢产物是异松萝酸(isousnic acid)[10]。
2.1.3 针叶茶渍
针叶茶渍LecanoraconiferarumPrintzen, Bryologist 104(3): 393 (2001),见图3。地衣体明显,壳状,发育良好,颗粒至疣状,表面呈灰色,黄灰色或灰白色或黄绿色,无粉霜,厚度可达0.1~0.2 mm;未发现下地衣体;子囊盘茶渍型,众多,单生至聚生,无柄,圆形至不规则,直径0.4~1.2 (1~5) mm;盘面呈黄棕色,棕色至红棕色,具轻微灰白色至白色粉霜或裸露,幼小时呈杯状,成熟时变扁平;边缘明显,全缘,有时呈波状,黄白色或与地衣体同色或稍微苍白,几乎无粉霜;果壳存在,皮层和藻胞层界限明显,藻细胞密集分布于藻胞层,连续;皮层分层明显,较薄,基部具有疏丝状排列的菌丝,具有黄色颗粒(偏振光下可见)且溶于K溶液和不溶于N溶液,向宽度为15~25 μm,纵向高度为35~60 μm;子实上层呈褐色至橄榄色或深棕色,颗粒物种可见或不明显,完全溶于K溶液且不溶于N溶液;子实层透明,厚度可达40~100 μm;子实下层透明,较薄但界限明显,厚度可达20~45 μm;囊层基无色,具有明显可见的菌丝,厚度可达20~75 μm;侧丝基部严重分支,不含色素,顶端无膨大;子囊8孢,棍棒状,具茶渍型顶器;孢子单胞,透明,椭圆形,无晕圈,大小在(7~12) μm×(4.5~7.5) μm之间;未发现分生孢子器。

A-B. 地衣体和子囊盘的外部形态结构;C. 子囊盘纵切解剖结构;D. 子囊盘纵切解剖偏振光下;E.子囊盘纵切解剖KOH溶液处理;F. 子囊;G. 子囊孢子。
显色反应:地衣体与子囊盘盘边缘K+黄色,C-,KC-,PD-;盘面K-或+黄色,C-,KC-,PD-。
次生代谢产物:松罗酸(usnic acid)。
生长基物:朽木上。
标本印证:新疆巴音郭楞自治州河静县贡乃斯林场,2013-07-30,2 660 m,43°11′58″N,84°20′14″E,热衣木·马木提,20138154,T2022925,20138159。
世界分布:北美洲[9]。
讨论:该物种以它的外部形态特征很容易跟异茶渍组的物种和其他柳茶渍组的其他物种混淆。本种主要特征是具有发育良好的颗粒至疣状的地衣体,皮层和藻胞层界限非常明显,且皮层局部含有溶于K溶液不溶于N溶液的黄色颗粒。针叶茶渍十分相似与LecanoraconizaeoidesCrombie,但主要区别在于后者子囊盘无粉霜,裸露且具有加厚的盘缘,在地衣体上局部或整个表面上具有黄色或绿色的粉芽,且变成粉末状。此外,子实上层的颗粒物种缓慢溶解于N溶液。针叶茶渍在化学物质上也不同于L.conizaeoides,L.conizaeoide含有富马酸,并与P+反应成红色至橙色[21]。
2.2 系统发育分析
为了确定和分析该研究中的3个物种在茶渍属中的进化位置选择了2个基因位点(ITS和mtSSU)构建柳茶渍组和类似物种的系统发育树。使用从GenBank数据库下载的27个ITS,21个SSU序列和自测的2个ITS序列,3个SSU序列进行分子系统发育树分析。基于前人的系统发育研究[3],原类梅属[石墙原类梅P.muralis(Schreb.) M. Choisy]物种被选为外群。从贝叶斯推理(BI)进化树可见异茶渍组(Lecanoravariagroup)以良好的支持率与柳茶渍组形成了姊妹分支。
从系统发育树结果可知,亚异茶渍标本序列与Genbank中的亚异茶渍标本序列聚为一支,其支持率为PP=1。栎生茶渍与亚异茶渍的标本序列形成小分支,说明这2个物种亲缘关系比较接近,支持率为PP=0.75。图4显示,针叶茶渍地衣序列与LecanoramughicolaNyl.的序列聚在1个小分支,由于针叶茶渍地衣的ITS序列缺失,本文中采用了该物种的SSU序列,支持率为PP=0.56,表型特征与柳茶渍组地衣的特征的完全符合性,进一步确认了本种在柳茶渍组的系统发育位置。所得支持率展示在于树枝对应的分支内,本研究鉴定的物种名序列以加黑形式呈现。
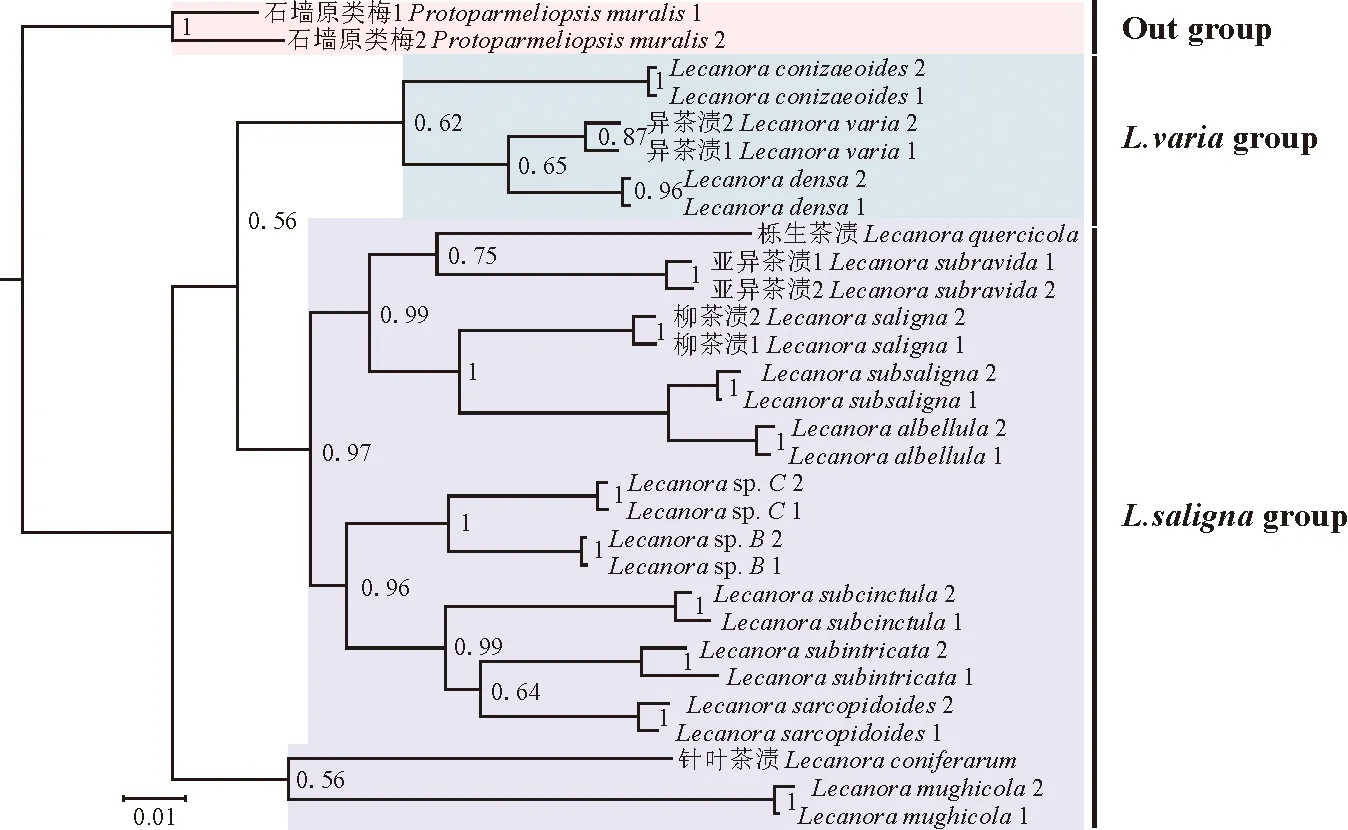
图4 基于贝叶斯推理(BI)并从粗体中的分支推断出的柳茶渍组及其相关物种的系统发育树,收到最大似然引导图和贝叶斯后验概率(PP值在分支上方)
