miRNA在黑色素瘤发病中的调控作用及相关药物的研究进展
2023-11-13陈红霞陈赛王旭张俐施健
陈红霞, 陈赛, 王旭, 张俐, 施健
南通市第一人民医院,江苏 南通 226006
黑色素瘤作为最具侵袭性的恶性肿瘤之一,在所有皮肤癌类型中的死亡率最高[1]。黑色素瘤患者早期诊断并通过手术切除治疗有较好的预后,患者5年生存率可达95%,而晚期黑色素瘤由于具有高转移特性,往往远期生存率很低,仅有5%[2]。目前,黑色素瘤的发病率和死亡率呈上升趋势。手术切除是早期黑色素瘤患者最常见及最有效的方式,其次是术后辅助治疗,如放疗和化疗[3]。然而转移性进展和治疗上的耐药性仍然是黑色素瘤治疗的两大难点。因此,进一步阐明黑色素瘤发病机制,探索出更多新的治疗药物和治疗方法具有重要意义。
miRNA是一组由19~24个核苷酸组成的非编码RNA,具有高度保守的特性。miRNA被证实通过调控靶基因相关通路或与靶基因直接相互作用参与肿瘤的细胞增殖、分化、凋亡等重要的生物学行为过程[4]。miRNA的表达在所有癌症类型中都受到异常调节,学术界和生物技术公司一直在积极追求miRNA作为癌症生物标志物的潜力,用于早期检测、评价预后和治疗效果[5]。miRNA在癌症中的参与也激发了人们对探索miRNA作为抗癌药物和药物靶点治疗价值的兴趣[5]。本文就miRNA 作为生物标记物、miRNA参与调控黑色素瘤相关信号通路、与miRNA相关的药物或有潜在治疗靶点的miRNA如何靶向治疗黑色素瘤进行综述,为后期靶向药物的研发提供理论基础。
1 miRNA可作为生物标记物
miRNA通过碱基互补配对的方式靶向识别并调控mRNA的转录、翻译、剪切及降解,通过对靶基因的调控,调节相关蛋白质的表达,参与正常黑色素细胞-良性痣-黑色素瘤的完整发展过程,其通过促进或抑制黑色素瘤细胞增殖、分化和凋亡,影响黑色素瘤的形成[6-7]。miRNA的具体表达情况及在黑色素瘤发展过程中的作用不尽相同,如黑色素瘤发展过程中起促进作用的miRNA有miR-221、miR-222 等,而起抑癌作用的有miR-320a、miR-128、miR-205等[7]。因此,miRNA 可作为生物标记物了解黑色素瘤患者的状态。
1.1 miRNA 参与黑色素瘤早期诊断
目前,对于部分已发生转移的黑色素瘤晚期患者,现有治疗手段的效果微乎其微。因此尽早诊断黑色素瘤并确定有转移倾向的高风险患者是降低死亡率的关键。Stark等[8]的一项关于葡萄膜黑色素瘤的研究显示,由6种miRNA(miR-146a、miR-145、miR-16、miR-363-3p、miR-211 和 miR-204)组成的 miRNA小组可准确区分葡萄膜良性痣和葡萄膜黑色素瘤,其中以 miR-211差异表达为著,该miRNA小组可作为协助诊断的工具,协助临床决策。Kozubek等[9]对比了正常皮肤、良性痣和黑色素瘤细胞中的 miRNA表达变化,发现7种 miRNA (miR-205-5p、miR-204-5p、miR-211-5p、miR-203、miR-23b-3p、miR-26b-5和miR-26a-5p)表达水平在黑色素瘤细胞中明显下调。此外,该研究也揭示了miR-211在区分痣和黑色素瘤上具有高度敏感性和特异性,因而该miRNA具有诊断效用。一系列研究结果证实,miR-211可特异性协助诊断黑色素瘤早期病变。
1.2 miRNA参与黑色素瘤转移及预后监测
近年来,CT、PET等影像学技术,病理活检以及基于临床特征的多变量分析是评价肿瘤患者术后转移和预后状态的主要手段。然而,影像学检查对微小病灶(<10 mm)、早期病例敏感性不高和假阳性结果等存在限制[7,10-11],而病理活检结果虽对预后有可观的预测效果,却无法在治疗后或术后随时监测,时效性和客观性欠佳[12]。因此,发现更多的miRNA 作为分子生物标记物,以鉴定具有高转移风险的患者非常有必要。Lu等[13]使用Kaplan-Meier生存分析以及多变量COX回归等统计方法发现5种miRNA(miR-510、miR-211、miR-513、miR-001c、miR-0)可作为皮肤黑色素瘤潜在的预后标志物。李英等[14]发现在黑色素瘤组织中miR-320a呈低表达,且那些miR-320a高表达的患者有较好的预后及较低的TNM分期,ROC曲线表明miR-320a在判断预后时具有一定的诊断效能。miR-146a和miR-186表达水平与临床分期和预后密切相关[15]。赵宏圻等[15]研究发现,miR-186在黑色素瘤肿瘤组织Ⅳ、Ⅲ、Ⅱ期中的相对表达量分别是3.17±1.05、2.41±0.81、1.58±0.42(P<0.01);miR-146a在黑色素瘤肿瘤组织Ⅳ、Ⅲ、Ⅱ期中的相对表达量分别是0.35±0.07、0.46±0.13、0.67±0.18(P<0.01)。miR-186在黑色素瘤生存组和死亡组中相对表达量分别是1.94±0.52和3.98±1.03(P<0.05);miR-146a在黑色素瘤生存组和死亡组中相对表达量分别是0.57±0.21和0.13±0.04(P<0.05)。简而言之,Ⅳ期黑色素瘤患者miR-186相对表达量高于Ⅱ期和Ⅲ期患者,miR-146a则相反。死亡组患者肿瘤组织中miR-186的相对表达量高于生存组,而miR-146a相对表达量低于生存组。因此,miR-146a和miR-186对预后具有一定的预测价值。
2 miRNA参与调控RAS-RAF-MEK-ERK通路及相关药物的研究进展
2.1 miRNA参与调控RAS-RAF-MEK-ERK通路
丝裂原活化蛋白激酶(MAPK)是一种丝氨酸—苏氨酸蛋白激酶。MAPK通路的基本组成是一种三级激酶模式,激酶的级联放大过程是该信号通路的主要特征,激酶的依次激活,共同刺激细胞的生长、增殖、分化、侵袭,抑制凋亡,促进肿瘤的转移等重要的生理病理过程[16]。MAPK信号通路有4条分支路线: ERK、p38、JNK和ERK5,其中ERK通路最常见。ERK主要调控细胞生长、分化,它的上游信号是著名的Ras/Raf蛋白。MAPK通路的异常激活在多种肿瘤中存在,也是发展为黑色素瘤的一个关键通路。
研究显示,miR-596在黑色素瘤中呈低表达,而miR-596过表达可以抑制MAPK/ERK信号通路的激活,从而抑制黑色素瘤细胞增殖、迁移和侵袭,并通过靶向调节BCL2L1和MCL1 mRNA促进细胞凋亡[17]。已有研究表明,肿瘤干细胞衍生的细胞外囊泡可以改变肿瘤细胞的致癌特性[18]。高转移性黑色素瘤干细胞分泌含有miRNA-592的外泌体到低转移性黑色素瘤,增强了后者的转移定植能力,而miRNA-592的促转移能力是通过靶向抑制PTPNT,导致MAPK/ERK通路被激活[19]。此外,miRNA-411-5p在高转移性黑色素瘤细胞系中显著富集,miRNA-411-5p可以外泌体的形式转移到低转移性黑色素瘤细胞系,促进低转移性黑色素瘤细胞系的转移定植能力,而该miRNA的促转移活性是通过激活MAPK/ERK信号通路来实现的[20]。 这些研究都显示了miRNA能通过影响MAPK/ERK信号通路进而影响黑色素瘤的进展。
2.2 参与调控RAS-RAF-MEK-ERK通路的药物
MAPK/ERK信号通路的任一环节,细胞因子、受体、Grb2-sos的复合物、Ras、Raf、MEK1/2和ERK都可能发生突变或失调,相应调控都可能成为疾病治疗的靶点[21]。目前,已研发多种靶向药物(如BRAF抑制剂、MEK抑制剂、KIT抑制剂等)成功用于抑制MAPK通路的过度激活[22]。市面上的BRAF抑制剂主要有维莫菲尼和达拉非尼,MEK抑制剂主要包括曲美替尼和考比替尼。任一单药都可提高恶性黑色素瘤患者生存率,然而单药的临床不良反应及耐药性却无法避免。近年来不同靶向药物的联合应用应运而生。有研究发现,维莫菲尼单药治疗较曲美替尼和达拉非尼的联合使用缓解率低,药物联合使用会提高BRAF突变型黑色素瘤患者的总生存率,而且两者的联合应用不增加总体毒性[23]。
Fattore等[24]的一项研究显示,miR-579-3p过表达会抑制BRAF基因,抑制黑色素瘤细胞的增殖、迁移和细胞周期,诱导细胞凋亡,增强BRAF抑制剂与MEK抑制剂联合应用的效能。miR-579-3p能够同时影响BRAF突变黑色素瘤增殖所需的两种途径,即BRAF/MAPK和MDM2/p53途径。认为它在诱导细胞生长停滞和凋亡方面的效力必须归因于它对这两种互补途径的干扰[24]。
3 miRNA参与调控PI3K/AKT通路及相关药物的研究进展
3.1 miRNA参与调控PI3K/AKT通路的研究进展
PI3K/AKT信号通路在许多细胞生物学行为中发挥至关重要的作用,如细胞存活、侵袭、迁移以及调控细胞周期。大量研究结果显示PI3K/AKT信号通路在黑色素瘤中存在异常激活现象。据报道,大约由70%的转移性黑色素瘤表现出AKT/mTOR活性增强[25]。
研究表明,miR-139-5p在黑色素瘤中呈低表达水平,miR-139-5p过表达可通过下调IGF1R抑制PI3K/AKT通路的活化程度,进而抑制黑色素瘤细胞的增值、迁移和侵袭,并促进细胞的凋亡[26]。因此,miR-139-5p可作为黑色素瘤诊断和治疗的生物标志物。Zheng等[27]证明miR-31可通过抑制SOX10激活PI3K/AKT信号通路,进而调节肿瘤生长和耐药的生物学行为。Cheng等[28]的研究也表明miR-222通过激活PI3K/AKT/MMP-9通路促进葡萄膜黑色素瘤(UM)细胞的增值和迁移。这些研究展示了miRNA可以通过调控PI3K/AKT信号通路促使黑色素瘤的发生。
3.2 参与调控PI3K/AKT通路的药物
靶向那些“尚未被药物化”的靶标在未来是治疗癌症的替代选择,例如NRAS基因。Pang等[29]研究发现,miR-708能直接靶向抑制NRAS蛋白的表达,进而抑制包含黑色素瘤在内的多种癌症细胞的增殖,促进细胞凋亡。该miRNA的过表达会使NRAS下游PI3K-Akt-mTOR和RAF-MEK-ERK的信号传导降低,该研究充分证明miR-708在未来有精准治疗癌症的潜力。Caporali等[30]的研究表明,在黑色素瘤耐达拉非尼细胞系中,miR-126-3p显著下调,miR-126-3p过表达后会抑制细胞增殖、侵袭,延缓细胞周期进程,促使AKT和ERK的磷酸化,并增加达拉非尼敏感性。BRAF抑制剂与miR-126-3p模拟物的组合可能代表一种新的治疗方法,尽管miRNA替代疗法仍存在一些挑战,但在已结束的两项Ⅰ期临床试验(晚期实体瘤[31]和胸膜间皮瘤[32])中显示miRNA具有抗肿瘤活性及延缓耐药性出现的证据,获得的结果显示了miRNA替代疗法的潜能。
4 miRNA参与调控小眼畸形相关转录因子(MITF)通路及相关药物的研究进展
4.1 miRNA参与调控MITF通路
约15%~20%的黑色素瘤患者中可见MITF基因的扩增[33]。该基因的扩增常发生在疾病的后期,且伴随5年生存率降低。MITF参与调控细胞周期、存活、增殖、代谢、DNA修复及衰老基因表达[34]。据报道,MITF和MAPK信号通路密切相关,MITF受到BRAFV600E突变的调控[35]。MITF的过表达或缺失都会使BRAF抑制剂产生耐药。
研究发现,MITF可通过调节RNA聚合酶Ⅱ(Pol-Ⅱ)的位置,引起let-7c/99a/125b-2簇编码蛋白的miRNA差异性表达,而这种差异表达将会影响黑色素瘤细胞的表型[36]。这些研究都反映了MITF基因的扩增与miRNA有关联,而存在MITF基因扩增的黑色素瘤患者往往预后不佳。
4.2 参与调控MITF的药物
羟基脲(Hydroxyurea,HU)作为一种抗癌药物,可抑制DNA的合成[37],对于治疗黑色素瘤有作用[38]。据报道,在经过HU处理后的B16黑色素瘤细胞中发现miR-7013-3p表达上调,而miR-7013-3p通过靶向MITF基因来抑制黑色素瘤细胞的增殖和迁移,可促进细胞的凋亡[39]。c-Met基因在超过60%的UM过表达,miR-182可靶向调节c-Met基因表达的MITF基因,降低肿瘤侵袭和转移风险[40]。此外,miR-182还参与UM的P53通路网[41]。可见miR-182下调MITF表达及参与P53通路网,具有改善UM患者治疗效果的潜力。
5 miRNA参与调控p53通路及相关药物的研究进展
5.1 miRNA参与调控p53通路
p53是一种转录因子,参与调节细胞修复、凋亡、细胞周期和分化等生物学过程,被称为基因守护者[42]。p53还可作为紫外线的分子感受器起作用,高水平的紫外线照射会导致持续性的p53激活,从而触发细胞凋亡。
Da等[43]研究表明,miR-138-5p过表达直接抑制Trp53的表达从而促进黑色素瘤的转移。p53的失活在黑色素瘤中经常发生。此外,p53的功能与MDMX和MDM2的作用有关[42]。如Wu等[44]研究发现,miR-17-3p过表达会使DMD2表达下调和p53转录活性增加,同时还可抑制UM细胞的增殖、迁移、侵袭和促进细胞的凋亡。
5.2 参与调控p53通路的药物
在黑色素瘤中,p53肿瘤蛋白频繁失活预示着p53激活剂在治疗黑色素瘤存在巨大的潜力。研究证实,p53激活剂SLMP53-2可诱导细胞周期停滞和细胞凋亡,抑制细胞迁移和侵袭,从而抑制肿瘤的生长[45]。大量研究表明,人类肿瘤(包括黑色素瘤)中MdmX蛋白水平会增加。依诺沙星作为一种促进miRNA成熟的小分子药物,可上调 26个成熟的miRNA,下调29个miRNA,与环丙沙星发挥同样作用下调MdmX蛋白水平,并激活p53通路,抑制黑色素瘤在体内和体外的生长[46]。
参与调控黑色素瘤的miRNA种类及其主要作用机制见表1,药物和具有治疗潜力的miRNA靶向相关信号通路见表2。
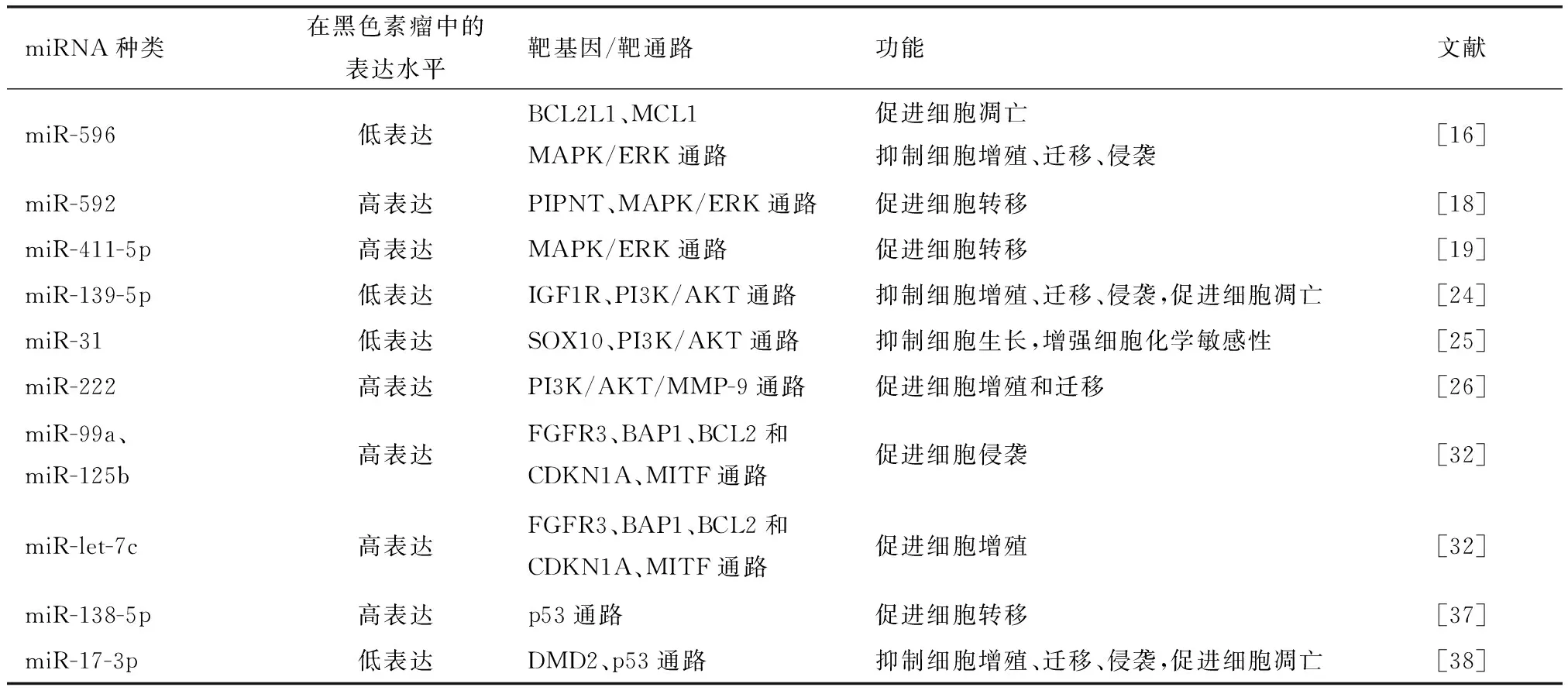
表1 miRNA调控黑色素瘤的机制Table 1 Mechanisms by which miRNAs regulate melanoma
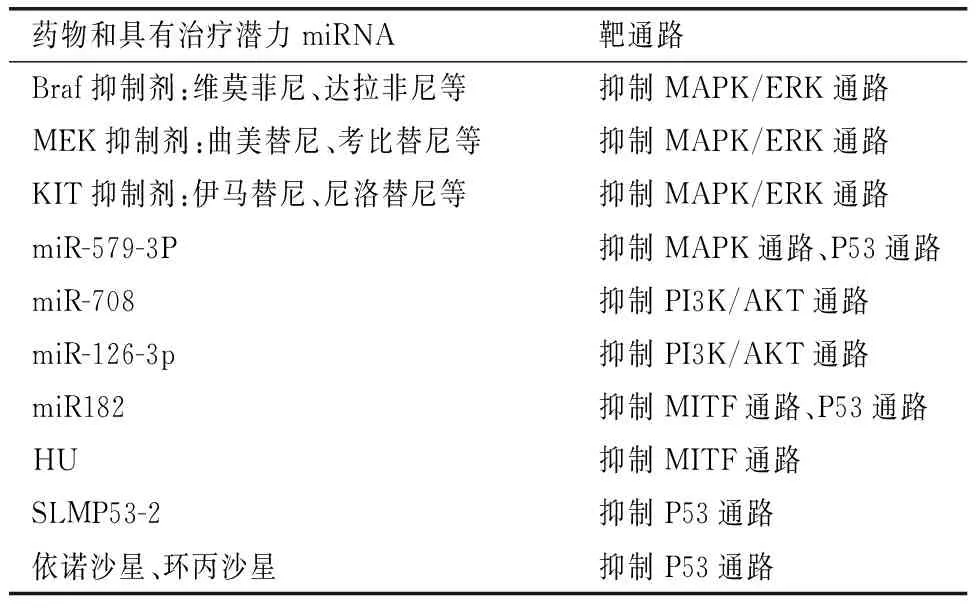
表2 药物和具有治疗潜力的miRNA靶向相关信号通路Table 2 Drugs and miRNAs with the therapeutic potential target-associated signaling pathways
6 结语与展望
作为世界上增长最快的恶性肿瘤之一,黑色素瘤的预防和治疗成为当前关注的重点。本文阐明miRNA主要通过MAPK通路、PI3K/AKT通路、MITF通路及P53信号通路调控黑色素瘤的发生发展。靶向药物可通过调控上述4条通路达到治疗效果。miRNA具有癌症生物标志物的潜力,可用于早期检测,评价预后和治疗效果。虽然有关miRNA的研究已有数十年,但miRNA家族由于数量繁多且生物学性质各异,能明确作用机制及特异性诊断的miRNA仍然相对较少。在未来的研究中,需要应用DNA测序和基因表达谱识别出更多与肿瘤进展或预后相关的miRNA,开展更深入的基础实验、临床实验及动物模型实验了解miRNA介导黑色素瘤发生和发展的分子机制,并通过标准化、大尺寸、多中心的生物标志物研究设计,鉴定出用于特异性诊断和评价预后的miRNA,研发出更好的治疗方案。随着不断深入理解黑色素瘤起始和进展,miRNA有望作为肿瘤生物标志物被使用,通过应用潜在治疗靶点的miRNA联合其他治疗方案共同诊治黑色素瘤。
