LINC01410 调控miR-124/stat3 轴参与急性髓性白血病免疫逃逸的机制研究
2023-11-13易慧智信阳职业技术学院信阳464000
袁 戎 易慧智 (信阳职业技术学院,信阳 464000)
急性髓性白血病(acute myeloid leukemia,AML)作为一种具有高度异质性的血液系统恶性肿瘤疾病,是由于骨髓和外周血中未成熟的髓细胞大量积累和扩增导致的造血功能衰竭[1-2]。免疫治疗虽已被认作是最有前景的治疗措施,但肿瘤细胞可躲避机体免疫系统的监视及杀伤,发生免疫逃逸,因此,详细了解AML 的免疫逃逸机制对其治疗极具意义[3-4]。长链非编码RNA(long non-coding RNA,lnc-RNA)是造血系统功能和发育的关键调节因子,研究 发 现lncRNA 参 与AML 细 胞 的 免 疫 逃 逸[5-6]。LINC01410 作为一种lncRNA 在胃癌等肿瘤疾病中呈异常高表达状态,但其对AML 免疫逃逸的影响还未见报道[7]。微小RNA(miRNA)作为高度保守的小分子非编码RNA 参与肿瘤细胞的转移及免疫逃逸,miR-124 已被发现可通过抑制信号传导与转录激活因子3(signal trans ducerand activator of transcription 3,stat3)表达抑制胶质瘤细胞的免疫逃逸,且miR-124 参与AML 的发生,抑制其表达可促进AML 细胞的增殖[4,8]。已知stat3 在AML 患者骨髓标本表达异常增加,参与AML 发生[9]。LINC01410 是否可能通过调控miR-124/stat3 轴影响AML 免疫逃逸值得探究,因此,本研究通过对LINC01410 在AML 免疫逃逸中的作用机制进行探究,以期为AML 免疫逃逸存在潜在作用靶点的寻找提供一定参考。
1 材料与方法
1.1 材料 LipofectamineTM2000 Transfection Reagent(上海研卉生物);干扰素-γ(interferon-γ,IFN-γ)ELISA 试剂盒、双荧光素酶检测试剂盒(北京索莱宝);IL-2(苏州赛业生物);兔抗p-stat3、β-actin、stat3抗体、Anti-rabbit IgG、HRP-linked Antibody(Cell Signaling Technology)。Insta Q48TM荧光定量PCR 检测系统购自上海威正翔禹生物;DAIHAN 凝胶成像系统购自上海连桥生物。
1.2 方法
1.2.1 骨髓及外周血样本获取 采集信阳职业技术学院附属医院2019 年3 月至2021 年5 月收治的21 例AML 患者骨髓样本,患者平均年龄(31.65±8.43)岁,另取同时期25 例非恶性血液病患者骨髓样本及外周血样本,患者平均年龄(30.34±7.98)岁,经过伦理委员会批准,受试者均知情同意。
1.2.2 白细胞收集 将所得骨髓样本与6 ml 红细胞裂解液混匀后冰上静置15 min,2 000 r/min 离心10 min,弃上清后加入4 ml红细胞裂解液重悬,再次离心弃上清取下层白细胞。
1.2.3 自然杀伤细胞(natural killer cell,NK)收集及培养 将经肝素抗凝的非恶性血液病患者外周血(2 ml)与PBS 等比例混匀后加入淋巴细胞分离液,1 500 r/min 离心15 min 后混合液分为4 层,吸取位于第2 层的乳白色淋巴细胞层,再次离心后弃上清取单个核细胞。按2.5×108个/ml 加入磁珠缓冲液MACS(miltenyi)重 悬,NK 细 胞 生 物 素 化 抗 体(7.5 µl)孵育10 min,再次添加macs缓冲液(22.5 µl)及抗生物素化抗体磁珠(15 µl)孵育20 min,经质谱分离、洗柱收集细胞,添加CD56、CD3抗体进行标记后筛选NK 细胞,将NK 细胞接种于RPMI1640 培养基培养,作为对照组,NK 细胞经20 ng/ml IL-2 刺激24 h后常规培养的细胞作为IL-2组。
1.2.4 分组、转染及共培养 将NK 细胞分为对照组、IL-2 组、sh-NC 组、sh-LINC01410 组、sh-LINC-01410+inhibitor NC 组、sh-LINC01410+miR-124 inhibitor 组、miR-NC 组、miR-124 mimics 组、miR-124 mimics+pcDNA3.1-stat3 组、miR-124 mimics+pcDNA 3.1 组,将所得的白细胞(1×105个/ml)接种到96 孔板中,使用LipofectamineTM2000 试剂盒对IL-2 组NK细胞进行相应转染后与白细胞以10∶1 的比例混匀共培养。
1.2.5 qRT-PCR 检 测LINC01410 及miR-124 的 表达 使用TRIzol 法提取AML 患者、非恶性血液病患者骨髓以及对照组、IL-2组、sh-NC组、sh-LINC01410组、sh-LINC01410+inhibitor NC 组、sh-LINC01410+miR-124 inhibitor 组NK 细 胞 中 总RNA,逆 转 录 成cDNA 后 分 别 以U6、GAPDH 作 为miR-124 及LINC01410 的内参进行qRT-PCR 扩增,采用2-ΔΔCt分析miR-124及LINC01410表达(n=5),引物见表1。

表1 qRT-PCR引物Tab.1 qRT-PCR primers
1.2.6 Western blot 检测stat3 蛋白表达 收集转染后的各组NK 细胞并经蛋白裂解液裂解提取总蛋白,经BCA 法定量、电泳分离、转膜、封闭后,孵育兔抗p-stat3、β-actin、stat3(1∶1 000)抗体过夜,孵育2 h羊抗兔IgG(1∶3 000),避光孵育ECL发光液(5 min),使用成像仪进行显影,计算p-stat3/stat3 蛋白表达(n=5)。
1.2.7 ELISA 法检测上清液中IFN-γ 含量 收集各组细胞共培养后的培养上清液后使用IFN-γ 试剂盒处理,于酶标仪 光密度D450nm处检 测IFN-γ 含 量(n=5)。
1.2.8 细胞毒性检测 收集各组NK 细胞(5×105个/ml)作为效应细胞,以白细胞为靶细胞:实验分为效应细胞自然释放组(100 µl NK 细胞悬液+100 µl 细胞培养液)、靶细胞自然释放组(100 µl 白细胞悬液+100 µl 细胞培养液)、自然杀伤组(100 µl NK细胞悬液+100 µl白细胞悬液)、靶细胞最大释放组(100 µl白细胞悬液+100 µl 2.5%的Triton X-100),培养4 h 后使用LDH 试剂盒检测光密度D,计算细胞毒性(%)=(D自然杀伤组-D靶细胞自然释放组-D效应细胞自然释放组)/(D靶细胞最大释放组-D靶细胞自然释放组)×100%(n=5)。
1.2.9 双荧光素酶报告基因检测LINC01410、miR-124、stat3 的靶向关系 starBase 网站预测miR-124分别与LINC01410、stat3 的结合位点;将含有miR-124 结合位点的LINC01410 及stat3 3'UTR 片段插入pMir-Report 载体上,构建LINC01410-wt、stat3-wt 野生型载体,通过替换miR-124 结合片段产生突变构建体,命名为LINC01410-mut、stat3-mut;将白细胞分为LINC01410-wt+miR-124 mimics 组、LINC01410-wt+miR-NC 组、LINC01410-mut+miR-124 mimics 组、LINC01410-mut+miR-NC 组、stat3-wt+miR-124 mimics组、stat3-wt+ miR-NC 组、stat3-mut+miR-124 mimics组、stat3-mut+miR-NC 组,将miR-NC、miR-124 mimics 分别与所构建的质粒共转染至白细胞中,24 h 后通过双荧光素酶报告系统(Promega)计算海肾和萤火虫荧光值,计算白细胞的相对荧光素酶活性。
1.3 统计学分析 数据通过SPSS22.0 软件分析,±s描述,多组数据比较行One-way ANOVA,SNK-q检验进行进一步两两比较,P<0.05表明差异有统计学意义。
2 结果
2.1 AML 以及非恶性血液病患者骨髓中LINC01410、miR-124表达水平比较 与非恶性血液病患者相比,AML 患者骨髓中LINC01410 表达显著增加,miR-124表达显著降低(P<0.05),见表2。
表2 AML 以及非恶性血液病患者骨髓中LINC01410、miR-124表达比较(±s)Tab.2 Comparison of LINC01410 and miR-124 expressions in bone marrow of AML patients and non malignant hematological patients (±s)

表2 AML 以及非恶性血液病患者骨髓中LINC01410、miR-124表达比较(±s)Tab.2 Comparison of LINC01410 and miR-124 expressions in bone marrow of AML patients and non malignant hematological patients (±s)
Note:Compared with non malignant hematological diseases group, 1)P<0.05.
Groups Non malignant hematological diseases AML n LINC01410 miR-124 0.99±0.04 0.42±0.061)37.122 0.000 25 21 t P--1.01±0.03 1.96±0.221)19.601 0.000
2.2 各组NK 细胞中LINC01410、miR-124 及stat3蛋白表达水平比较 与对照组相比,IL-2组NK细胞中LINC01410 及p-stat3/stat3 表 达 显 著 降 低(P<0.05),miR-124 表达显著增加(P<0.05);与IL-2 组、sh-NC组相比,sh-LINC01410组LINC01410及p-stat3/stat3 表达显著降低(P<0.05),miR-124 表达显著增加(P<0.05);与sh-LINC01410 组、sh-LINC01410+inhibitor NC 组相比,sh-LINC01410+miR-124 inhibitor组LINC01410 表达无显著变化(P>0.05),而miR-124 表达显著降低,p-stat3/stat3 表达显著增加(P<0.05),见表3、图1。
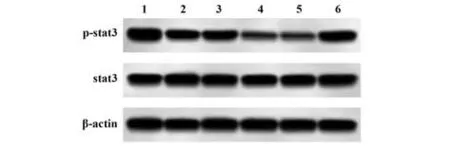
图1 各组NK细胞中stat3蛋白表达比较Fig.1 Comparison of stat3 protein expression in NK cells of each group
表3 各组NK细胞中LINC01410、miR-124及stat3蛋白表达比较(±s,n=5)Tab.3 Comparison of LINC01410, miR-124 and stat3 protein expressions in NK cells of each group(±s,n=5)

表3 各组NK细胞中LINC01410、miR-124及stat3蛋白表达比较(±s,n=5)Tab.3 Comparison of LINC01410, miR-124 and stat3 protein expressions in NK cells of each group(±s,n=5)
Note:Compared with control group, 1)P<0.05; compared with IL-2 group, 2)P<0.05; compared with sh-NC group, 3)P<0.05; compared with sh-LINC01410 group, 4)P<0.05; compared with sh-LINC01410+inhibitor NC group, 5)P<0.05.
Groups Control IL-2 sh-NC sh-LINC01410 sh-LINC01410+inhibitor NC sh-LINC01410+miR-124 inhibitor LINC01410 0.99±0.05 0.52±0.041)0.53±0.05 0.24±0.022)3)miR-124 1.01±0.03 1.63±0.201)1.64±0.24 2.33±0.262)3)p-stat3/stat3 1.63±0.21 0.92±0.101)0.93±0.12 0.35±0.042)3)0.25±0.03 2.35±0.28 0.34±0.06 0.23±0.04 1.29±0.164)5)0.98±0.084)5)
2.3 LINC01410 及miR-124 表达沉默对细胞培养上清液中IFN-γ 含量的影响 与对照组相比,IL-2组细胞培养上清液中IFN-γ 含量显著增加(P<0.05);与IL-2 组、sh-NC 组相比,sh-LINC01410 组IFN-γ含量显著增加(P<0.05);与sh-LINC01410组、sh-LINC01410+inhibitor NC 组相比,sh-LINC01410+miR-124 inhibitor 组IFN-γ 含量显著降低(P<0.05),见表4。
表4 各组IFN-γ含量比较(±s,n=5)Tab.4 Comparison of IFN-γ content in each group (±s,n=5)
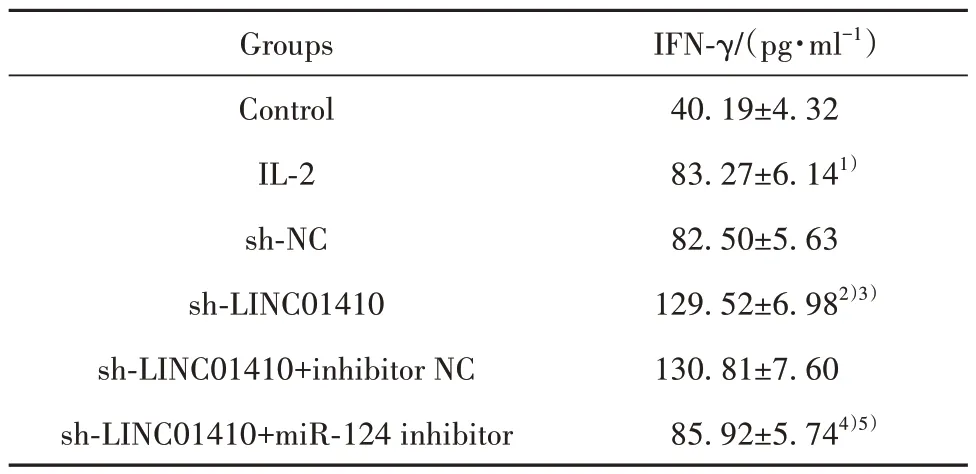
表4 各组IFN-γ含量比较(±s,n=5)Tab.4 Comparison of IFN-γ content in each group (±s,n=5)
Note:Compared with control group, 1)P<0.05; compared with IL-2 group, 2)P<0.05; compared with sh-NC group, 3)P<0.05;compared with sh-LINC01410 group, 4)P<0.05; compared with sh-LINC01410+inhibitor NC group, 5)P<0.05.
IFN-γ/(pg·ml-1)40.19±4.32 83.27±6.141)82.50±5.63 129.52±6.982)3)130.81±7.60 85.92±5.744)5)Groups Control IL-2 sh-NC sh-LINC01410 sh-LINC01410+inhibitor NC sh-LINC01410+miR-124 inhibitor
2.4 LINC01410 及miR-124 表 达 沉 默 对NK 细 胞毒性的影响 与对照组相比,IL-2组NK细胞毒性显著增强(P<0.05);与IL-2 组、sh-NC 组相比,sh-LINC01410 组NK 细胞毒性显著增强(P<0.05);与sh-LINC01410 组、sh-LINC01410+inhibitor NC 组 相比,sh-LINC01410+miR-124 inhibitor 组NK 细胞毒性显著降低(P<0.05),见表5。
表5 各组NK细胞毒性比较(±s,n=5)Tab.5 Comparison of NK cytotoxicity in each group(±s,n=5)

表5 各组NK细胞毒性比较(±s,n=5)Tab.5 Comparison of NK cytotoxicity in each group(±s,n=5)
Note:Compared with control group, 1)P<0.05; compared with IL-2 group, 2)P<0.05; compared with sh-NC group, 3)P<0.05;compared with sh-LINC01410 group, 4)P<0.05; compared with sh-LINC01410+inhibitor NC group, 5)P<0.05.
Cytotoxicity/%32.65±4.35 49.23±6.221)50.01±5.92 72.62±6.852)3)71.53±7.20 48.20±5.374)5)Groups Control IL-2 sh-NC sh-LINC01410 sh-LINC01410+inhibitor NC sh-LINC01410+miR-124 inhibitor
2.5 LINC01410、miR-124、stat3 的靶向关系验证starBase 预测显示:LINC01410 与miR-124 间及miR-124与stat3间存在结合位点(图2);荧光素酶报告基因实验显示:与LINC01410-wt+miR-NC 组相比,LINC01410-wt+miR-124 mimics 组荧光素酶活性显著降低(P<0.05),LINC01410-mut+miR-124 mimics组、LINC01410-mut+miR-NC 组荧光素酶活性无明显变化(P>0.05),见图3;与stat3-wt+miR-NC 组相比,stat3-wt+miR-124 mimics组荧光素酶活性显著降低(P<0.05),stat3-mut+miR-124 mimics组、stat3-mut+miR-NC 组荧光素酶活性无显著性变化(P>0.05),见图4。

图3 荧光素酶活性检测Fig.3 Detection of luciferase activity

图4 荧光素酶活性检测Fig.4 Luciferase activity assay
2.6 miR-124 及stat3 过表达对细胞培养上清液中IFN-γ 含量及NK 细胞毒性作用的影响 与IL-2 组、miR-NC 组相比,miR-124 mimics 组IFN-γ 含量及NK细胞毒性显著增强(P<0.05);与miR-124 mimics组、miR-124 mimics+pcDNA3.1 组 相 比,miR-124 mimics+pcDNA3.1-stat3 组IFN-γ 含量及NK 细胞毒性显著降低(P<0.05),见表6。
表6 各组IFN-γ含量及NK细胞毒性比较(±s,n=5)Tab.6 Comparison of IFN-γ content and NK cytotoxicity in each group (±s,n=5)
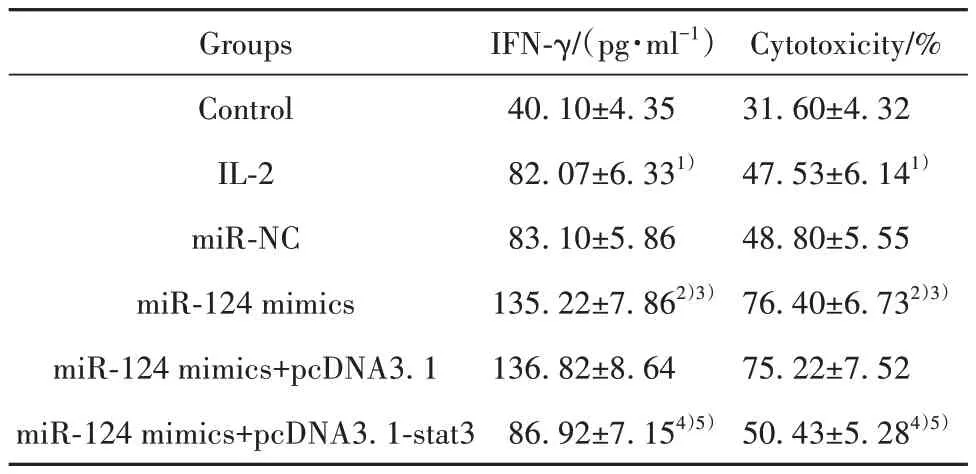
表6 各组IFN-γ含量及NK细胞毒性比较(±s,n=5)Tab.6 Comparison of IFN-γ content and NK cytotoxicity in each group (±s,n=5)
Note:Compared with control group, 1)P<0.05; compared with IL-2 group, 2)P<0.05; compared with miR-NC group, 3)P<0.05;compared with miR-124 mimics group, 4) P<0.05; compared with miR-124 mimics+pcDNA3.1 NC group, 5) P<0.05.
Cytotoxicity/%31.60±4.32 47.53±6.141)48.80±5.55 76.40±6.732)3)75.22±7.52 50.43±5.284)5)Groups Control IL-2 miR-NC miR-124 mimics miR-124 mimics+pcDNA3.1 miR-124 mimics+pcDNA3.1-stat3 IFN-γ/(pg·ml-1)40.10±4.35 82.07±6.331)83.10±5.86 135.22±7.862)3)136.82±8.64 86.92±7.154)5)
3 讨论
AML 可通过基因融合、突变和表观遗传修饰来躲避NK 细胞的免疫监视,造成免疫逃避的发生,而至今免疫逃逸的发生机制尚不清楚[10-11]。因此有必要对其深入探讨。
肿瘤细胞的免疫逃逸机制涉及NK 细胞等免疫细胞的细胞毒作用改变,NK 细胞作为机体抗肿瘤第一道防线,其功能异常会造成机体免疫耐受及功能障碍的发生,从而导致免疫逃逸[4,11]。lncRNA 可在细胞中充当信号分子,调节某些基因的表达,如充当miRNA 海绵,调控miRNA 表达[12]。但目前关于LINC01410 在AML 免疫逃逸机制中的相关研究还未见报道,本研究结果显示,AML 患者骨髓中LINC01410 表达显著增加,LINC01410 参与AML 的发生;在IL-2 刺激的NK 细胞中LINC01410 显著降低,IFN-γ 含量、NK 细胞毒性显著增加,并且沉默LINC01410 表达后与AML 患者白细胞共培养促进NK 细胞的细胞毒作用及IFN-γ 分泌,表明LINC01410表达沉默能够有效增加NK细胞毒性,增强对AML 的杀伤作用,并通过释放IFN-γ 等促进其杀伤效应,从而抑制免疫逃逸。
本研究发现,miR-124 是LINC01410 的靶基因。有研究报道,肿瘤抑制因子miR-124 在AML 患者骨髓中表达降低,其参与AML 的发生[13]。lncRNA SNHG16 沉默通过促进miR-124-3p 表达在急性淋巴细胞白血病中起到肿瘤抑制作用[14]。近期有研究称,miR-124 与IL-2、IFN-γ 等细胞因子表达与细胞免疫应答有关[4]。本研究发现,AML患者骨髓中miR-124表达显著降低,IL-2 刺激的NK 细胞miR-124 表达显著增加,与前述研究一致[13],且沉默LINC01410后与AML 患者白细胞共培养促进NK 细胞miR-124 表达,而miR-124 表达沉默可逆转LINC01410 沉默对NK 细胞的毒性作用,结果表明,LINC01410 表达沉默对AML 免疫逃逸的抑制作用可能与其促进miR-124 表达有关。为进一步对miR-124 在AML 免疫逃逸中的作用机制进行验证,本研究对miR-124 过表达,结果发现,miR-124 过表达能够有效促进IFN-γ释放及NK细胞毒性增加。
miRNA 可通过与目标mRNA 3'-UTR 结合在转录水平上负向调控其目标基因表达,有研究表明,其主要通过拷贝数改变、表观遗传变化等机制参与AML 发病[12]。本研究发现,stat3 是miR-124 的靶基因。miR-124过表达可通过抑制stat3表达增加NK 细胞对胶质瘤细胞的细胞毒作用,抑制免疫逃逸[4]。stat3作为转录因子参与多种类型的肿瘤细胞免疫逃逸的发生[15-17]。本研究发现,IL-2 刺激的NK细胞中p-stat3/stat3 表达显著降低,并且沉默LINC01410 后与AML 患者白细胞共培养抑制NK 细胞p-stat3/stat3 表达,miR-124 表达沉默可逆转LINC01410 沉默对p-stat3/stat3 表达的抑制作用,上述结果表明,LINC01410 表达沉默可能通过促进miR-124表达抑制stat3表达。本研究还发现stat3过表达可逆转miR-124过表达对AML的杀伤作用。
综上所述,LINC01410 沉默通过激活miR-124/stat3 轴抑制AML 免疫逃逸。本研究为AML 免疫逃逸机制的研究以及AML 治疗靶点的寻找提供了线索。
