circRNA-1565抑制CD8+T细胞对宫颈癌细胞的杀伤功能研究①
2023-11-13王青慧王晓黎胡传翠聂明朝庞晓庆张亚芳
王青慧 李 波 王晓黎 胡传翠 聂明朝 庞晓庆 张亚芳
(海南省妇女儿童医学中心妇产科,海口 570206)
宫颈癌是女性常见的恶性肿瘤,统计学研究显示2020 年全球宫颈癌新增发病人数超过60 万,虽然宫颈癌筛查和早期诊断技术已取得极大进步,但病死率仍居高不下,需要探究其发生发展机制,寻找更多用于宫颈癌治疗的方法[1-2]。肿瘤免疫治疗是一种新型肿瘤治疗手段,CD8+T 细胞在肿瘤微环境中主要发挥杀伤肿瘤细胞作用,且CD8+T 细胞浸润与宫颈癌的生长、转移、化疗密切相关[3-4]。肿瘤细胞通过多种途径抑制T 细胞功能,促进肿瘤免疫逃逸[5]。探究调控CD8+T 细胞功能的分子机制对宫颈癌治疗至关重要。课题组前期研究发现宫颈癌组织大量表达circRNA-1565。而肿瘤细胞可通过旁分泌途径向肿瘤微环境释放外泌体,传递circ-RNA 等抑制免疫细胞对肿瘤的杀伤作用[6-7]。本研究拟探讨circRNA-1565能否通过抑制CD8+T细胞功能影响其对肿瘤的杀伤作用。
1 资料与方法
1.1 资料
1.1.1 研究对象 患者来自海南省妇女儿童医学中心,所有患者均为原发性宫颈癌患者,且经病理验证为首次确诊者,入选患者均未经放化疗、免疫或激素干预,患者或家属知情同意,且经海南省妇女儿童医学中心伦理委员会批准,批号:HNWCMC伦审2022年第[14]号。
1.1.2 主要试剂 人淋巴细胞分离液(货号:P8900,索莱宝生物科技有限公司);MACS 缓冲液、CD8 磁珠分选试剂盒、CD3/CD28 激活磁珠试剂盒(货号:130-091-221、130-045-201、130-050-101,德国美天旎生物技术有限公司);细胞毒性试剂盒(货号:G1780,美国Promega 公司);RNA 逆转录试剂盒和Realtime PCR 扩 增 试 剂 盒(货 号:MF787-T 和MF787-02,北京聚合美生物科技有限公司);宫颈癌细胞HeLa 和SiHa(货号:UBS294-01、UBS295-02,广州欣源生物科技有限公司);TNF-α(货号:SEKH-0047)、IFN-γ、Granzyme-B、perforin ELISA 试剂盒(货号:SEKH-0046、SEKH-0049、SEKH-0295)、Lipofectamine 2000 试剂盒(货号:YZ-11668);CCK-8 试剂盒、细胞凋亡检测试剂盒(货号:CA1210、CA1020)均购自北京索莱宝科技有限公司;CD8 抗体、Bcl-2 抗体、Bax 抗体、cleaved-caspase-3 抗 体、GAPDH 抗 体、山 羊 抗 兔IgG(货 号:66868-1-Ig、12789-1-AP、50599-2-Ig、66470-2-Ig、60004-1-Ig、30000-0-AP,武汉三鹰生物科技有限公司)。
1.2 方法
1.2.1 细胞培养 取液氮中保存的宫颈癌细胞HeLa 和SiHa 迅速融化,1 000 r/min 离心5 min,收集细胞沉淀,10 ml 含10%胎牛血清的RPMI1640 培养基重悬,转移至10 cm 细胞培养皿,隔天更换培养基,细胞生长至80%汇合时传代。
1.2.2 CD8+T 细胞分离、培养与鉴定 取宫颈癌患者外周血10 ml,1 500 r/min 离心10 min,收集血浆,30 ml 无菌PBS 溶液重悬,在50 ml 离心管中加入15 ml 人 淋 巴 细 胞 分 离 液,加 入3 ml 血 浆 溶 液,2 500 r/min 离心25 min,取中间分层的白色絮状物,10 ml无菌PBS重悬,1 500 r/min离心10 min,所得沉淀加入10 ml RPMI1640培养基重悬,即为PBMC。
1.2.3 CD8+T 细 胞 磁 珠 分 选PBMC CD8+T 细 胞
MACS缓冲液重悬PBMC,取1×107个细胞加入20 µl CD8 磁珠和80 µl MACS 缓冲液,避光孵育20 min,采用试剂盒将孵育的细胞加入磁分选的LS/MS 柱,液体流出后取出柱子,远离磁场,使用2 ml MACS缓冲液将柱中的细胞打入离心管,1 500 r/min 离心10 min,所得沉淀使用10 ml RPMI1640培养基重悬,即为CD8+T细胞。根据CD3/CD28激活磁珠数(细胞数为1∶1),在分选的CD8+T 细胞中加入CD3/CD28激活磁珠缓冲液激活72 h,5%CO2、37 ℃培养。
1.2.4 流式细胞术鉴定CD8+T细胞 取2×104个分选细胞,20 µl FACS缓冲溶液重悬,加入2 µl CD8抗体,避光孵育15 min,200 µl FACS缓冲液清洗,200 µl FACS缓冲液重悬,流式细胞仪检测CD8表达。
1.2.5 细胞转染 根据Lipofectamine 2000 试剂盒说明书,取1 支离心管加入240 µl 无血清RPMI1640培养基,加入Lipofectamine 2000 试剂10 µl 进行稀释。再取2 支离心管,每管加入120 µl 无血清RPMI1640 培养基,分别加入5 µl 空白质粒和5 µl circRNA-1565 质粒。在上述2 支离心管中每管加入125 µl Lipofectamine 2000 稀释液,室温下共孵育15 min。将CD8+T 细胞接种至12 孔板(3×105个/孔,750 µl),将250 µl上述混合液分别加入对应的12孔板,5%CO2、37 ℃培养24 h,将12 孔板中的培养基更换为新鲜培养基,继续培养24 h,所得细胞用于后续研究,转染空白质粒和circRNA-1565 质粒的细胞记为Control组和circRNA-1565组。
1.2.6 qRT-PCR 检 测circRNA-1565 表 达 采 用TRIzol 试剂盒提取转染后各组CD8+T 细胞的总RNA,定量,使用RNA 逆转录试剂盒将RNA 逆转为cDNA,Realtime PCR 扩增试剂盒进行qRT-PCR 反应,反应条件为:95 ℃ 5 min,95 ℃ 15 s,60 ℃ 1 min,共40 个循环。2-ΔΔCt计算基因相对表达,引物序列为circRNA-1565 F:5'-GATCACACCGTTAACCGCC-3',R:5'-ACGACGTTCTTTGTCAGCTT-3';β-actin F:5'-CTCCATCCTGGCCTCGCTGT-3',R:5'-GCTGTCACCTTAACCGTTCC-3'。
1.2.7 CCK-8 检测细胞增殖 将Control 组和circ-RNA-1565 组CD8+T 细胞以2 000 个/孔接种于96 孔板(90 µl/孔),设置5个平行孔作为重复,24 h、48 h、72 h 时取出96 孔板,每孔添加10 µl CCK-8 溶液,37 ℃培养2 h,酶标仪于450 nm处读取吸光度。
1.2.8 流式细胞术检测细胞凋亡 取Control 组和circRNA-1565 组CD8+T 细 胞各1×105个,分别加入200 µl 凋亡检测结合缓冲液重悬细胞,每管加入5 µl Annexin V-FITC,避光孵育10 min,加入5 µl PI混匀避光孵育5 min,设置单染管PI 和Annexin VFITC调节补偿,流式细胞仪检测细胞凋亡。
1.2.9 ELISA 检测TNF-α、IFN-γ、Granzyme-B 和perforin 浓度 在6 孔板中将HeLa 和SiHa 细胞分别与Control组和circRNA-1565组CD8+T 以5∶1比例共孵育24 h,分别记为:HeLa+CD8+T+Vector 组、HeLa+CD8+T+circRNA-1565 组、SiHa+CD8+T+Vector 组、SiHa+CD8+T+circRNA-1565 组,取共孵育的细胞悬液100 g 离心10 min,收集上清,ELISA 试剂盒检测上清中TNF-α、IFN-γ、Granzyme-B 和perforin 浓度:分别取100 µl 待测样品和标准品加至相应样品孔,37 ℃水浴避光孵育90 min,弃上清,缓冲洗涤液,洗涤甩干,重复4次,每孔加入100 µl上述备用的生物素化抗体工作液,37 ℃水浴避光孵育60 min,洗板4 次,每孔加入100 µl 显色液,37 ℃水浴避光孵育20 min,每孔加入终止液混匀,酶标仪检测450 nm处吸光度(OD450)。
1.2.10 CD8+T 细胞杀伤能力检测 收集 HeLa 和SiHa 细胞并调整浓度至2×104个/ml,将细胞悬液以50 µl/孔接种于96 孔板,将HeLa 和SiHa 细胞分别与Control组和circRNA-1565组CD8+T 以5∶1比例接种至96 孔板,共同培养24 h,分别记为CD8+T+Vector组、和CD8+T+circRNA-1565组。按照细胞毒性试剂盒说明书,96 孔板中每孔加入50 µl CytoTox-GloTMCytotoxicity 试剂,摇晃均匀,室温孵育15 min,检测570 nm处各孔吸光度(OD)。计算肿瘤杀伤率,细胞毒性(%)=(ODE+T-ODE-ODT)/(ODEmax-ODE)×100%,其中ODE+T为(效应细胞+靶细胞)OD,ODE为效应细胞OD,ODT为靶细胞OD,ODEmax为靶细胞全部裂解后的OD,HeLa 和SiHa 细胞为靶细胞,Control 组和circRNA-1565组CD8+T为效应细胞。
1.2.11 Western blot 收集转染后的各组CD8+T细胞,加入适量细胞裂解液冰上裂解10 min,离心取上清为总蛋白,BCA 法测定蛋白浓度,取10 µg 蛋白进行SDS-PAGE 电泳分离蛋白,湿转法将目的蛋白转至0.45 µm PVDF 膜,5%脱脂奶粉室温封闭,Bcl-2、Bax、cleaved-caspase-3、GAPDH一抗于4 ℃过夜孵育,山羊抗兔IgG室温孵育2 h,TBST洗涤3次后显影。1.3 统计学分析 采用GraphPad 8.0 软件进行数据处理和制图。实验重复3次,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 CD8+T 细胞鉴定与转染结果 流式细胞术结果显示(图1A),磁珠分选的人PBMC CD8+T 细胞阳性率>88%。qRT-PCR 结果显示(图1B),circRNA-1565 组CD8+T 细 胞circRNA-1565 表 达 显 著 高 于Control组(P<0.001),说明CD8+T分选及转染成功。2.2 circRNA-1565 抑制CD8+T 细胞增殖 CCK-8结 果 显 示,24 h、48 h、72 h 时,circRNA-1565 组CD8+T 细胞OD 值均显著低于Control 组(P<0.001,图2),说明circRNA-1565抑制CD8+T细胞增殖。
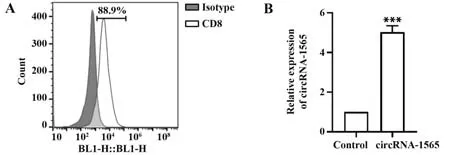
图1 CD8+T细胞鉴定与转染结果Fig.1 Identification and transfection results of CD8+T cells

图2 Control组和circRNA-1565组CD8+T细胞增殖能力Fig.2 Proliferation ability of CD8+T cells in control group and circRNA-1565 group
2.3 circRNA-1565 促进CD8+T 细胞凋亡 流式细胞术结果(图3A)显示,circRNA-1565 组CD8+T 细胞凋亡水平显著高于Control 组(P<0.001)。相比于Control 组,circRNA-1565 组CD8+T 细胞cleaved-caspase-3 表 达 显 著 增 加,Bcl-2/Bax 显 著 降 低(P<0.001)。说明circRNA-1565促进CD8+T细胞凋亡。

图3 circRNA-1565对CD8+T细胞凋亡的影响Fig.3 Effect of circRNA-1565 on apoptosis of CD8+T cells
2.4 circRNA-1565 抑 制CD8+T 细 胞 分 泌TNF-α、IFN-γ、Granzyme-B 和perforin ELISA 结果(图4)显示,相比于HeLa+CD8+T+Vector组,HeLa+CD8+T+circ-RNA-1565 组细胞上清中TNF-α、IFN-γ、Granzyme-B和perforin 浓度显著降低(P<0.001)。相比于SiHa+CD8+T+Vector 组,SiHa+CD8+T+circRNA-1565 组 细胞上清中TNF-α、IFN-γ、Granzyme-B和perforin浓度显著降低(P<0.001),说明circRNA-1565可抑制CD8+T细胞分泌TNF-α、IFN-γ、Granzyme-B和perforin。

图4 circRNA-1565 对CD8+T 细胞TNF-α、IFN-γ、Granzyme-B和perforin分泌的影响Fig.4 Effect of circRNA-1565 on secretions of TNF-α,IFN-γ, Granzyme-B and perforin in CD8+T cells
2.5 circRNA-1565 抑制CD8+T 细胞对宫颈癌细胞的杀伤作用 细胞杀伤检测结果(图5)显示,CD8+T+circRNA-1565 组CD8+T 细 胞 对HeLa 和SiHa细胞的杀伤能力显著低于CD8+T+Vector 组(P<0.001)。说明circRNA-1565可抑制CD8+T细胞对宫颈癌细胞的杀伤作用。
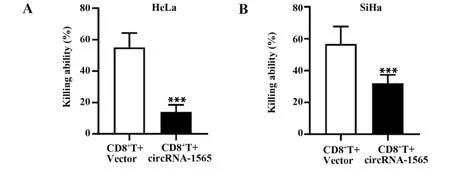
图5 circRNA-1565 对CD8+T 细胞杀伤HeLa(A)和SiHa(B)细胞的效果Fig.5 Effect of circRNA-1565 on killing of HeLa (A) and SiHa (B) cells by CD8+T cells
3 讨论
CD8+T 细胞是调控病毒感染的重要免疫细胞之一。目前人乳头瘤病毒(human papilloma virus,HPV)疫苗均以调节细胞毒性T 细胞杀伤活性达到清除HPV 的目的[8-9]。CD8+T 细胞在宫颈免疫微环境中发挥免疫监视、免疫效应、杀伤肿瘤细胞作用[10-11]。研究表明CD8+T、CD4+T细胞、B淋巴细胞在宫颈癌患者外周血中含量显著增加,CD8+T 细胞可对宫颈癌细胞起显著杀伤作用,但肿瘤细胞会通过自分泌胞外囊泡等多种方式调控CD8+T 细胞功能,促进自身免疫逃逸[12-13]。发现更多调控CD8+T 细胞功能的分子对CD8+T细胞相关免疫治疗至关重要。
circRNA 是一类具有闭合环状结构特点的非编码RNA,具有稳定性、组织细胞发育时空特异性以及保守性等生物学特性,在基因调控过程中具有重要作用[14-15]。研究表明N6-甲基腺苷修饰的circ-IGF2BP3 通过促进非小细胞肺癌PD-L1 去泛素化抑制CD8+T细胞功能以促进肿瘤免疫逃逸[16]。本课题组在前期研究中对宫颈癌组织进行了circRNA 测序分析,筛选得到多种宫颈癌肿瘤组织中高表达的circRNA,其中circRNA-1565 在宫颈癌组织中显著高表达,因此本研究集中于circRNA-1565,初步探究circRNA-1565能否通过调控CD8+T细胞功能并影响其对肿瘤的杀伤功能。
本研究首先从人PBMC 中分离得到CD8+T 细胞,将空白质粒和circRNA-1565 质粒转染至CD8+T细胞构建差异表达circRNA-1565 的CD8+T 细胞,并发现circRNA-1565 可显著抑制CD8+T 细胞增殖,促进CD8+T 细胞凋亡。研究表明抗原持续暴露条件下,CD8+T细胞会逐渐降低其增殖能力,处于功能耗竭状态,降低CD8+T 细胞的杀伤能力[17]。耗竭的CD8+T 细胞可发生代谢功能不全,伴随信号级联和表观遗传背景改变,从而抑制效应性免疫,并导致对免疫检查点阻断治疗反应不良,抑制circRNA-1565 可能改善CD8+T 耗竭,进而促进肿瘤免疫治疗。将差异表达circRNA-1565的CD8+T细胞分别与宫颈癌细胞HeLa 和SiHa 细胞共孵育,且发现高表达circRNA-1565 的CD8+T 细胞与HeLa 和SiHa 细胞共孵育后其TNF-α、IFN-γ、Granzyme-B 和perforin 分泌能力显著减弱,且CD8+T 细胞的肿瘤细胞杀伤能力显著减弱。研究表明CD8+T 细胞可通过分泌TNF-α、IFN-γ、Granzyme-B 和perforin 杀伤靶细胞,其中TNF-α 对机体免疫有调节作用,TNF-α 通过促进T细胞及其他杀伤细胞表达而杀伤或抑制肿瘤细胞;IFN-γ 可通过诱导凋亡或非凋亡细胞死亡杀伤肿瘤细胞;Granzyme-B 是一种丝氨酸蛋白酶,介导细胞毒性T淋巴细胞和自然杀伤细胞凋亡信号通路;perforin 是一种T 细胞分泌的可刺穿靶细胞外膜的蛋白,起肿瘤杀伤作用[18-19]。本研究说明circ-RNA-1565 可通过抑制CD8+T 细胞TNF-α、IFN-γ、Granzyme-B和perforin分泌而抑制其肿瘤杀伤功能。
研究表明肿瘤细胞可通过分泌外泌体传递遗传物质进而调控CD8+T 细胞功能,如肿瘤细胞可通过外泌体转移circUSP7 而调控非小细胞肺癌CD8+T细胞功能,膀胱癌细胞外泌体可通过转移circTRPS1促进CD8+T 细胞耗竭[20-21]。本研究推测宫颈癌细胞或可通过外泌体而向CD8+T细胞转移circRNA-1565调控其杀伤能力,本课题组会进行进一步探究。
综上,本研究发现circRNA-1565 可调控CD8+T细胞增殖和凋亡,进而抑制CD8+T 细胞对宫颈癌细胞的杀伤作用,但circRNA-1565 的调控机制及其临床应用潜力还需进一步探究。
