乳酸调控小鼠巨噬细胞M2型极化的关键靶点分子筛选①
2023-11-13杨颖颖刘新宇贵州医科大学生物与工程学院贵阳550000
杨颖颖 黄 瑾 刘新宇 邱 炜 (贵州医科大学生物与工程学院, 贵阳 550000)
巨噬细胞是特异性及非特异性免疫的重要参与者,具有抗原提呈、维持组织稳态、吞噬及降解等功能。在不同条件刺激下,巨噬细胞呈现出不同的表型,发挥的功能也不同,被称为巨噬细胞的极化[1]。根据激活条件的不同,将其分为经典途径激活的M1 型和替代途径激活的M2 型[2]。M1 型巨噬细胞可由IFN-γ 及LPS 诱导活化,高表达CD86、CD11c 等标志分子,分泌大量IL-12、iNOS、TNF-α 等细胞因子,但分泌IL-10 较少,具有促进炎症发生、抗肿瘤等功能;M2 型巨噬细胞可由IL-4 及IL-13 等细胞因子诱导活化,高表达Arg-1 等标志分子,分泌大量IL-10、HIF-1、VEGF 等细胞因子,但分泌IL-12较少,具有促进损伤修复及肿瘤形成等功能[3-4]。存在于肿瘤组织中的巨噬细胞,即肿瘤相关巨噬细胞(tumor-associated macrophages,TAM),是肿瘤微环境(tumor microenvironment,TME)中数量最多的免疫细胞[5]。近年来,已有大量研究证明,TAM主要表现为M2 型巨噬细胞的特点,且有促进肿瘤细胞增殖、转移、血管生成及免疫逃逸等作用[6-7]。
生理条件下,人体大多数组织的pH 稳定在7.35~7.45。对多种恶性实体肿瘤的研究表明,大部分TME pH 波动在6.4~7.0,最低可至5.6[8-9]。代谢过程中乳酸的大量堆积被认为是TME 呈酸性的最主要原因。在正常生理条件下,乳酸浓度为1.5~3.0 mmol/L,在大部分实体肿瘤的TME中,乳酸浓度为10~20 mmol/L,少部分可达到30 mmol/L[10]。乳酸的来源为“Warburg 效应”,即无论氧气充足与否,肿瘤细胞都倾向于有氧糖酵解作为主要的能量代谢途径[11]。通过有氧糖酵解,葡萄糖被转化为大量的乳酸。谷氨酰胺分解途径,作为人体含量最多的氨基酸,谷氨酰胺常被肿瘤细胞摄取从而释放能量,在这个过程中,乳酸作为副产物被大量堆积[12]。已有大量研究证实,TME 中的乳酸亦能促进肿瘤细胞的形成、血管生成及免疫逃逸[13]。然而,关于乳酸与TAM 之间相互作用的研究还比较少,相互作用机制还不甚明确,本研究将以此为出发点展开。
肿瘤的发生发展是个极其复杂且漫长的过程,其产生的具体机制尚未研究清楚,缺乏特效药物。VEGF、HIF-1 等细胞因子均能促进肿瘤细胞的发生发展[14-15]。近年来,随着贝伐珠单抗、雷莫芦单抗等针对VEGF 受体的靶向药物及帕博丽珠单抗等免疫治疗药物的问世,肿瘤患者的生存率得到了明显提高,恶性肿瘤治疗进入了“免疫治疗”时代。但巨噬细胞相关的免疫治疗药物还是空白。因此本研究筛选乳酸调控小鼠腹腔巨噬细胞M2 型极化的关键靶点分子,为巨噬细胞相关的肿瘤免疫治疗提供理论依据。
1 材料与方法
1.1 材料 6~8 周龄雌性C57 小鼠(Mus musculus)购自贵州医科大学动物实验中心,已通过动物伦理审批(审批号:2000269)。Trizol RNA 分离试剂、Lipo3000(美国Thermo Fisher 公司);流式抗体(美国BD公司);TB Green试剂及逆转录试剂盒(日本宝生物公司);FBS、OPTI-MEM 培养基(美国Gibco 公司);Deionized Water 及BSA、可溶淀粉、Cell Counting Kit 8、PBS(北京索莱宝科技有限公司);ELISA试剂盒(上海爱必信公司);CO2培养箱、QuantStudio3 qPCR 仪(美国Thermo Fisher 公司);流式细胞仪(美国艾森公司);F-4600 荧光分光光度计(日本Hitachi公司);精密酸度计(上海大普仪器有限公司);倒置显微镜(德国Leica公司)。
1.2 方法
1.2.1 鼠腹腔巨噬细胞的分离及处理 将30 只C57 小鼠随机分为3 组,每组10 只分开提取腹腔巨噬细胞。提取细胞前3 d 给每只小鼠腹腔注射含5%淀粉的生理盐水0.5 ml,1 次/d。第3 天使其麻醉后引颈处死小鼠。75%乙醇消毒小鼠后,用RPMI1640 对小鼠进行腹腔灌洗并将灌洗液收集在50 ml 离心管中,800 r/min 离心5 min,弃上清液,得到细胞沉淀。配制含10%胎牛血清的培养基重悬细胞,平铺于6 孔板内,放入含5%CO2、37 ℃恒温培养箱中,2 h后换液,去除未贴壁的细胞,即得到小鼠腹腔巨噬细胞。将纯化后的小鼠腹腔巨噬细胞分为2 个组,分别加入下列培养基:RPMI1640 完全培养基(对照);将1 mmol/L 乳酸加至RPMI1640 培养基,使培养基中乳酸的终浓度为20 mmol/L。各组处理24 h后收集细胞。
1.2.2 腹腔巨噬细胞的消化及活力检测 吸弃上清,加入适量的Ⅳ型胶原酶,放入37 ℃含有5%CO2的细胞培养箱中15 min,收集细胞悬液,800 r/min离心5 min弃上清,PBS漂洗后用完全培养基重悬。收集细胞至96 孔板中,每孔加入100 µl 的细胞悬液。每组做3个重复实验;处理24 h后吸弃培养基,向每个孔中加入CCK-8 溶液10 µl;将培养板放入37 ℃含有5%CO2的细胞培养箱中孵育2 h;用酶标仪检测出每个孔在450 nm处的吸光度。
1.2.3 流式细胞术鉴定巨噬细胞 消化、收集细胞至1.5 ml离心管,调整细胞浓度为1×106个/100 µl,900 r/min 离心5 min,PBS 漂洗细胞,800 r/min 离心5 min,弃上清;1%BSA 重悬细胞,加入适量荧光标记抗体的染色缓冲液,冰上孵育20 min。PBS 漂洗细胞,800 r/min 离心5 min,300 µl PBS 重悬细胞后上流式细胞仪读取数据。
1.2.4 qPCR 法检测VEGF、HIF-1、Arg-1等基因转录水平变化 Trizol 法提取两组细胞的总RNA,采用TaKaRa PrimeScript RT reagent Kit 逆转录试剂按说明书合成cDNA,-20 ℃保存待用。采用TaKaRa TB Green Premix Ex Taq Ⅱ检 测 巨 噬 细 胞VEGF、HIF-1、Arg-1、IL-10等表达。反应体系总体积10 µl,其 中 包 括TB Green 5 µl、正 反 向 引 物 各0.4 µl、RNase Free dH2O 3.2 µl、cDNA 1 µl。扩增条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,72 ℃ 30 s,重复40个循环; 95 ℃ 15 s,60 ℃ 1 h,95 ℃ 1 s,Tm 56 ℃。引物序列见表1。反应结束后,以β-actin 为参照,采用2-ΔΔCt法计算各基因的相对表达量。

表1 qPCR引物序列Tab.1 Primer sequences of qPCR
1.2.5 转录组学分析及qPCR 验证 用Trizol 法提取各组细胞的总RNA。随后通过Agilent 2100 bioanalyzer 精确检测RNA 完整性,确定合格后得到后期转录组测序使用的totalRNA。以片段化的mRNA为模板,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成cDNA 第一条链。由dUTP 取代dNTPs中的dTTP,USER 酶降解含U 的cDNA 第二条链后进行PCR 扩增并获得文库。库检合格后,把不同文库按照浓度及数据量的需求pooling 后进行Illumina测序。上述得到的单链环状DNA 文库即为Raw reads,随后对其进行质控,利用HISAT2 软件将质控后的clean reads 与参考基因组进行比对,获取定位信息。利用subread 软件中的featureCounts 工具统计每个基因从起始到终止范围内覆盖的reads 数并进行过滤。然后对每个样本分别进行基因表达水平的定量分析。应用edgeR 软件,按ROBINSON等[16]的方法对定量分析结果进行统计学分析,定义差异基因筛选标准为|log2(fold change)|>1,P<0.05。据差异倍数大小及表达量高低选择4 个基因Tpt1、Malat1、Hes6、Slc4a7 进行qPCR 验证,校验转录组数据可靠性,方法同1.2.4,引物序列见表2。

表2 部分差异表达基因qPCR验证引物序列Tab.2 Primer sequences of some differentially expressed genes verified by qPCR
1.2.6 基因互作网络图的构建及关键差异表达基因的筛选 将筛选到的差异表达基因按数据库编号,其与蛋白网络互作数据库进行STRING 比对后,按照confidence score>0.7提取得到差异表达基因互作关系。利用Cytoscape软件将筛选出的差异表达基因构建互作网络图,并按照节点数筛选关键基因。
1.2.7 siRNA 转染及验证 选择蛋白互作节点数最多的两个差异表达基因Malat1及Tpt1构建siRNA进行转染。收集细胞平铺于6 孔板上,以每个视野细胞融合率在70%~80%为佳;转染前1 h 将培养基更换为OPTI-MEM。采用250 µl DEPC 水稀释目的基因siRNA(由上海吉荧生物技术有限公司合成,序列见表3),125 µl DEPC水稀释NC siRNA。在250 µl OPTI-MEM 中加入4 µl Lipo3000,充分混匀后室温孵育5 min,制成溶液1;在250 µl OPTI-MEM 中加入6.5 µl 上述稀释好的siRNA,制成溶液2;将溶液1和溶液2 充分混合,室温静置15 min;将混合孵育好的溶液1和溶液2加入细胞培养孔内,再加入1.5 mlOPTI-MEM 培养基,即每个孔的总液体量为2 ml。转染6 h 后,更换为含10%血清的1640 培养基,24 h后收取细胞。提取一部分转染后细胞的总RNA 并逆转录。以上述逆转录的cDNA 为模板,检测Tpt1及Malat1的表达水平,计算出转染效率。再次处理剩余的转染后细胞,qPCR 法检测转染后巨噬细胞Arg-1、VEGF、CD11c等基因的相对表达量变化情况。

表3 siRNA序列Tab.3 siRNA sequences
1.3 统计学方法 采用GraphPad Prism8 软件进行数据分析,计量资料以±s形式表示。组间比较使用独立样本t检验,P<0.05 即代表差异有统计学意义。GO 分析使用Metascape 软件,KEGG 分析采用cluster Profiler R package 软件检验差异表达基因在KEGG 通路中的统计富集性,校正P<0.05 被认为差异有统计学意义。
2 结果
2.1 小鼠巨噬细胞的鉴定 F4/80 及CD11b 是鼠源巨噬细胞的标志性表面标志物。流式细胞术结果显示,获得的小鼠腹腔细胞表达F4/80 的阳性率为97.40%,CD11b的阳性率为93.37%(P<0.000 1),表明已成功获得高纯度的小鼠腹腔来源巨噬细胞(图1)。
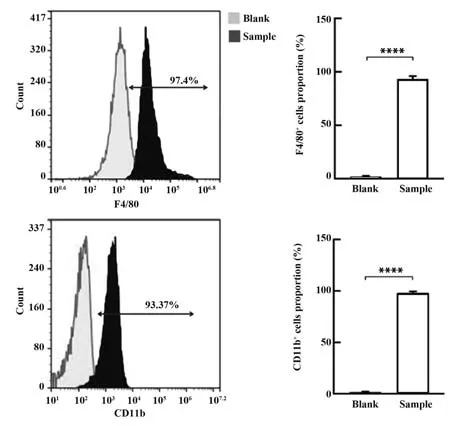
图1 巨噬细胞表面标志物鉴定Fig.1 Identification of macrophage surface markers
2.2 乳酸对巨噬细胞活力的影响 结果显示,随着乳酸浓度增加,细胞活力也逐渐下降。在乳酸浓度为20 mmol/L 时,对细胞活力影响较小,且该浓度亦为大部分实体肿瘤TME 中的乳酸浓度。当乳酸浓度升至40 mmol/L 时,细胞活力明显下降,细胞大量死亡。故本实验选择20 mmol/L 乳酸处理细胞(图2)。

图2 乳酸对巨噬细胞活力的影响Fig.2 Effect of lactic acid on macrophage activity
2.3 乳酸促进巨噬细胞的M2 型极化 M2 型巨噬细胞高表达Arg-1,同时分泌大量IL-10、VEGF及HIF-1α。通过qPCR 法检测Arg-1、IL-10、VEGF及HIF-1α的相对表达量。结果显示,Arg-1、IL-10、VEGF及HIF-1α的表达量均上调,表明乳酸能促进巨噬细胞的M2型极化(图3)。

图3 乳酸促进巨噬细胞的M2型极化Fig.3 Lactic acid promotes M2-type polarization of macrophages
2.4 转录组学分析
2.4.1 差异表达基因的筛选及GO 富集分析 与对照组相比,经20 mmol/L 乳酸处理后,得到差异表达基因共6 295 个,其中上调基因2 690 个,下调基因3 605 个。GO 富集分析结果显示,上调差异表达基因主要参与细菌防御反应、胞质基因翻译、胎盘发育等生物过程;核糖体、胞质、核糖体亚单位等细胞组分;结构分子活性、核糖体结构组成、受体调节活性等分子功能(图4A)。下调差异表达基因主要参与ncRNA 代谢、加工、核糖体生物合成等生物过程;核仁、前核糖体、小亚基加工体等细胞组分;RNA 催化活性、转移酶活性、核酸酶活性等分子功能(图4B)。

图4 上调差异表达和下调差异表达基因的GO分析Fig.4 GO analysis of up-regulated and down-regulated differentially expressed genes
2.4.2 差异表达基因的KEGG 富集分析 KEGG富集分析结果显示,上调差异表达基因主要富集在核糖体(mmu03010)、癌症通路(mmu05200)、MAPK(mmu04010)、PI3K-Akt(mmu04151)等 信 号 通 路(图5A)。下调差异表达基因主要富集在细胞因子受体相互作用(mmu04060)、嘌呤代谢(mmu00230)、NOD 样受体信号通路(mmu04621)、自然杀伤细胞介导的细胞毒性(mmu04650)等信号通路(图5B)。

图5 上调差异表达基因和下调差异表达基因的KEGG分析Fig.5 KEGG analysis of up-regulated and down-regulated differentially expressed genes
2.4.3 差异表达基因的qPCR 验证 根据差异倍数(|log2(fold change)|)的大小,选择了排名靠前的上调表达基因Tpt1、Malat1和下调表达基因Hes6、Slc4a7进行qPCR 验证。结果显示,4 个基因qPCR结果与转录组测序结果趋势一致(图6)。

图6 部分差异表达基因qPCR验证Fig.6 Some differentially expressed genes were verified by qPCR
2.4.4 基因互作网络图的构建及关键差异表达基因的筛选 利用Cytoscape 软件将筛选出的差异表达基因构建互作网络图(附图1,www.immune99.com)。网络图中,与某基因相对应的蛋白相互作用的节点数越多,说明该基因可能在乳酸对巨噬细胞调控过程中发挥的功能越重要。筛选出关键上调差异表达基因Malat1、Tpt1、FADD、Per1、Gipr等(表4)。

表4 部分上调关键差异表达基因Tab.4 Some key up-regulated differentially expressed genes
2.5 关键基因验证
2.5.1Tpt1和Malat1siRNA 有效片段的筛选 分别设计了2条针对小鼠Tpt1和Malat1基因的siRNA,同时采用与哺乳动物无关的siRNA 作为阴性对照(NC),qPCR 检测转染24 h 后巨噬细胞内Tpt1和Malat1的 表 达。结 果 发 现,Tpt1siRNA-1 序 列 及Malat1siRNA-1 序列的抑制效果最明显,抑制率分别为77%及81%(P<0.01)。后续实验均选取这两个序列进行转染(图7)。

图7 Tpt1及Malat1的 siRNA对其mRNA表达的影响Fig.7 Tpt1 and Malat1 siRNA and their effect on mRNA expressions
2.5.2Tpt1及Malat1对巨噬细胞极化的影响 结果显示,抑制Tpt1及Malat1基因表达并再次进行乳酸处理后,巨噬细胞VEGF及Arg-1的表达出现下调,CD11c出现上调,表明乳酸对巨噬细胞M2 型极化的促进作用明显下降(图8、图9)。
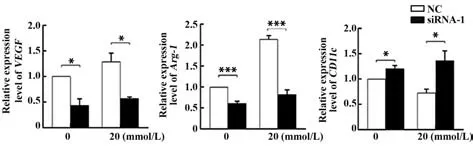
图8 Tpt1对巨噬细胞极化的影响Fig.8 Effects of Tpt1 on polarization of macrophages

图9 Malat1对巨噬细胞极化的影响Fig.9 Effects of Malat1 on polarization of macrophages
3 讨论
巨噬细胞的极化受多种因素的调控,是一个动态转化的过程,M1/M2 型只是人为将其极端化的两种亚型。但实际上,巨噬细胞的亚型分类众多,并不局限于M1 和M2。目前,比较公认的是高表达CD11c 和IL-12 者 鉴 定 为M1 型;高 表 达Arg-1、VEGF、HIF-1 及IL-10 者鉴定为M2 型[17]。因此,通过qPCR 实验检测CD11c、Arg-1、VEGF、HIF-1等基因相对表达量的变化来评估乳酸对巨噬细胞极化的影响。结果表明,20 mmol/L乳酸能上调巨噬细胞Arg-1、VEGF、HIF-1、IL-10等基因的表达,说明乳酸能促进小鼠巨噬细胞M2型极化。
通过转录组学技术分析了乳酸对小鼠巨噬细胞转录水平的影响,筛选出差异表达基因共6 295 个,其中上调基因2 690 个,下调基因3 605 个。GO 分析结果显示,上调差异表达基因主要参与细菌防御反应、胞质基因翻译、结构分子活性、核糖体结构组成等。下调差异表达基因主要参与ncRNA 代谢、核糖体生物合成、核酸酶活性等。通过KEGG 分析发现,上调差异表达基因主要涉及PI3K-Akt、癌症通路、MAPK 等信号通路。PI3K-Akt 通路即磷脂酰肌醇3-激酶-蛋白激酶通路,该通路被激活后能促进细胞增殖[18-19]。此外,PI3K-Akt 通路还可通过P13K/Akt/mTOR 途径调节VEGF 蛋白合成,促进肿瘤血管生成[18,20]。而癌症通路的激活能直接促进癌细胞的形成、发展及转移,在恶性肿瘤形成及发展过程中有不可或缺的作用。MAPK 即丝裂原活化蛋白激酶,参与细胞有丝分裂、增殖及凋亡[21]。MAPK 的激活,促进了肿瘤细胞的增殖。同时,通过调节基质金属蛋白酶(matrix metalloproteinases,MOL/LPs)和聚焦黏附激酶(focal adhesion kinase,FAK)的表达和活化,MAPK 参与了肿瘤细胞的迁移和浸润,进一步促进肿瘤的转移[22-23]。以上均说明乳酸能促进巨噬细胞中肿瘤相关通路的激活并促进肿瘤的发生发展。下调差异表达基因主要涉及NOD 样受体、自然杀伤细胞介导的细胞毒性等信号通路。NOD 样受体是参与天然免疫的一种特殊模式识别受体,可被巨噬细胞识别并呈递给其他免疫细胞,启动免疫应答[24]。自然杀伤细胞介导的细胞毒性,即ADCC 作用,通过自然杀伤细胞与癌细胞IgG的Fc部分结合,可杀灭癌细胞[25]。在乳酸微环境中,巨噬细胞的NOD 样受体信号通路和ADCC、抗原呈递功能被抑制,削弱了天然免疫应答,机体免疫功能受损,这可能是导致肿瘤细胞发生免疫逃逸的原因之一。
通过构建互作网络图,筛选出了Tpt1、Malat1等关键上调差异表达基因。Tpt1可编码细胞质蛋白TCTP(translationally controlled tumor protein)。通过Toll样受体,TCTP可刺激趋化因子CXCL1(C-X-C Motif Chemokine 1)和CXCL2(C-X-C Motif Chemokine 2)的分泌以及中性粒细胞在TME 内的聚集,从而减弱其抗肿瘤活性[26]。目前已有证据证实Tpt1 在多种肿瘤组织中过表达:在卵巢癌和宫颈癌中,Tpt1 的过表达能促进肿瘤细胞的转移[27-28];在胃癌组织中,过表达的Tpt1 可能通过调节细胞周期G1/S 转换而促进胃癌的增殖、侵袭及迁移[29]。这说明Tpt1 与肿瘤关系密切,是肿瘤发生发展的重要参与者与促进者。Malat1 即肺腺癌转移相关转录本1,是长链非编码RNA 的一种,通过作用于SR 蛋白调控细胞周期从而发挥生物学作用。Malat1 在非小细胞肺癌、肾癌、膀胱癌、子宫内膜癌、乳腺癌等组织中均呈高表达,能促进肿瘤组织的增殖、侵袭及转移,敲低Malat1 的表达能够抑制癌细胞增殖并促进其凋亡[30]:在乳腺癌中,通过激活PI3K-Akt 通路,Malat1能诱导Her-2 阳性细胞的EMT 样表型,提高细胞侵袭力,从而促进乳腺癌细胞转移[31];在前列腺癌中,沉默Malat1 能使前列腺癌细胞恢复正常细胞的糖酵解表型,从而促进癌细胞的清除[32-33]。作为最早被发现的长链非编码RNA,Malat1 作为肿瘤进展和转移的促进剂的作用是明确的。通过转染实验,分别验证了Tpt1及Malat1表达被抑制后,乳酸能下调巨噬细胞VEGF、Arg-1表达,上调CD11c表达,这说明乳酸可能通过上调巨噬细胞Tpt1及Malat1表达从而促进其M2型极化。
综上所述,基因Tpt1及Malat1可能为乳酸调控小鼠巨噬细胞M2 型极化的关键靶点分子。但本实验仅为体外研究结果,下一步将通过构建肿瘤动物模型,进一步探讨乳酸微环境中Tpt1及Malat1调控小鼠巨噬细胞M2 型极化的分子机制,以期为巨噬细胞相关的肿瘤免疫治疗提供理论基础及新思路。
