腹腔镜结肠癌根治术后肝转移风险列线图预测模型的建立及其临床意义
2023-11-13李碧李佳
李碧,李佳
(1.杭州市第一人民医院 消化内科,浙江 杭州 310000;2.南京大学医学院附属鼓楼医院 消化科,江苏 南京 210008)
结肠癌是临床上常见的消化道恶性肿瘤,其起源于结肠上皮组织[1-2]。有研究[3]表明,结肠癌是癌症相关死亡的第二大因素[3]。结肠癌的5 年生存率为64.60%,伴有同步转移的患者,生存率仅为14.3%,而肝脏是结肠癌最常见的转移部位[3]。有研究[4-6]表明,约20.00% 的患者初诊时已发生肝转移,25.00%~40.00%的患者在根治术后也会发生肝转移。结肠癌外科治疗的方式以根治术为主,随着医疗的发展,腹腔镜结肠癌根治术已成为国内外治疗结肠癌的主要方式,相较于传统开放手术,其具有创伤小、恢复快和切口美观等优点[7-8]。本研究选取155例行腹腔镜结肠癌根治术的患者作为研究对象,分析术后发生肝转移的独立危险因素,并建立列线图模型,旨在为临床个体化预测结肠癌肝转移风险,以及早期制定干预措施,提供参考依据。现报道如下:
1 资料与方法
1.1 一般资料
选取2016 年9 月1 日-2018 年12 月31 日于杭州市第一人民医院行腹腔镜结肠癌根治术的155 例患者,回顾性分析该155例患者的临床资料。根据术后肝脏转移的情况,分为肝转移组(n=36)和无肝转移组(n=119),并使用多因素Cox 回归模型,分析术后发生肝转移的独立危险因素,并建立列线图模型。
1.2 纳入和排除标准
1.2.1 纳入标准 行腹腔镜结肠癌根治术,组织标本经病理学诊断为结肠癌;临床资料完整。
1.2.2 排除标准 合并其他部位肿瘤者;妊娠者;存在远处转移者;病情危重不能耐受者;临床资料不完整。本研究经过医院伦理委员会审核,并批准该项目的实施。同时,本研究对象均已签署知情同意书,知晓并同意参与研究。
1.3 研究方法
电话或者门诊随访155例患者的术后情况,收集患者的临床资料,包括:年龄、性别、肿瘤部位、组织类型、TNM 分期、原发灶浸润深度、肿瘤沉积、肿瘤大小、术后癌胚抗原(carcinoembryonic antigen,CEA)、术后化疗、淋巴转移、输血和梗阻等,共计13 项临床指标。随访时间截止至2022 年2 月28 日,随访结局为患者发生结肠癌肝转移,并以肝部CT 和MRI等影像学检查结果作为依据。
1.4 统计学方法
采用SPSS 22.0 和R 软件(4.1.0)进行统计学分析。计数资料以例(%)表示,比较采用χ2检验。使用多因素Cox回归模型,分析术后发生肝转移的独立危险因素,用风险比(hazard ratio,)和95%CI作为效应量,P<0.05 为差异有统计学意义。使用R 软件(4.1.0)的survminer 包对多因素Cox 回归分析中P<0.05 的临床指标进行森林图展示,采用R 软件(4.1.0)的rms 包和survival 包构建术后肝转移风险的列线图预测模型,并绘制1、3和5年肝转移率的校准曲线,基于survival ROC 包绘制受试者操作特征曲线(receiver operator characteristic curve,ROC curve),并计算曲线下面积(area under curve,AUC),当AUC>0.75时,表示精准度较高。
2 结果
2.1 术后发生肝转移的单因素分析
36 例(23.23%)术后发生肝转移,119 例(76.77%)没有发生肝转移。两组患者年龄、性别、肿瘤部位、组织类型、原发灶浸润深度、术后CEA和输血比较,差异均无统计学意义(P>0.05);两组患者TNM 分期、术后化疗、肿瘤沉积、肿瘤大小、淋巴转移和梗阻比较,差异均有统计学意义(P<0.05)。见表1。

表1 术后发生肝转移的单因素分析 例(%)Table 1 Univariate analysis of postoperative liver metastasis n(%)
2.2 多因素Cox回归分析
将单因素分析中,差异有统计学意义的6项指标(TNM 分期、术后化疗、肿瘤沉积、肿瘤大小、淋巴转移和梗阻)作为变量,以是否发生肝转移作为临床事件,发生肝转移时间作为事件时间,进行多因素Cox 回归分析,结果显示:TNM 分期 ≥ Ⅲ期(=32.397,95%CI:4.658~225.338,P=0.000)、肿瘤沉积(=8.009,95%CI:1.966~32.620,P=0.004)、淋巴转移(=17.191,95%CI:6.076~48.641,P=0.000)和梗阻(=3.383,95%CI:1.202~9.525,P=0.021)是术后发生肝转移的独立危险因素,术后化疗(=0.075,95%CI:0.011~0.505,P=0.008)为保护性因素,肿瘤大小(P=0.824)为排除指标。见表2和图1。
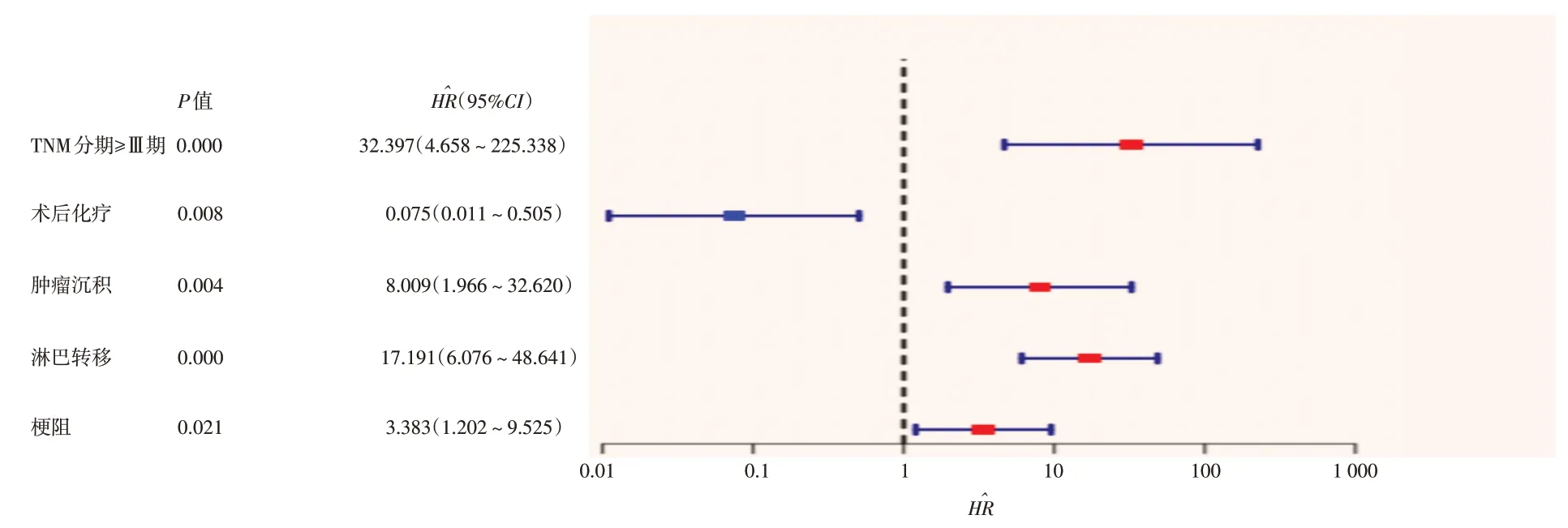
图1 多因素Cox回归森林图Fig.1 Forest map of multivariate Cox regression

表2 术后发生肝转移的多因素COX回归分析Table 2 Multivariate Cox regression analysis of postoperative liver metastasis
2.3 术后发生肝转移风险的列线图预测模型
2.3.1 模型的建立 基于多因素Cox 回归分析结果,将术后发生肝转移的5项独立危险因素(TNM分期、术后化疗、肿瘤沉积、淋巴转移和梗阻)构建列线图模型,用于预测术后发生肝转移的风险(图2)。列线图中,各独立危险因素的线段长短,对应该因素对本项研究中发生肝转移风险大小的基础贡献,以评分代表其贡献值。根据每例患者各指标的具体定位,标记出各预测因素对应的线段,以及评分标尺上所对应的分值,将每个预测因素的评分相加,得到总分,总分的分值对应的概率,代表患者术后发生肝转移的风险程度。

图2 术后发生肝转移风险的列线图预测模型Fig.2 The nomogram prediction mode for the risk of postoperative liver metastasis
2.3.2 列线图预测模型的准确性和有效性的验证 绘制1、3 和5 年肝转移率的校准图(图3),结果显示:校准图中的实际曲线与理想曲线贴合紧密,该列线图模型具有较高的预测效能。

图3 列线图的校准曲线Fig.3 Calibration curve of the nomogram

图4 列线图的ROC curveFig.4 ROC curve of the nomogram
2.3.3 列线图预测模型的ROC curve 绘制ROC curve,结果显示:AUC 为0.843,该预测模型具有良高的精准度和区分度。
3 讨论
3.1 结肠癌的临床现状
随着人们生活习惯和饮食结构的变化,我国结肠癌的发病率呈逐年上升的趋势,严重威胁人们的生命健康[9-10]。尽管腹腔镜结肠癌根治术具有较好的治疗效果,但术后发生肝转移仍然是导致患者死亡的主要因素[11-12]。因此,建立腹腔镜结肠癌根治术后发生肝转移风险的预测模型,至关重要。本研究回顾性分析了本院行腹腔镜结肠癌根治术的155例患者的临床资料,筛选出结肠癌患者术后发生肝转移的5个独立危险因素,包括:TNM 分期、肿瘤沉积、淋巴转移、梗阻和术后化疗。其中,术后化疗为保护性因素。
3.2 腹腔镜结肠癌根治术后发生肝转移的独立危险因素
3.2.1 TNM 分期 有文献[13-14]报道,TNM 分期大于或等于Ⅲ期的患者,相对于Ⅰ期和Ⅱ期患者,更易发生术后复发和转移。此时,肿瘤细胞生长速度更快,侵袭能力更强,已经侵犯黏膜下层,患者属于中晚期,预后较差。
3.2.2 肿瘤沉积 肿瘤沉积是位于原发肿瘤淋巴引流区的孤立性肿瘤结节[15],也是影响结肠癌患者术后发生肝转移的独立因素,其为肿瘤在血管、神经和肠系膜中的迁移和侵袭,提供了新的“通道”[16]。
3.2.3 淋巴转移 当发生淋巴转移时,说明癌细胞累及范围较广泛。此时,肿瘤细胞可通过位于结肠壁上的淋巴管网,采用顺行或者逆行的方式,经过毛细血管并扩散,增加了腹腔镜结肠癌根治术中切除肿瘤病灶的难度,淋巴清扫不干净,导致术后复发和转移风险的增加[17]。
3.2.4 梗阻 梗阻为结肠癌术后常见并发症,其临床表现为:结肠病灶局部水肿,导致肠壁血运较差,甚至发生肠穿孔。此时,毒素排出困难,增加了体内肿瘤细胞复发的概率,导致肝转移的概率增加[18]。
3.2.5 术后化疗 化疗能够消除潜在的微转移,降低术后风险和手术难度[19]。一项Meta分析[20]表明,术前已存在肝转移,但可行切除术的患者,辅助化疗能够提高患者的无病生存期。本研究也表明,术后行化疗患者,发生肝转移的风险较未化疗患者低。结肠癌术后化疗主要针对Ⅲ期患者,对于Ⅱ期,则有所不同,Ⅱa期无需化疗,而Ⅱb期,即:病理学检查发现存在脉管癌栓,或有神经、淋巴浸润的患者,一般选择术后化疗。
3.3 腹腔镜结肠癌根治术后发生肝转移风险的列线图预测模型的临床价值
基于此5项危险因素,笔者构建了腹腔镜结肠癌根治术后发生肝转移风险的列线图预测模型,根据患者个体化情况,得出相应的术后肝转移风险评分,具有较高的准确度和区分度。
3.4 本研究的局限性
本研究为单中心研究,可能存在偏倚。为了增强研究结果的可靠性,后续还将联合多中心数据进行分析。
综上所述,TNM 分期 ≥ Ⅲ期、肿瘤沉积、淋巴转移和梗阻是腹腔镜结肠癌根治术后发生肝转移的独立危险因素,而术后化疗是保护性因素。本研究构建的列线图预测模型,具有较高的准确度和区分度,能为腹腔镜结肠癌根治术后患者提供个性化的肝转移风险评估,为早期干预和治疗提供科学、可靠的证据。
