多形性胶质母细胞瘤相关基因和候选通路的生物信息学分析
2023-11-11赵一明许海洋
赵一明, 许海洋
(吉林大学第一医院神经外科,吉林 长春 130021)
神经胶质瘤是最常见的恶性原发性颅内肿瘤,约占原发性恶性脑肿瘤的80%[1]。根据世界卫生组织 (World Health Organization,WHO) 分类,神 经 胶 质 瘤 分 为4 个 等 级, 为WHO 1~4[2]。WHO 1 和WHO 2 定义为低级别胶质瘤(low-grade glioma,LGG),与预后不良相关的WHO 3 和WHO 4 定义为高级别胶质瘤(high-grade glioma,HGG)。 多形性胶质母细胞瘤(glioblastoma multiforme,GBM) 为WHO 4,通常被认为是所有脑肿瘤中最具侵袭性的类型[3]。2000—2014 年的 报 道[4-5]显 示:GBM 患 者 的1 年 和5 年 相 对 生 存率分别为41.4%和5.4%。LGG 患者预后明显好于GBM 患者;然而,多数LGG 患者最终发展为HGG。术后,放疗和替莫唑胺给药是GBM 患者的主要治疗方法[6]。但GBM 患者预后仍然较差,中位生存期约为初始诊断后15 个月[7]。因此,寻找GBM 新的生物标志物和治疗靶点非常重要。
分子生物学的发展促进了GBM 的潜在机制的研究。多种分子机制和信号转导途径已被证实在GBM 癌变过程中发挥关键作用,对其进行深入分析对于改善GBM 患者预后具有重要意义[8-9]。近年来,随着微阵列技术和生物信息学的发展及对GBM 高通量微阵列和基因芯片数据的深入研究,越来越多的GBM 相关差异表达基因(differentially expressed genes,DEGs)被发现[10-13]。这些基因的发现有望为阐明GBM 发病的分子机制和治疗靶点提供新的理论指导。
本研究采用生物信息学方法对已公开发表自癌症 基 因 组 图 谱 (The Cancer Genome Atlas,TCGA) 数 据 库 和 基 因 表 达 综 合 (Gene Expression Omnibus,GEO)数据库中的多形性胶质母细胞瘤的基因表达数据集TCGA-GBM 及GSE7696 进行联合分析,筛选出具有高可信度的DEGs 和重要的相关信号通路,构建了DEGs 的蛋白-蛋白互作(protein-protein interation,PPI) 网络,并筛选出关键基因作为分子靶标,为更好地诊断和治疗多形性胶质母细胞瘤提供依据。
1 资料与方法
1.1 资料来源从TCGA 数据库中下载GBM 患者的临床资料和mRNA 测序数据,其中包括5 例正常对照组组织,157 例GBM 组织。在GEO 数据库(https://www.ncbi.nlm.nih.gov/geo/) 中,以“glioblastoma”为关键词进行检索,纳入标准:①样品来自人GBM 组织标本;②研究对象包含GBM 患者和正常对照;③研究类型为Expression profiling by array。从GEO 数据库中筛选下载数据集GSE7696,GSE7696 数据集基于GPL570 平台。GSE7696 数据集包括80 例GBM 癌组织和4 例正常脑组织。
1.2 DEGs 筛选对于TCGA-GBM 数据,采用R 语言的Deseq2 数据包筛选正常组与GBM 组患者的DEGs,筛选条件为:倍数变换(fold change,FC) 对 数 的 绝 对 值|Log2FC|≥2,AdjustedP≤0.05。GSE7696 芯片数据采用R 语言的limma 数据包筛选GBM 与正常脑组织之间的DEGs,按照|Log10FC|≥2 且AdjustedP<0.05的标准进行筛选。
1.3 基因本体(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)信号通路富集分析采用在线分析工具gProfiler(https://biit.cs.ut.ee/gprofiler/gost)对DEGs 进行GO 功能富集分析和KEGG 信号通路富集分析,以P<0.05 为差异有统计学意义。分析结果采用R 语言的tinyarray 和ggplot2 数据包进行可视化。
1.4 PPI 网络的构建和关键基因的筛选
STRING 在 线 数 据 库(https://string-db.org/)可用于检索分子间相互作用和预测PPI 网络关系。采用STRING 数据库对上述77 个共同下调基因进行分析,构建PPI 网络并采用Cytoscape 3.9.1 软件进行可视化,采用Cytohubba 插件,基于4 种拓扑算法:最大聚集中心(maximal clique centrality, MCC)、 最 大 邻 域 组 件(maximum neighborhood component,MNC)、度(Degree)和边缘渗透组件(edge percolated component,EPC)分别筛选出PPI 网络中前5 个重要节点,将上述4 种算法所获得的结果作为关键基因,即hub 基因。
1.5 PPI 网络中hub 基因的验证从数据库中收集 GBM 相关靶基因的信息。 DisGeNET(https://www.disgenet.org/home/) 是一个综合疾病、基因和实验研究的综合性多功能数据平台[14]。GeneCards(https://www.genecards.org/)是一个包括基因组学、蛋白质组学和转录组学在内的功能综合数据库[15]。因此,本研究在上述2 个数据库中以“glioma”和“glioblastoma”为关键词进行检索,筛选与GBM 相关的靶点,并与上述PPI 网络中的关键基因相交,从而对hub 基因进行验证。
2 结 果
2.1 DEGs 的筛选结果对 TCGA-GBM 和GSE7696 数据集中的DEGs 取交集,最终筛选出90 个DEGs,包括13 个共同上调差异表达基因(upregulated differentially expressed genes,UDEGs) 和77 个共同下调差异表达基因(downregulated differentially expressed genes,DDEGs)。不同数据集的DEGs 筛选结果的火山图和Venn 图见图1 和图2 及 表1 和表2。
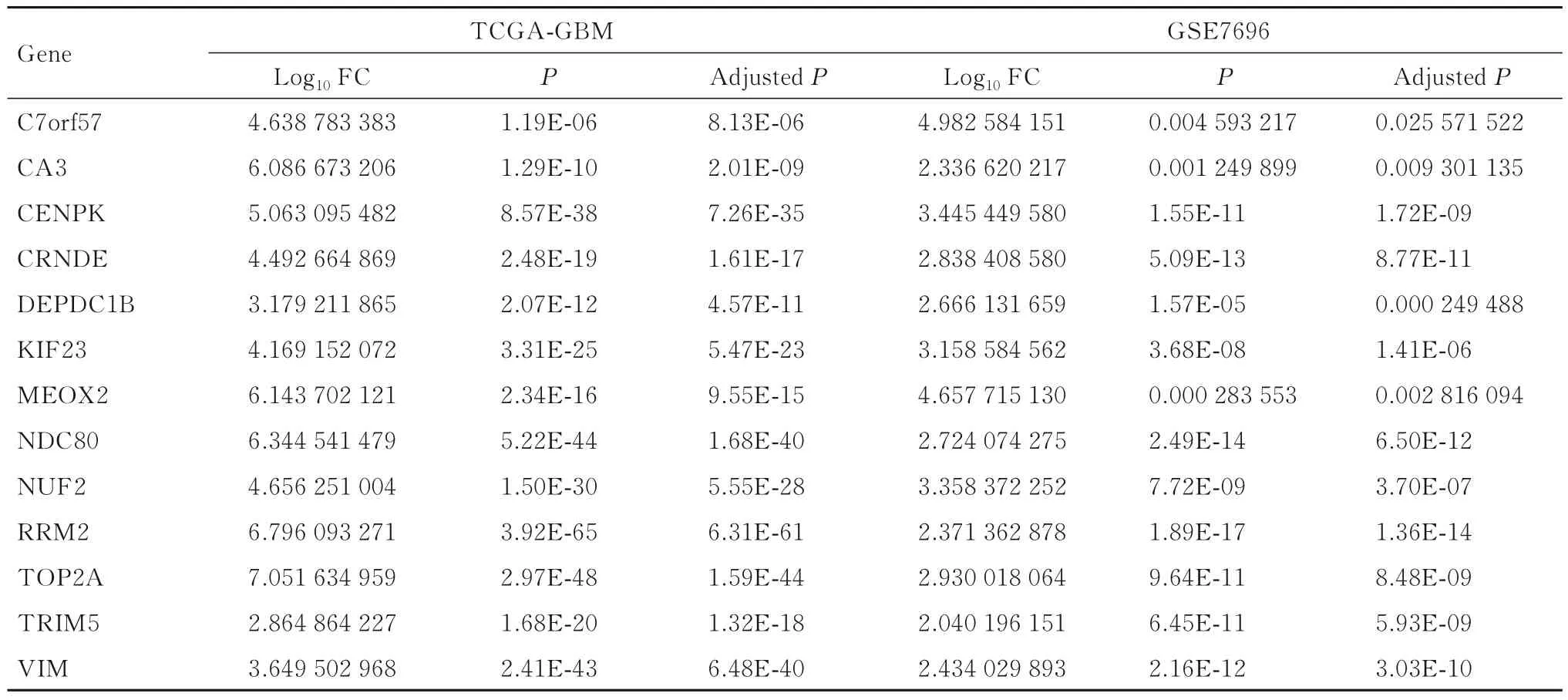
表1 TCGA-GBM 和GSE7696 数据集中UDEGsTab.1 UDEGs in TCGA-GBM and GSE7696 Datasets
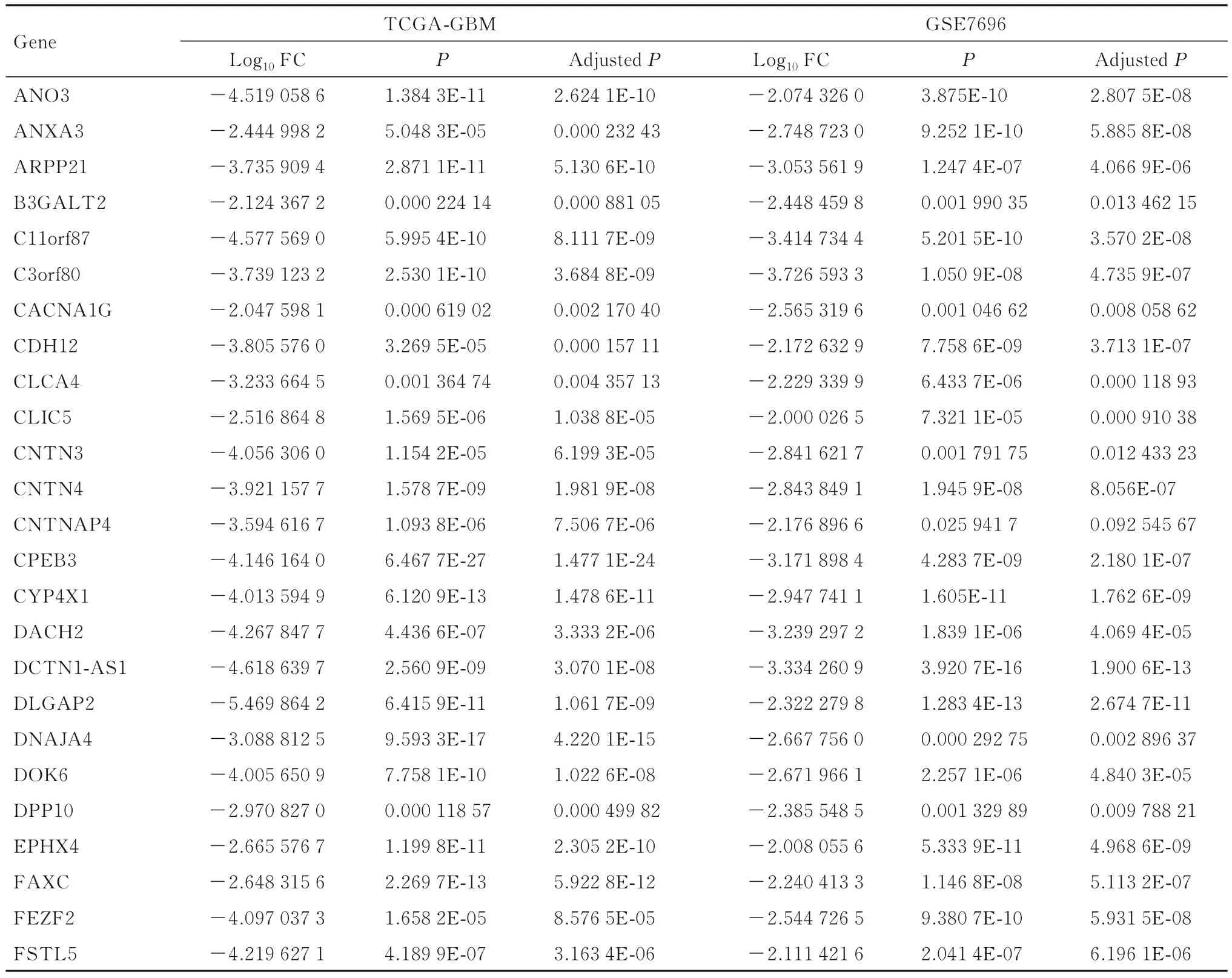
表2 TCGA-GBM 和GSE7696 数据集中DDEGsTab.2 DDEGs in TCGA-GBM and GSE7696 Datasets
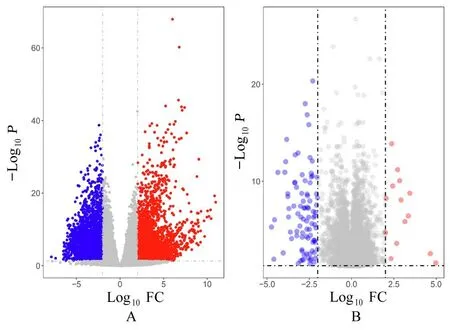
图1 GBM 的DEGsFig.1 DEGs of GBM
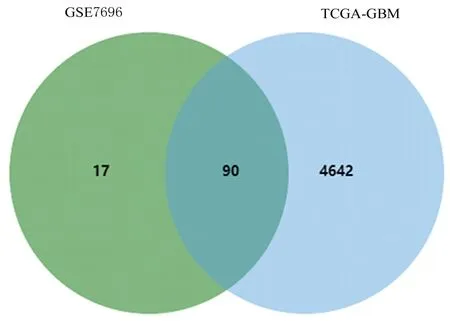
图2 TCGA-GBM 和GSE7696 数据集中共同DEGs 的Venn 图Fig.2 Venn diagram of common DEGs in TCGA-GBM and GSE7696 Datasets
2.2 DEGs 的GO 功能富集分析和KEGG 信号通路富集分析GO 功能富集分析结果显示:DDEGs在细胞学过程(biological processes,BP) 方面主要是参与顺行突触传递信号和化学突触传递等生物过程(图3A)。在细胞成分(cell component,CC)方面,主要分布于突触和GABA-A 受体复合物等组织(图3B)。在分子功能(molecular function,MF)方面,DDEGs 主要有氯离子通道活性和γ-氨基丁酸(gamma-aminobutyric acid,GABA) 门控氯离子通道活性等分子功能(图3C)。DDEGs 的KEGG 信号通路富集分析结果显示:DDEGs 在GABA 能突触、神经活性配体-受体相互作用等通路中富集表达(图3D)。UDEGs 的GO 功能富集分析结果显示:UDEGs 主要在细胞核分裂等生物过程中发挥重要作用(图4)。
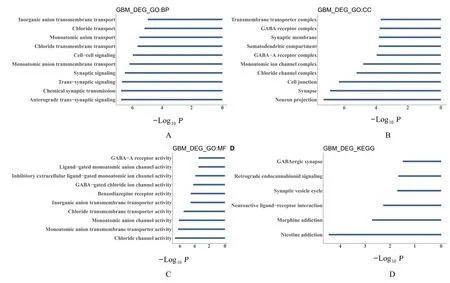
图3 DDEGs 的GO 功能富集分析和KEGG 信号通路富集分析Fig.3 GO functional enrichment analysis and KEGG signaling pathway enrichment analysis on DDEGs
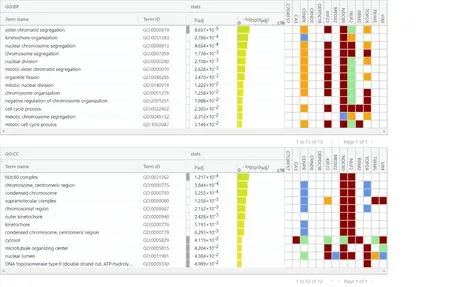
图4 UDEGs 的GO 功能富集分析Fig.4 GO functional enrichment analysis on UDEGs
2.3 PPI 网络构建和hub 基因筛选PPI 网络共涉及节点73 个,边数48 个,平均节点度为1.32,PPI 富 集P值 小 于1.0E-16。 将PPI 网 络 导 入Cytoscape 3.9.1 软件进行可视化(图5),并采用MCODE 插件筛选PPI 网络中的关键功能模块,包括2 个关键功能模块(共12 个基因)(图6)。通过CytoHubba 插 件,根 据MCC、MNC、Degree 和EPC 这4 种拓扑算法对模块1(图6A)筛选出关键基因为溶质载体家族17 成员6 (solute carrier family 17 member,6SLC17A6)、溶质载体家族1成员2(solute carrier family 1 member 2,SLC1A2)、前速激肽前体1(tachykinin precursor 1,TAC1)、突触结合蛋白1(synaptotagmin 1,SYT1)、RNA结合蛋白fox1 同源物3 (RNA binding fox-1 homolog 3,RBFOX3) 和γ-氨基丁酸A 型受体亚基γ2 (gamma-aminobutyric acid type A receptor subunit gamma 2,GABRG2)(表3)。
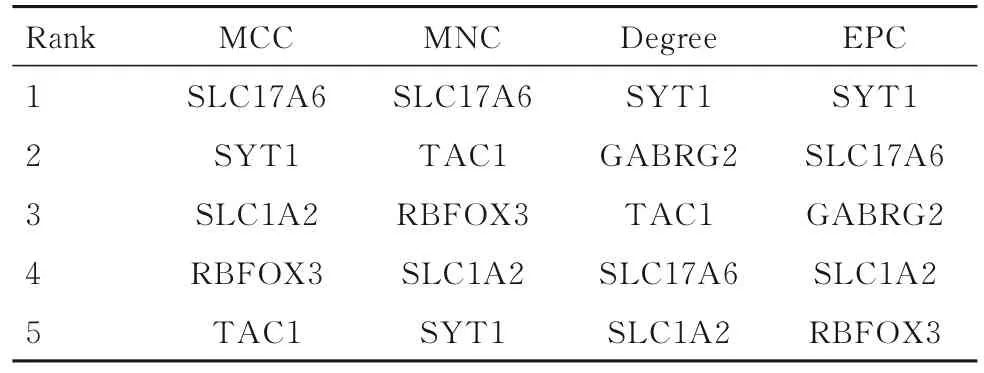
表3 基于Cytohubba 插件筛选DDEGs 的hub 基因Tab.3 Hub genes of DDEGs screened based on Cytohubba plugin
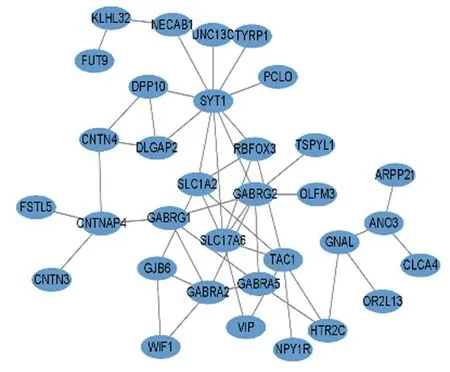
图5 GBM 的编码蛋白的PPI 网络图Fig.5 PPI network diagram of DDEGs of GBM
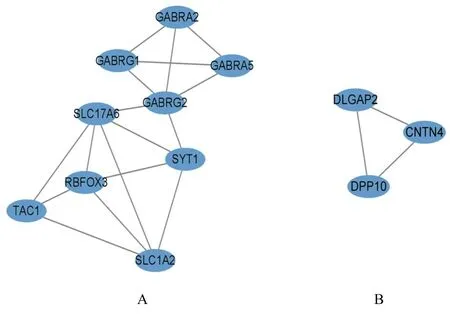
图6 MCODE 分析DDEGs 关键子模块Fig.6 Key submodules of DDEGs analyzed by MCODE
2.4 PPI 网络中hub 基因的验证DisGeNET 和GeneCards 数据库整合检索结果,获得GBM 相关疾病蛋白靶点。将PPI 网络分析获得的6 个关键基因定位至GBM 相关疾病靶基因,共获得5 个交集靶 点(SLC1A2、 TAC1、 SYT1、 RBFOX3 和GABRG2), 进 一 步 验 证 了SLC1A2、 TAC1、SYT1、RBFOX3 和GABRG2 蛋 白 与GBM 的 潜 在关联性。靶点相关信息见表4。

表4 靶点相关信息Tab.4 Related informations of targets
3 讨 论
GBM 是神经外科最难治的恶性肿瘤之一,其复发率高和预后差会给患者、家庭和社会均带来沉重负担[16]。目前,GBM 的传统治疗主要依靠手术最大限度切除,辅以放疗和化疗。然而,患者生存率仍然较低,5 年生存率不足5%,中位生存时间仅为15 个月[6]。因此,迫切需要寻找新的生物标志物并制定更为有效的治疗策略来改善GBM 患者的预后。
本研究从TCGA-GBM 和GSE7696 数据集中共筛选出90 个DEGs,并对这些基因进行生物信息学分析,探讨其在GBM 发展中的功能和信号通路。通过构建PPI 网络,并采用Cytoscape 3.9.1 软件分析及DisGeNET 和GeneCards 数据库验证,本研究最终确定了与GBM 密切相关的6 个关键基因,分别为GABRG2、TAC1、RBFOX3、SLC17A6、SLC1A2 和SYT1。这些关键基因可能在GBM 发展过程中起重要作用。
本研究的GO 功能富集和KEGG 信号通路富集分析结果显示:在GBM 中,氯离子通道活性、GABA-A 受体活性和GABA 能突触活性下调。GABA 作为成年哺乳动物大脑的主要抑制性神经递质,通过激活GABA 受体在中枢神经系统中产生 抑 制 性 效 应[17]。GABA 受 体 由 GABA-A 和GABA-B 受 体 组 成。在GBM 中,GABA-A 受 体 的功能性表达与肿瘤的低恶性程度有关,并且其活性抑制了神经胶质瘤细胞的增殖[18]。此外,细胞中氯 离 子 通 道1 (chloride intracellular channel 1,CLIC1) 的活性在GBM 细胞增殖中起调控作用[19]。BLANCHART 等[18]研究显示:GBM 细胞中GABA-A 受体能够激活氯离子通道,从而调控氯离子流动,减弱肿瘤的生长并延长生存时间。上述研究结果与本研究结果一致,进一步证实了GABA-A 受体在GBM 发生发展中的重要作用。此外,PPI 网络分析结果显示:GABRG2 可能是影响GBM 进展的关键基因。GABRG2 作为GABA-A 受体的亚基,编码的蛋白是GABA 突触通道的主要成 分[20]。研 究[21]显 示:GABA-A 受 体 亚 基 基 因(GABRA1、GABRB3、GABRG2 和GABRD) 与遗传性癫痫综合征相关。另外,有研究[22]显示:GABRG2 在胶质瘤组织中表达降低,但其影响胶质瘤进展的潜在分子机制尚未明确。
本研究采用PPI 网络分析确定了与GBM 密切相关的其他5 个关键基因,包括SYT1、TAC1、RBFOX3、SLC17A6 和SLC1A2。SYT1 是中枢神经系统中神经递质释放的重要介质。SYT1 通过高度保守的细胞质C2A 和C2B 结构域与钙结合,触发突触囊泡融合,随后上述结构域中的一系列疏水残基穿透质膜双层,影响神经传递和突触可塑性[23]。遗 传 学 研 究[24]显 示SYT1 可 能 是GBM 的候选致癌基因。TAC1 编码多种产物,包括P 物质(substance P,SP)、神经激肽A、神经肽K 和神经肽γ。TAC1 的高甲基化在包括头颈癌在内的多种癌细胞中常被检测到,导致TAC1 基因的表达和功能受到抑制[25-26]。本研究结果显示:TAC1 在GBM 中表达下调,为进一步探讨TAC1 在GBM 中的表观遗传修饰状态提供了思路。RBFOX3 编码的蛋白是fox1 剪接因子家族的新成员,其在有丝分裂 后 的 神 经 元 中 被 检 测 到[27]。研 究[28]显 示:RBFOX3 通过激活hTERT 间接调节肝细胞癌的发生发展,并被认为可能是潜在的新治疗靶点。然而,RBFOX3 在GBM 中的功能目前尚不清楚。
SLC17A6 编码囊泡谷氨酸转运蛋白2(vesicular glutamate transporter, VGLUT),SLC1A2 编码谷氨酸转运体(glutamate transporter-1,GLT-1),其对谷氨酸的摄取和清除至关重要。SLC17A6 和SLC1A2 的谷氨酸功能障碍会增加细胞外谷氨酸,已被证明会导致中枢神经系统中毒[29-30]。谷氨酸是神经系统中主要的兴奋性神经递质,在脑肿瘤细胞增殖、生长和运动中起重要作用。神经胶质瘤细胞已被证明可通过谷氨酰胺酶产生大量谷氨酸,过量谷氨酸能信号可能会导致LGG 进 展 和GBM 侵 袭[31]。因 此,本 研 究 为 进 一步探讨谷氨酸能突触活性在GBM 进展中的潜在机制提供候选基因。 然而, 尚未有研究探讨SLC17A6 与胶质瘤之间的关联。
本研究对GBM 的下调差异表达基因进行了分析,证实了GABA 在GBM 发生发展中的作用。此外,本文作者还发现GABRG2、TAC1、RBFOX3、SLC17A6、SLC1A2 和SYT1 这6 个关键基因,为GBM 的治疗提供潜在的靶点。本研究为GBM 发生发展的分子机制研究提供了初步依据。但本研究尚有局限性,仍需要结合细胞实验和临床样本进一步验证上述关键基因在体内外的功能和调控机制。
