二氧化硫对大鼠急性心肌缺血损伤后心肌纤维化的改善作用及其机制
2023-11-11刘佳丽聂连桂刘茂军赵俊雄汪刘洋
刘 星, 刘佳丽, 聂连桂, 刘茂军, 赵俊雄, 汪刘洋, 杨 军
(南华大学衡阳医学院附属第一医院心内科, 湖南 衡阳 421001)
心肌梗死(myocardial infarction,MI)是冠心病最严重的表现,也是全世界最常见的致死原因之一[1]。尽管溶栓治疗和经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI) 血 运 重建等治疗手段明显提高了MI 患者的早期存活率,但发生MI 时,心肌急性缺血损伤导致的病理性心肌重构可导致患者心功能下降,严重影响MI 患者的 远 期 预 后[2]。心 肌 纤 维 化(myocardial fibrosis,MF) 是心肌重构的主要病理表现形式,与MI 后患者的预后不良有密切关联,然而目前对MF 和心肌重构尚无针对性干预手段。
二氧化硫(sulfur dioxide ,SO2) 是一种新型内源性气体信号分子,内源性SO2具有多种生物学功能,对心血管系统具有重要作用。SO2可拮抗高血压、抑制肺动脉高压、改善动脉粥样硬化和降低心脏缺血再灌注损伤,其内在机制可能与维持钙稳态、抑制氧化应激、抗炎、调节自噬和细胞凋亡有关联[3-4]。WANG 等[5]研究显示: SO2可以通过抑制内质网应激而改善MI 后MF,但其机制尚未完全阐明。自噬是一种通过溶酶体降解途径自我吞噬的生理过程,在不同的细胞环境和条件下发挥促生存或促死亡的作用[6],研究[7]显示:自噬与MF 和心肌重构具有紧密联系,但SO2能否通过调控自噬改善急性心肌缺血损伤后MF 尚不清楚。本研究以自噬为切入点,探讨外源性SO2对大鼠急性心肌缺血损伤后MF 的影响及其可能的作用机制。
1 材料与方法
1.1 实验动物、主要试剂和仪器于南华大学动物实验中心挑选24 只SPF 级雄性成年SD 大鼠,体质量(250±20)g,实验动物生产许可证号:SCXK(湘) 2015-0002,动物使用许可证编号:SYXK(湘)2015-0001,将其饲养于SPF 级实验室,保持恒温(22 ℃±2 ℃)和恒湿状态,人工照明,昼夜交替各12 h,自由摄食摄水。实验过程严格遵守南华大学实验动物管理办法。亚硫酸钠(Na2SO3)和亚硫酸氢钠(NaHSO3) 均购自美国Sigma 公司,异丙肾上腺素(isoprenaline, ISO)购自大连美伦生物科技有限公司,兔抗大鼠基质金属蛋白酶8 (matrix metalloproteinase-8,MMP-8)、基质金属 蛋 白 酶 抑 制 剂 2 (tissue inhibitor of metalloproteinase-2,TIMP-2)、含半胱氨酸的天冬氨酸蛋白水解酶9 (aspartate proteolytic enzyme containing cysteine-9,Caspase-9)、含半胱氨酸的天冬氨酸蛋白水解酶 3(aspartate proteolytic enzyme containing cysteine-3,Caspase-3)、自噬相关蛋白3(autophagy related protein 3,Atg3)、自噬相关蛋白5(autophagy related protein 5,Atg5)、自噬相关16 样蛋白1(autophagy related 16 like protein 1,ATG16L1)、GAPDH 抗体和辣根过氧化物酶(horseradish peroxidase,HRP) 标记的山 羊抗兔IgG 二抗均购自武汉三鹰生物技术有限公司,BCA蛋白检测试剂盒、增强型化学发光试剂盒和 SDSPAGE 凝胶制备试剂盒均购自上海碧云天生物技术有限公司,Masson 染色试剂盒由上海威奥生物科技有限公司提供, Tunel 试剂盒(KGA704) 由江苏凯基生物技术有限公司提供。电源、电泳槽和转膜槽均购自美国Bio-Rad 公司。
1.2 实验动物分组和急性心肌缺血损伤动物模型的制备先将所有大鼠适应性喂养1 周,随后采用随机数字表法将其随机分为对照组、ISO 组(给予ISO)、ISO+SO2组(给 予ISO+SO2) 和SO2组(给予SO2),每组6 只。ISO 组和ISO+SO2组大鼠连续2 d 腹腔注射ISO(50 mg·kg-1·d-1)构建急性心肌缺血损伤大鼠模型,对照组和SO2组大鼠腹腔注射等量生理盐水,完善心电图及血浆肌钙蛋白T水平检测确定造模成功后,ISO+SO2组和SO2组大鼠腹腔注射SO2供体Na2SO3溶液(0.54 mmol·kg-1·d-1)和NaHSO3溶 液(0.18 mmol·kg-1·d-1)[8],注射4周,同时对照组和ISO 组大鼠给予等量生理盐水腹腔注射。
1.3 各组大鼠心电图检查和血浆肌钙蛋白T 水平检测麻醉大鼠,麻醉后迅速将其摆为平卧位并固定体位,通过导联线固定,记录标准导联心电图。随后立即采集尾静脉血,采用化学发光免疫分析法检测各组大鼠血浆超敏肌钙蛋白T 水平。
1.4 超声心动图检测各组大鼠心功能各组大鼠称体质量,麻醉大鼠,除去大鼠前胸体毛,固定于检测台上,采用M 型超声检测左心室运动情况,取心率稳定的3 个心动周期进行测量,检测各组大鼠左心室短轴缩短率(left ventricular short axis shortening rate,LVFS) 和左心室射血分数(left ventricular ejection fraction,LVEF)。
1.5 标本采集和处理麻醉大鼠后开胸取出心脏,剪取部分左心室肌组织以4%多聚甲醛固定,剩余大鼠心肌组织-80 ℃保存用于后续实验。
1.6 Masson 染色观察各组大鼠心肌组织中胶原沉积情况4%多聚甲醛固定的心室肌组织以梯度乙醇浸泡脱水,石蜡包埋、切片,将石蜡切片脱蜡至水化,以 Masson 试剂盒染色,按照试剂盒说明书操作,显微镜下观察,采用Image J 软件进行纤维化定量分析,计算各组大鼠心肌组织中胶原体积分数(collagen volume fraction,CVF)。CVF=胶原蓝染部分面积/总面积×100%。
1.7 TUNEL 染色检查各组大鼠心肌细胞凋亡率
心肌组织制成石蜡切片后,按照TUNEL 染色试剂盒说明书操作步骤检测心肌组织细胞凋亡率,荧光显微镜下观察并计算心肌细胞凋亡率。心肌细胞凋亡率=细胞凋亡数/总细胞数×100%。
1.8 Western blotting 法检测各组大鼠心肌组织中目的蛋白表达水平取保存于-80 ℃的心肌组织,滤纸吸净水分后剪取0.1 g,加入900 μL 细胞裂解缓冲液、9 μL 苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF),于冰上充分研磨,离心提取上清,采用BCA 法进行蛋白定量,煮沸变性后冷冻保存。制备适当浓度的十二烷基硫酸钠(sodium dodecyl sulfate, SDS)- 聚 丙 烯 酰 胺 凝 胶 电 泳(polyacrylamide gel electrophoresis,PAGE)凝胶,严格按照 Western blotting 实验步骤进行上样、电泳、转膜、封闭,于4 ℃孵育一抗(稀释比例 1∶1 000)过夜,TBST 洗膜后孵育二抗(稀释比例1∶ 5 000) 1 h,将 PVDF 膜再次漂洗后均匀涂布显影液,在显影仪下显影,将GAPDH 作为内参,采用Image J 软件进行灰度值分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参GAPDH 条带灰度值。
1.9 统计学分析采用GraphPad Prism 8.0 统计软件进行统计学分析。各组大鼠血浆肌钙蛋白T 水平、LVFS、LVEF、心肌组织中CVF 和心肌细胞凋亡率及心肌细胞中MMP-8、TIMP-2、Caspase-3、Caspase-9、Atg3、Atg5 和Atg16L1 蛋 白 表 达 水 平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠心电图改变和血浆肌钙蛋白T 水平与对照组比较,ISO 组和ISO+SO2组大鼠心电图ST 段呈现明显抬高,且血浆肌钙蛋白T 水平明显升高(P<0.05),而SO2组大鼠心电图及血浆肌钙蛋白T 水平差异无统计学意义(P>0.05),提示ISO 组和ISO+SO2组大鼠急性心肌缺血损伤模型制备成功。见表1 和图1。
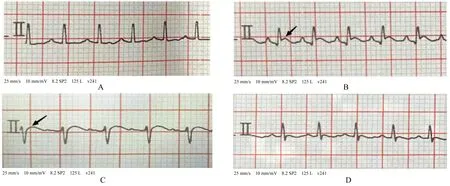
图1 各组大鼠心电图结果Fig.1 Electrocardiogram results of rats in various groups
表1 各组大鼠血浆肌钙蛋白T 水平Tab.1 Levels of troponin T in plasma of rats in various groups [n=6,±s,ρB/(ng·L-1)]

表1 各组大鼠血浆肌钙蛋白T 水平Tab.1 Levels of troponin T in plasma of rats in various groups [n=6,±s,ρB/(ng·L-1)]
*P<0.05 vs control group.
Group Control ISO ISO+SO2 SO2 Plasma troponin T level 32.86±5.97 307.12±84.06*346.73±27.38*32.65±4.73
2.2 各组大鼠LVFS 和LVEF与对照组比较,ISO 组大鼠LVFS 和LVEF 明显降低(P<0.05);与ISO 组比较,ISO+SO2组大鼠LVFS 和LVEF明显升高(P<0.05),提示SO2可以改善大鼠急性心肌缺血损伤后的心功能。见表2 和图2。
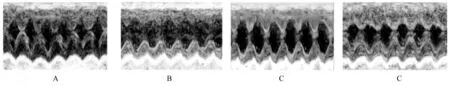
图2 各组大鼠超声心动图结果Fig.2 Echocardiogram results of rats in various groups
表2 各组大鼠LVFS 和LVEFTab.2 LVFS and LVEF of rats in various groups(n=6,±s,η/%)

表2 各组大鼠LVFS 和LVEFTab.2 LVFS and LVEF of rats in various groups(n=6,±s,η/%)
*P<0.05 vs control group; △P<0.05 vs ISO group.
Group Control ISO ISO+SO2 SO2 LVEF 72.80±3.27 56.09±10.79*65.41±5.24△71.59±7.67 LVFS 42.26±3.20 29.86±7.33*36.17±4.19△41.45±6.85
2.3 各组大鼠心肌组织中胶原沉积情况与对照组比较,ISO 组大鼠心肌组织中CVF 明显升高(P<0.05);与ISO 组比较,ISO+SO2组大鼠心肌组织中CVF 明显降低(P<0.05),见图3 和4。
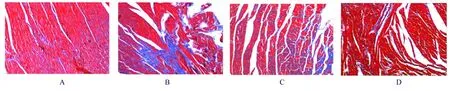
图3 各组大鼠心肌组织纤维化情况(Masson 染色,×400)Fig.3 Fibrosis of myocardium tissue of rats in various groups (Masson staining,×400)
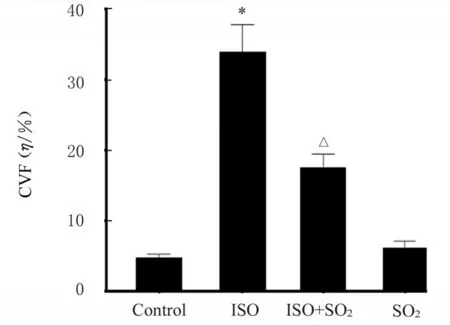
图4 各组大鼠心肌组织中CVFFig.4 CVF in myocardium tissue of rats in various groups
2.4 各组大鼠心肌组织中MMP-8 和TIMP-2 蛋白表达水平与对照组比较,ISO 组大鼠心肌组织中MMP-8 蛋白表达水平升高(P<0.05),TIMP-2蛋白表达水平降低(P<0.05);与ISO 组比较,ISO+SO2组大鼠心肌组织中MMP-8 蛋白表达水平降低(P<0.05),TIMP-2 蛋白表达水平升高(P<0.05)。见图5。
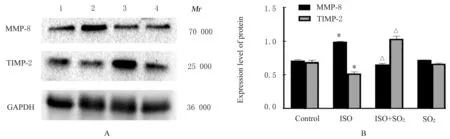
图5 各组大鼠心肌组织中MMP-8 和TIMP-2 蛋白表达电泳图(A)和直条图(B)Fig.5 Eletropohregram(A) and histogram(B) of expressions of MMP-8 and TIMP-2 proteins in myocardium tissue of rats in various groups
2.5 各组大鼠心肌细胞凋亡率与对照组比较,ISO 组大鼠心肌细胞凋亡率明显升高(P<0.05);与ISO 组比较,ISO+SO2组大鼠心肌细胞凋亡率明显降低(P<0.05)。见图6 和7。
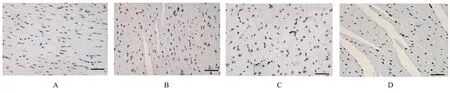
图6 各组大鼠心肌细胞凋亡情况 (TUNEL 染色,Bar=50 μm)Fig.6 Apoptosis of cardiomyocyte of rats in various groups(TUNEL staining,Bar=50 μm)
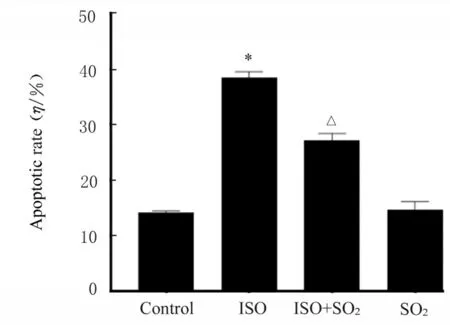
图7 各组大鼠心肌细胞凋亡率Fig.7 Apoptotic rates of cardiomyocytes of rats in various groups
2.6 各组大鼠心肌组织中凋亡相关蛋白Caspase-3和Caspase-9 表达水平与对照组比较,ISO 组大鼠心肌组织中Caspase-3 和Caspase-9 蛋白表达水平升高(P<0.05);与ISO 组比较,ISO+SO2组大鼠心肌组织中Caspase-3 和Caspase-9 蛋白表达水平降低(P<0.05)。见图8。
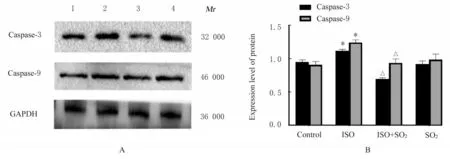
图8 各组大鼠心肌组织中Caspase-3 和Caspase-9 蛋白表达电泳图(A)和直条图(B)Fig.8 Eletropohregram(A) and histogram(B) of expressions of Caspase-3 and Caspase-9 proteins in myocardium tissue of rats in various groups
2.7 各组大鼠心肌组织中自噬相关蛋白Atg3、Atg5 和Atg16L1 表达水平与对照组比较,ISO 组大鼠心肌组织中 Atg3、Atg5 和 Atg16L1 蛋白表达水平升高(P<0.05);与ISO 组比较,ISO+SO2组大鼠心肌组织中Atg3、Atg5 和 Atg16L1 蛋白表达水平降低(P<0.05)。见图9。
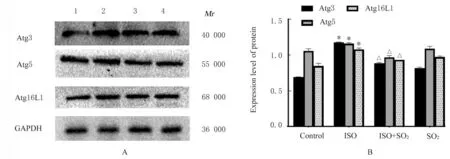
图9 各组大鼠心肌组织中Atg3、Atg5 和 Atg16L1 蛋白表达电泳图(A)和直条图(B)Fig.9 Eletropohregram(A) and histogram(B) of expressions of Atg3, Atg5, and Atg16L1 proteins in myocardium tissue of rats in various groups
3 讨 论
近年来 MI 患者的早期生存率提高较多,但心肌的急性缺血性损伤多引起严重心肌负性重构导致患者远期预后不良[9]。作为MI 后心肌重构的主要病理表现,MF 也是导致心室顺应性下降、心力衰竭和引起各种类型的心律失常的主要原因,而拮抗心肌缺血损伤后MF 可能是改善MI 患者长期预后的关键策略。SO2是一种无色但具有刺激性气味的有毒气体,近年来研究[3-4]显示:SO2在哺乳动物体内可由含硫氨基酸代谢途径内源性产生,并发现其对心血管系统疾病具有多种调节功能。ZHAO 等[10]研 究 显 示:SO2可 以 调 节 自 噬 改 善 糖尿病大鼠MF,但SO2能否通过调控细胞自噬和凋亡拮抗急性心肌缺血损伤后MF 目前尚不清楚。
注射大剂量ISO 诱发急性心肌缺血坏死是一种常用的心肌缺血动物模型构建方法,有研究[11]显示:该方法在实验动物心脏组织中所引起的病理生理学和形态学改变与人类MI 中观察到的变化较为相似。本研究以腹腔注射大剂量ISO 构建急性心肌缺血损伤大鼠模型[12],并检测大鼠心电图和血浆肌钙蛋白水平的变化。本研究结果显示:与对照组比较,腹腔注射大剂量 ISO 后,ISO 组和ISO+SO2组大鼠心电图ST 段明显抬高,血浆肌钙蛋白 T 水平升高,提示急性心肌缺血损伤大鼠模型构建成功。在给予内源性SO2连续干预4 周后, ISO 组大鼠心功能较对照组明显降低, ISO+SO2组大鼠心功能较ISO 组明显改善,提示SO2可以改善急性心肌缺血损伤后大鼠的心功能。
MF 主要由心肌细胞丢失、心肌成纤维细胞增殖活化和心肌细胞外基质(extracellular matrix,ECM)沉积过度所诱发[13],其中基质金属蛋白酶(matrix metalloproteinases,MMPs)和金属蛋白酶组织抑制物(tissue inhibitors metalloproteinases,TIMPs) 相互影响,对 ECM 的稳定进行动态调控,而心肌成纤维细胞活化在释放大量ECM 蛋白的同时还分泌MMPs,对ECM 进行分解和重塑促进纤维化的发生[14]。有研究[15-16]显示:纤维化的发展与MMPs 上调和TIMPs 下调有密切关联,含有TIMP-2 的外泌体可以抑制心肌成纤维细胞的增殖和活化。其中MMP-8 主要由中性粒细胞和巨噬细胞产生,可以有效地降解Ⅰ型、Ⅱ型和Ⅲ型胶原蛋白及蛋白聚糖和纤连蛋白等[17],TIMP-2 能抑制多 数MMPs 的 活 性[18]。本 研 究 结 果 显 示:ISO 组大鼠发生明显的MF,而SO2组大鼠MF 情况得到了改善。与对照组比较,ISO 组大鼠心肌组织中MMP-8 蛋白表达水平升高、TIMP-2 蛋白表达水平降低;与ISO 组比较,ISO+SO2组大鼠心肌组织中MMP-8 蛋白表达水平降低、TIMP-2 蛋白表达水平升高,提示SO2可以减轻ISO 诱导的急性心肌缺血损伤后的MF,且其机制可能与调节MMPs/TIMPs 比值有关。
研究[19]显示:细胞凋亡是MI 期间导致心肌细胞死亡的主要过程。心肌细胞的过度凋亡可导致心肌细胞数急剧下降,并刺激心肌成纤维细胞增殖活化、促进ECM 沉积,诱发MF;相反,有效抑制心肌细胞凋亡可以改善MF[20]。Caspase 家族在细胞凋亡中起重要作用[21],在缺血缺氧等促凋亡刺激下,心肌细胞中的Caspase 家族级联通路被激活,从而诱导细胞凋亡的发生。本研究结果显示:与对照组比较,ISO 组大鼠心肌细胞凋亡率升高、心肌组织中Caspase-3 和Caspase-9 蛋白表达水平升高;与ISO 组比较,ISO+SO2组大鼠心肌细胞凋亡率明显降低,且Caspase-3 和Caspase-9 蛋白表达水平降低,提示SO2改善急性心肌缺血损伤后MF可能与减少心肌细胞凋亡有关。
自噬是降解细胞质成分和功能失调的细胞器的重要过程,在正常生理条件下,自噬在维持心肌细胞功能和存活方面起重要作用。然而,过度的自噬可导致功能性细胞器和重要蛋白质降解,进而诱发细胞凋亡[22]。有研究[23]显示:严重的缺血缺氧等损伤应激可导致心肌细胞过度自噬,进而诱发细胞凋亡和心脏功能障碍。REN 等[24]研究显示:抑制过度自噬可以预防大鼠MI 后心功能不全和MF。本研究结果显示:与对照组比较,ISO 组大鼠心肌组织中Atg3、Atg5 和Atg16L1 蛋白表达水平升高,提示存在过度激活的细胞自噬;与ISO 组比较,ISO+SO2组 大 鼠 心 肌 组 织 中Atg3、 Atg5 和Atg16L1 蛋白表达水平明显降低,表明SO2可拮抗急性心肌缺血损伤大鼠心肌组织中的过度自噬,而SO2可能通过抑制过度自噬拮抗细胞凋亡而改善MI 后的MF。
综上所述, SO2干预后急性心肌缺血损伤大鼠MF 得到明显改善,同时心肌细胞凋亡明显减少,细胞自噬水平明显降低,表明SO2可以改善急性心肌缺血损伤后MF,其机制可能与抑制过度自噬并减少心肌细胞凋亡有关,而调控SO2气体微环境可能成为拮抗急性心肌缺血损伤后MF 的新思路和新策略。
