细胞焦亡分型和APOD 预测胃癌患者预后作用的生物信息学分析
2023-11-11崔海康张旭东李晓宁张文杰
崔海康, 张旭东, 李晓宁, 杨 希, 杨 兰,2, 张文杰,2
(1.石河子大学医学院病理系,新疆 石河子 832002;2.新疆地方与民族高发病教育部重点实验室,新疆 石河子 832002)
胃癌(gastric carcinoma,GC) 是我国常见的恶性肿瘤之一。虽然近些年我国对GC 的防治已经取得了明显的进步,GC 患者5 年生存率已从27.4% 上升到35.1%,但与日本[1](80.1%) 和韩国[2](75.4%)比较,我国GC 患者5 年生存率仍然较低。因此急需寻找有效的GC 分型和预后标志物提高我国GC 患者的生存率。焦亡作为细胞程序性死亡的一种,可以为肿瘤的生长提供适宜的微环境,促进肿瘤的发生发展[3]。因此本研究选用焦亡相关基因作为胃癌的分型依据,并对差异预后基因采用Lasso 和Cox 回归分析构建风险预后模型,探讨载脂蛋白D(apolipoprotein D,APOD)与胃癌患者的预后及临床表现的相关性。
APOD 作为脂蛋白超家族中的成员,在脂质运输、炎症、抗氧化和多种癌症的发展中起重要作用[4]。然 而 目 前 关 于APOD 与GC 关 系 的 研 究 较少,本研究基于生物信息学方法分析APOD 对GC患者预后的影响及其与GC 患者常见临床特征的相关关系,并初步探讨APOD 对GC 免疫微环境的影响以及其作为胃癌治疗新靶点的潜力。
1 资料与方法
1.1 数据收集和整理从癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库(包含32例癌旁正常组织和375 例肿瘤组织)(https://portal.gdc.cancer.gov/) 和GSE84437(包含433 例肿瘤组织)数据库(https://www.ncbi.nlm.nih.gov/geo/)中分别下载GC 患者的临床数据和相应的转录组数据,采用sva 数据包[5]进行批次矫正后,将2 个数据库中提取的数据进行合并,形成新的数据库Merge。同时下载GSE66229 数据集(包含100 例癌旁正常组织和300 例肿瘤组织)作为验证数据集。
1.2 焦亡分型和分型间的相关性分析从基因富集 分 析(Gene Set Enrichment Analysis,GSEA)官网(http://www.gsea-msigdb.org/gsea) 下载52 个焦亡相关基因,并提取Merge 数据库中所有GC 样 本 焦 亡 相 关 基 因 的 表 达, 采 用ConsensusClusterPlus 数 据 包[6]对GC 样 本 进 行 聚类分型(A 分 型 和 B 分 型), 聚 类 算 法 为k-means[7],筛选原则为分型内部相关性高,分型间相关性低。采用pheatmap 数据包绘制热图,采用survminer 和survival 数据包进行生存分析,采用ssGSEA 算法比较不同分型患者免疫浸润的差异。
1.3 不同焦亡分型样本组间差异预后基因的筛选采用limma 数据包筛选出分型之间的差异预后基因,设置过滤条件为倍数变换(fold changes,FC) 对数的绝对值|log2FC|>0.585 和矫正后P<0.05。然后将差异预后基因进行整理(对在相同样本中重复出现的基因取平均值,删除所有样品中表达量均为0 的基因)。采用survival 数据包将差异预后基因的表达量和生存数据进行合并,然后采用单因素Cox 回归分析进行循环,设置CoxP<0.05 为过滤条件。
1.4 构建GC 患者预后模型将Merge 数据库中的GC 样本进行随机分组,分为样本组(402 例)和验证组(401 例),采用glmnet 数据包进行Lasso Cox 比例风险回归(迭代次数=1 000)构建风险预后模型。风险得分=模型基因的表达量×风险系数之和,根据公式计算每个样本的风险得分,根据打分中位值将样本组划分为低和高风险组,将验证组划分为低和高风险组。
1.5 目的基因筛选将TCGA 数据库中379 例具有完整临床信息的GC 患者纳入分析,对构建模型的6 个基因进行临床性状过滤。采用TCGA 数据库、GSE66229 数据库和基于基因表达水平值的交互 式 分 析 平 台 (Gene Expression Profiling Interactive Analysis, GEPIA) (http://gepia.cancer-pku.cn/)探讨癌旁正常组织和肿瘤组织中APOD mRNA 表达水平的差异,同时采用人类蛋白图库(The Human Protein Atlas,HPA)数据库中的免疫组织化学结果进行验证。
1.6 APOD 独立预后分析和生存分析在TCGA和GSE84437 数据库中将APOD mRNA 表达水平、年龄、性别及TNM 分期等多个临床因素与总生存期进行单因素和多因素Cox 回归分析,并绘制森林图进行可视化。将GC 患者按照APOD 表达水平的中位值分为低表达组和高表达组,采用Survival 数据包绘制生存曲线。
1.7 不同 APOD mRNA 表达水平患者临床特征分析在TCGA 数据库(379 例具有完整年龄、性别、分级、Stage分期和TNM分期胃癌患者)对不同APOD mRNA 表达水平患者进行临床特征分析,并采用GSE84437(包含433 例具有完整年龄、性别、T 和N 分期胃癌患者)数据库进行验证,采用ggpubr 数据包绘制箱式图对分析结果进行可视化。
1.8 APOD 表达水平的GSEA 分析和免疫浸润分析将TCGA 数据库中的GC 样本按照APOD 表达水平的中位值分为低表达组和高表达组,采用GSEA 软件进行京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。采用CIBERSORT 反卷积算法[8]评估GC 样本中22 种免疫细胞含量,根据P<0.05 进行过滤,筛选出367 例符合条件的样本。采用ggpubr 和reshape2 数据包对免疫细胞差异结果进行可视化。采用corrplot 数据包绘制22 种免疫细胞含量相关性矩形图,绘制棒状图分析APOD 与免疫细胞含量的相关性,采用GSE84437 数据集对结果进行验证。采用TISIDB在线数据库[9](http://cis.hku.hk/TISIDB/) 分析GC 患者中APOD 与免疫激活剂、免疫抑制剂、趋化因子和受体之间的相关性。
1.9 APOD 药物敏感性分析通过GSCA 在线网站(http://bioinfo.life.hust.edu.cn/GSCA/) 中的抗癌药物敏感性基因组学(Genomics of Drug Sensitibity in Cancer,GDSC)[10]和癌症治疗反应门 户(The Cancer Therapeutics Response Portal,CTRP)数据库对APOD 进行药物敏感性分析,在TISIDB 数据库中发掘以APOD 为治疗靶点的药物。
1.10 统计学分析采用R 统计软件(4.2.0 版本)和SPSS 27.0 统计软件进行统计学分析。细胞焦亡分型在胃GC 患者分布中的差异比较采用χ2检验。TCGA 和GEO 数据库中APOD mRNA 表达水平不符合正态分布,肿瘤组织和癌旁正常组织中APOD mRNA 表达水平比较采用Wilcoxon 秩和检验;APOD mRNA 表达水平与患者临床特征的相关性分析采用Wilcoxon 和Kruskal-Wallis 秩和检验;生存分析采用Kaplan-Meier 方法(Log-rank 检验);采用受试者工作特征曲线(receiver operating characteristic curve,ROC) 数据包绘制ROC 曲线评估患者预后模型的准确性;采用Spearman 相关分析探讨APOD 与免疫因子表达之间的相关性。以P<0.05 为差异有统计学意义。
2 结 果
2.1 焦亡分型和分型间的相关性分析结果按照聚类分型原则将Merge 数据库中的GC 样本分为A 分型(342 例)和B 分型(465 例)(图1A)。焦亡分型相关分析结果显示:A 分型中焦亡相关基因表达水平高于B 分型(图1B);生存曲线显示:A 分 型GC 患 者 预 后 更 好(P=0.02,图1C);A 分型中激活B 淋巴细胞、激活CD4+T 淋巴细胞和激活CD8+T 淋巴细胞等22 种免疫细胞均高于B 分型(P<0.01,图1D)。焦亡分型在胃癌中的差异分布结果显示:不同年龄(P<0.01)和N 分期(P=0.04) GC 患者A 分型和B 分型百分率比较差异有统计学意义。见表1。

表1 不同临床病理特征GC 患者细胞焦亡分型的分布Tab.1 Distributions of subtypes of pyroptosis in GC patients with different clinicopathological characteristics

图1 2 种焦亡分型的差异分析Fig.1 Differential analysis on two subtypes of cell pyroptosis
2.2 预后模型的构建采用Lasso 回归和Cox 回归对A 和B 分型的差异预后基因构建GC 风险预后模型, 参与构建模型的基因有载脂蛋白D(apolipoprotein D,APOD)、细胞程序性死亡蛋白1(programmed cell death 1,PDCD1)、葡萄糖转运体3(solute carrier family 2 member 3,SLC2A3)、转谷氨酰胺酶2(transglutaminase 2,TGM2)、角蛋 白 7 (keratin 7, KRT7) 和 印 记 基 因 10(paternally expressed gene 10,PEG10)。生存曲线结果显示:高风险组GC 患者预后较差(P<0.01,图2A)。ROC 曲线结果显示:验证组患者预测第1、3 和5 年生存率的ROC 曲线下面积(area under curve,AUC) 为0.634、0.666 及0.674,样本组患者预测第1、3 和5 年生存率的AUC 为0.635、0.625 及0.637(图2B)。表明该模型可以用来评估GC 患者预后水平,并且具有一定的可靠性。
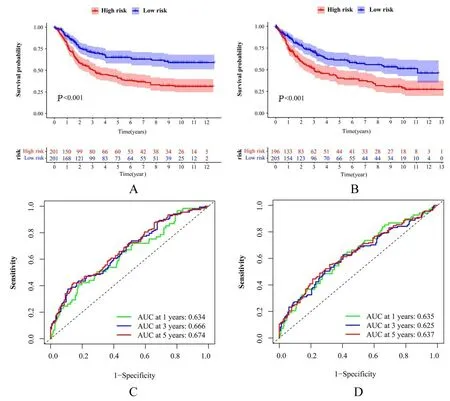
图2 GC 患者的Kaplan-Meier 曲线和ROC 曲线Fig.2 Kaplan-Meier curve and ROC curve of GC patients
2.3 APOD mRNA 表达水平与GC 患者临床特征的关联性本研究在TCGA 数据库中对预后模型基因进行临床相关性过滤,结果显示:APOD 是与GC 患者临床性状联系最为紧密的基因(表2)。TCGA 数 据 库、GSE66229 数 据 集 和GEPIA 检 索结果显示:GC 组织中APOD mRNA 表达水平低于癌旁正常组织(P<0.05),见图3。由于GC 患者肿瘤组织和癌旁正常组织中APOD mRNA 表达水平有差异,因此本研究将其作为目的基因进行后续分析。
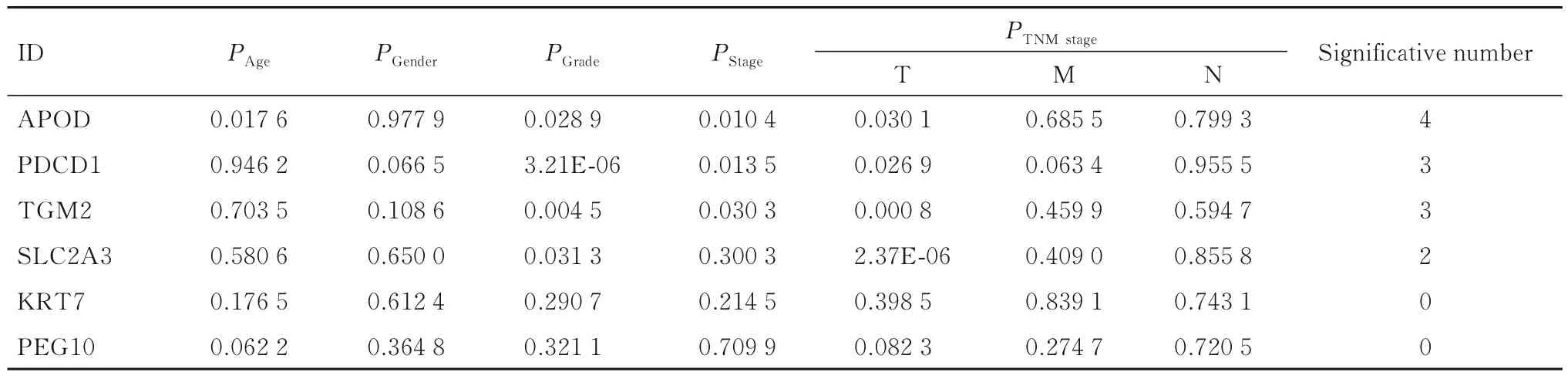
表2 与GC 患者临床特征有关联的基因Tab.2 Genes related to clinical characteristics of GC patients
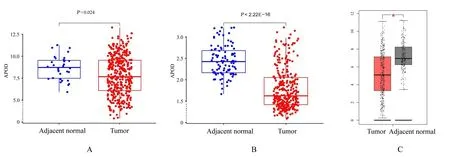
图3 癌旁正常组织和肿瘤组织中APOD 表达水平的差异性分析Fig.3 Differential analysis on expression levels of APOD in adjacent normal tissue and GC tissue
2.4 GC 患者预后的生物标志物TCGA 数据库中单因素Cox 回归分析结果显示:年龄、Stage 分期、T 分期、N 分期、APOD 与GC 患者的生存有关联。多因素Cox 回归分析结果显示:年龄和APOD 是影响GC 患者生存的独立因素。GEO 数据库中单因素和多因素Cox 回归分析结果显示APOD能够独立影响GC 患者生存。为了进一步探讨APOD 对GC 患者预后的影响,本研究将GC 组织样本按照APOD 表达水平的中位值分为APOD 低表达组和APOD 高表达组,分别进行生存分析,结果显示:APOD 高表达不利于GC 患者的预后(P<0.05)。见图4。

图4 APOD 表达与GC 患者预后的关系Fig.4 Relationship between APOD expression and prognosis of GC patients
2.5 APOD 表达水平与GC 患者临床特征的关系TCGA 数据库中,不同年龄、性别、Stage 分期和T 分期患者的APOD 表达水平比较差异有统计学意义(P<0.05),且APOD 表达水平随着T 分期的增高而增长。GEO 数据库中,T2 和T3组、T2 和T4 组、N0 和N2 组患者APOD 表达水平比较差异有统计学意义(P<0.05),在T2~T4 组,随着T 分期的增长,患者APOD 表达水平升高。见图5。

图5 APOD 表达水平与GC 患者临床特征的关系Fig.5 Correlation between expression levels of APOD and clinical characteristics of GC patients
2.6 APOD 表达对免疫等通路中的调控作用本研究将TCGA 数据库中的GC 组织样本按照APOD表达水平分为APOD 低表达组和APOD 高表达组,分别进行GSEA 分析,采用GSE84437 数据集对结果进行验证。GSEA 分析结果显示:2 个数据库中APOD 高表达组均在免疫相关通路(细胞黏附通路和白细胞内皮迁移通路) 和缝隙连通路中富集,APOD 低表达组均在DNA 复制、错配修复及碱基切除修复通路中富集。见图6。

图6 APOD 低表达组和APOD 高表达组的GSEA 分析Fig.6 GSEA analysis on APOD low expression group and APOD high expression group
2.7 APOD 表达与 GC 免疫微环境的关系在TCGA 数据库和GSE84437 数据集中探讨了APOD低表达组和APOD 高表达组之间免疫细胞含量的差异。APOD 高表达组中幼稚B 淋巴细胞、单核细胞、树突状细胞静息和静息肥大细胞含量较为丰富,而滤泡辅助细胞、CD4+记忆激活T 淋巴细胞、静息NK 细胞和中性粒细胞含量相对较少。免疫细胞相关性分析结果显示:CD4+记忆静息T 淋巴细胞和CD8+T 淋巴细胞含量呈负相关关系,激活肥大细胞和静息肥大细胞含量呈负相关关系。APOD 与滤泡辅助细胞、CD4+记忆激活T 淋巴细胞、静息NK 细胞和中性粒细胞含量呈负相关关系。TISDB 分析结果显示:APOD 在GC 组织中和免疫刺激剂CXC 趋化因子配体12(CXC chemokine ligand 12,CXCL12)(r=0.500,P<0.01)、免疫抑制剂转化生长因子B1(transforming growth factor beta 1,TGFB1)(r=0.313,P<0.01)、趋化因子CC 趋 化 因 子 配 体 19(CC chemokine ligand 19,CCL19)(r=0.518,P<0.01)和受体CX3C 趋化因子受体1(CX3C chemokine receptor 1,CX3CR1)(r=0.444,P<0.01)呈正相关关系。见图7。

图7 APOD 表达与 GC 免疫微环境的关系Fig.7 Relationship between APOD expression and GC immune microenvironment
2.8 GDSC 数据库药物敏感性分析结果GDSC数据库药物敏感性分析结果显示:APOD 与抗肿瘤药物达拉非尼,B-Raf 抑制剂PLX4720、SB590885呈负相关关系(-0.4 图8 APOD 药物敏感性分析Fig.8 Drug sensitivity analysis on APOD 早期GC 起病隐匿,不易被发现,一旦确诊基本已经进入晚期,患者将会错过最佳治疗期。即使后期接受手术治疗,其5 年生存率仍低于30%[11]。鉴于晚期GC 患者手术治疗效果较差,本研究旨在寻找新的GC 分型和生物学标志物以实现对GC 的早期诊断和早期治疗, 从而提高GC 患者的生存率。 细胞焦亡是一种由 Gasdermin(GSDM)家族蛋白进行诱导的程序性细胞死亡,在神经退行性变[12]、动 脉 粥 样 硬 化[13]和 癌 症[14]等 疾 病 中 发 挥重要作用。在癌症组织中,细胞焦亡可以促进炎性细胞的死亡,抑制癌细胞的增殖和迁移。本研究采用细胞焦亡相关基因将GC 患者分为A 和B 2 种分型,相关分析结果显示:A 分型患者细胞焦亡相关基因的表达水平较高,且预后更好;A 分型患者中22 种免疫细胞含量均高于B 分型。目前已有相关报道显示:依据细胞焦亡相关基因可以对乳腺癌[15]、膀胱癌[16]和结肠癌[17]等患者进行分型,并且根据分型可对患者进行预后评估,细胞焦亡相关基因的表达影响癌症患者的肿瘤微环境,这与本研究结论一致。 本研究采用Lasso 回归和Cox 回归分析构建风险预后模型,并对参与构建模型的基因进行临床相关性过滤,筛选出联系最为紧密的APOD 基因进行后续分析。APOD 是一种多功能蛋白,在不同组织中其表达水平对预后的影响有差异。乳腺癌组织[18]中APOD 蛋白表达水平低于癌旁正常组织,APOD 高表达对患者预后有利。在结肠癌组织[19]中APOD 蛋白表达水平低于癌旁正常组织,而APOD 高表达却不利于患者预后。本研究结果显示:在GC 患者肿瘤组织中APOD 蛋白表达水平低于癌旁正常组织,并且APOD 高表达不利于GC 患者预后。此外本文作者发现:APOD 可以独立对GC 患者进行预后评估,APOD 蛋白表达水平还会随着T 分期的增高而升高,因此认为APOD 具有成为GC 预后标志物的潜力。 APOD 高表达组在细胞黏附和白细胞内皮迁移等免疫通路及缝隙连接通路中富集。细胞黏附在癌症进展中起到非常重要的作用,被认为是肿瘤免疫逃逸和转移性扩散的标志。细胞黏附分子常通过糖基化的改变,影响癌细胞和细胞外基质蛋白之间的相互作用[20]。白细胞在参与炎症反应时会通过阿米巴运动的方式穿过紧密相连的内皮细胞,通过间质 组 织 进 行 迁 移[21]。缝 隙 连 接(gap junction,GJ) 是一种连接2 个相邻细胞通道构成的膜结构,相邻细胞通过GJ 可以进行信息、能量和物质等交换,并且GJ 对细胞新陈代谢、内环境稳定及增殖分化等起重要调控作用[22]。APOD 可能是通过调控这些通路影响GC 浸润深度,进而影响GC 的发展,导致患者预后较差。 肿瘤微环境(tumor microenvironment,TME)与肿瘤发展关系密切,肿瘤细胞增殖常会导致TME 发生相应重构,TME 又在影响患者预后和抗癌疗效等方面具有较大优势,因此目前人们越来越重视TME 的靶向治疗[23]。本研究结果显示:APOD 高表达组中滤泡辅助T 淋巴细胞、CD4+记忆激活T 淋巴细胞、静息NK 细胞和中性粒细胞含量较低,并且APOD 蛋白表达水平与上述4 种免疫细胞的丰度呈负相关关系。而这4 种免疫细胞在肿瘤的发展中起抵抗作用,滤泡辅助T 淋巴细胞属于辅 助B 细 胞 的CD4+T 淋 巴 细 胞 亚 群[24],有 研究[25]显示:在乳腺癌和结肠癌患者中,滤泡辅助T 淋巴细胞相关的细胞越少,患者预后越差,也有研究[26]显示:滤泡辅助T 淋巴细胞缺失会导致CD8+T 淋巴细胞功能障碍。NK 细胞作为一种可以参与抗击肿瘤的天然免疫细胞,不依赖抗原呈递细胞(antigen-presenting cells,APCs)的刺激也可以直接杀伤肿瘤细胞,与肿瘤相互作用后,NK 细胞可以杀死其靶点并分泌细胞因子、肿瘤坏死因子α 和生长因子[27]。 CD4+记忆T 淋巴细胞是TME 的重要组成部分,影响肿瘤的发生发展,有研究[28]显示在GC中高丰度CD4+记忆T 淋巴细胞的患者预后较好。中性粒细胞作为人体最主要的免疫细胞之一,具有免疫防御作用,可以抵抗细菌、真菌和病毒的侵袭,清除凋亡细胞有利于受损组织血管再生[29]。鉴于上述免疫细胞的肿瘤抵抗性,本文作者认为是APOD 表达降低了4 种免疫细胞的丰度,从而导致GC 患者预后较差。 本研究结果显示:APOD 表达与CXCL12、TGFB1、CCL19 和CX3CR1 表达呈正相关关系。CXCL12 是一种内稳态趋化因子,在自身免疫炎症反应中扮演抗炎趋化因子的作用,在癌细胞中可以促进血管生成,调节肿瘤细胞凋亡。研究[30]显示:CXCL12 在卵巢癌、小细胞肺癌、胰腺癌和前列腺癌等癌症中可以刺激肿瘤细胞增殖。TGF-B1 作为一种免疫抑制剂,可以通过抑制T 淋巴细胞中白细胞介素2(interlukin-2,IL-2) 的表达和许多关键调节因子的分泌来抑制T 淋巴细胞的生长。在肿瘤细胞中TGF-B1 可以在恶性转化后期促进上皮细胞间充质转化和转移[31]。CCL19 是一种稳态趋化因子,在肿瘤细胞中可以诱导肿瘤异质性,抑制细胞凋亡,促进肿瘤细胞的转移[32]。CX3CR1 作为趋化因子受体家族中的一员,与其配体形成的CX3CR1-CX3CL1 轴可以诱导具有促进肿瘤活性的免疫细胞的增殖、迁移、侵袭和黏附,从而导致肿瘤的发生发展[33]。本文作者认为:APOD 有可能通过调控上述免疫相关分子,促进GC 发展,导致患者预后较差。 药物敏感性分析结果显示:APOD 和细胞周期检 测 点 激 酶(checkpoint kinase, Chk) 抑 制 剂AZD-7762、多重激酶抑制剂KW-2449 和JAK2 抑制剂TG-101348 呈正相关关系。有研究[34]显示:Chk 抑制剂在治疗肺癌时已经取得了显著成效,其通过诱导细胞凋亡,阻滞细胞周期的方式,可以逆转因细胞周期失调而引起的获得性耐药。多靶点激酶抑制剂可以同时阻断多个细胞生长的信号传导通路,目前已经成为肿瘤新药研发的重点[35]。JAK2抑制剂也对部分存在JAK2 信号通路异常的实体肿瘤具有一定疗效,可以在一定程度上减慢肿瘤生长[36]。 本研究结果显示:依据细胞焦亡分型可以很好地对GC 患者的预后进行评估,且APOD 有可能成为GC 新的预后标志物。临床医生在对GC 患者进行诊疗时可以采用细胞焦亡分型,同时应重视APOD 蛋白表达水平。但是APOD 在GC 中的调节机制仍需进一步研究,其对GC 预后水平的评估作用也需要在临床中进一步验证。
3 讨 论
