小鼠各期卵母细胞中SGK3 mRNA 和蛋白的动态表达及其亚细胞定位
2023-11-11何文宁冯少青庞海垚
何文宁, 冯少青, 庞海垚, 孟 峻
(1.内蒙古医科大学临床检验诊断教研室,内蒙古 呼和浩特 010059;2.内蒙古医科大学附属医院检验科,内蒙古 呼和浩特 010050)
血清和糖皮质激素诱导蛋白激酶(serum and glucocorticoid-inducible protein kinase,SGK) 是 一种Ser/Thr 双重特异性蛋白激酶,与蛋白激酶B(protein kinase B,Akt)等第二信使蛋白具有极高同 源 性, 且 均 受 磷 脂 酰 肌 醇 -3- 激 酶(phosphatidylinositol-3-kinase,PI3K)/磷酸肌醇依赖 性 蛋 白 激 酶 1 (phosphoinositide dependent protein kinase 1,PDK1)信号通路的调控,广泛参与真核细胞中基因快速转录调节和细胞内定位调节[1-3]。在海星卵母细胞中,SGK 可使细胞分裂周期 因 子25 (cell division cycle protein 25,Cdc25)和髓磷脂转录因子1 (myelin transcription factor 1,MYT1) 磷酸化, 从而诱导细胞周期蛋白B(Cyclin B,Cdc2) 去磷酸化和激活,导致减数分裂G2/M 期转换[4]。哺乳动物细胞中存在SGK1、SGK2 和SGK3 亚型。其中SGK3 不同于其他2 种SGK 亚型和Akt 家族:其在N 端有1 个Phox(PX)结构域,该结构域对其蛋白激酶活性非常重要,并负责将SGK3 靶向于囊泡样结构和内体隔室[5-6]。TESSIER 等[7]研 究 显 示:在 小 鼠 卵 母 细胞中,SGK3 在核内体的特异性定位是其激活的关键,而SGK3 在核内体的定位依赖于其PX 结构域和一种Ⅱ类PI3K 酶 (PI3K-C2α)的存在,而不依赖于Ⅰ型PI3K 酶活性,且SGK3 和PDK1 在膜上的共定位不足以触发SGK3 的磷酸化和激活。另外,与磷酸化后的Akt 不同,SGK3 一旦被激活就会留在细胞核内,而Akt 的活化部位在浆膜,活化后转位至细胞质和细胞核[8-9]。DONG 等[10]研究显示:SGK3 表达缺失会导致足细胞功能障碍和蛋白尿,且在阿霉素肾炎小鼠模型中,SGK3 表达下调与蛋白尿的严重程度呈负相关关系。在非洲爪蛙卵母细胞中,SGK3 可通过增加肾上皮细胞膜上钙通路瞬时受体电位V 型5/6 (transient receptor potential vanilloid 5/6,TRPV5/6) 的数量而参与肾脏对钙的重吸收,维持钙的动态平衡[11]。研究[9]显示:SGK3 广泛地参与调控细胞增殖、存活、应急和离子转运等多种生物学过程,目前已经成为国内外研究热点。但关于小鼠卵母细胞是否存在SGK3 蛋白激酶、SGK3 和Cdc25B 蛋白在卵母细胞发育中的作用及SGK3 能否直接或间接激活Cdc2 尚不清楚。本研究以小鼠卵母细胞为研究对象,观察小鼠卵母细胞中SGK3 蛋白激酶的表达水平和亚细胞定位情况,为哺乳动物卵母细胞早期生长发育的机制研究提供依据。
1 材料与方法
1.1 实验动物、主要试剂和仪器3~4 周SPF 级昆明系雌鼠购自内蒙古医科大学实验动物中心,动物使用许可证号:SYXK (蒙) 2015-0001。体质量17~20 g。孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)和人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)(苏州素仕公司),M16 培养液、MB 培养基和M2 培养液(美国Invitrogen 公司),SGK3 引物和β-actin 引物由安徽通用生物系统有限公司合成,总RNA 极速抽提试剂盒(上海飞捷生物技术公司),反转录试剂盒和实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 试剂盒(北京全式金生物技术公司),SGK3 抗体和β-actin 抗体(美国SantaCruzbio technology 公司),SDS-PAGE 凝胶快速配制试剂盒和预染蛋白Marker (美国Thermo Fisher 公司),细胞裂解液和Hoechst33258染色液(广州碧云天生物技术公司),Alexa Fluor 488 标记的驴抗山羊IgG (H+L) (货号:705-545-147) 和Alexa Fluor 594 标 记 的 驴 抗 兔IgG(H+L)(货 号: 705-585-152)(美 国Jackson ImmunoResearch 公司),SGK3 抗体(山羊抗兔)(货号:ab150080)和β-actin 抗体(货号:ab6276)(美国Abcam 公司), 增强型化学发光试剂(enhanced chemiluminescence,ECL)(美国Piece Biotechnology 公司)。台式高速离心机(型号:LG16-WA,北京京立公司),高速微量冷冻离心机(型 号: AHCL-FZSW-LXJ-003, 美 国 Thermo Fisher 公司),CO2恒温培养箱(德国Binder 公司),激光共聚焦扫描显微镜(德国Leica公司),HR30-Ⅱ级A2 型生物安全柜(青岛海尔生物医疗股份有限公司),紫外-可见分光光度计(型号:Nano Drop 2000c,美国Thermo Fisher 公司),相差显微镜(日本奥林巴斯公司), RT-qPCR 仪(型号:CFX96,美国Bio-Rad 公司),垂直玻璃板和转膜槽(北京六一生物科技公司),纯水机(广州天创公司)。
1.2 小鼠卵母细胞的采集和培养取3~4 周龄的SPF 级昆明级雌性小鼠,在明暗交替环境下喂养3~4 d。于当天13:00 小鼠腹腔内注射PMSG(10 IU/只),48 h 后脱颈处死小鼠,剖开腹腔,取出卵巢置于含M2 培养液的平皿上。在体视显微镜下撕开卵巢,自然流出卵母细胞团,采用MB 培养液反复吹洗3 次以上去除颗粒细胞,清洗完成即得到完整的生发泡(germinal vesicle,GV)期裸卵母细胞,计数收集100 个细胞备用。将收集的GV 期裸卵母细胞移至已预平衡的MB 培养液中,表面覆盖石蜡油,放入培养条件为37 ℃、体积分数为5%、湿度为100%的CO2培养箱中进行体外培养。根据细胞培养时间和卵母细胞的形态表现区分细胞培养程度: ①生发泡破裂(germinal vesicle breakdown, GVBD) 期卵母细胞。GV 期卵母细胞培养3~4 h 后可获得;②第1 次减数分裂 (first meiotic metaphase,M Ⅰ) 期卵母细胞。GV 期卵母细胞培养6~7 h 后可获得;③第2 次减数分裂(second meiotic metaphase,MⅡ)期卵母细胞。
每只小鼠腹腔内注射10 IU PMSG,48 h 后注射10 IU HCG,15~16 h 处死小鼠,取出两侧输卵管,镜下剖开输卵管壶腹部自然流出卵团,充分清洗后即可获得MⅡ期卵母细胞。
1.3 RT-qPCR 法检测卵母细胞中SGK3 mRNA 表达水平取GV、GVBD、MⅠ和MⅡ期收集到的卵母细胞各100 个,参照总RNA 极速抽提试剂盒说明书提取各期细胞中mRNA,采用微量紫外分光光度计检测4 期卵母细胞中mRNA 的吸光度(A)值,若A(260)/A(280)比值在1.8~2.0,说明所提取的mRNA 纯度较高、蛋白质污染较少,可用作逆转录实验。经测定本实验中获取的各期卵母细胞中mRNA 的A(260)/A(280) 比值均在1.8~2.0,显示mRNA 纯度较高,可用于后期逆转录PCR 实验。采用逆转录试剂盒进行反转录,反应体系为20 μL,反应条件:42 ℃、15 min,85 ℃、5 s。根据试剂盒说明书进行RT-qPCR 反应,引物序列:SGK3(NM_001037759.1),正向引 物5'-TCCCAGCTCTGACGAACACA-3' 和 反向引物5'-TCAAACTCTGCGTATCTCCTGA-3';β-actin(NM:007393.5),正向引物5'-GTGACGTTGACATCCGTAAAGA-3' 和 反 向 引 物5'-GCCGGACTCATCGTACTCC-3'。 PCR 反 应体系为20 μL,反应条件:94 ℃、30 s,94 ℃、5 s,60 ℃、15 s,45 个循环;95 ℃、15 s,56 ℃、30 s,95 ℃、15 s,1 个循环。采用2-△△Ct法计算细胞中SGK3 mRNA 表达水平。
1.4 Western blotting 法检测小鼠卵母细胞中SGK3 蛋白表达水平分别收集GV、 GVBD、MⅠ和MⅡ期小鼠卵母细胞各200 个。离心机4 ℃、3 000 r·min-1离 心10 min,弃 上 清。加 入50 μL RIPA 蛋白裂解液,反复冻融3 次,每次10 min,使所有卵母细胞完全裂解,离心机4 ℃预冷,12 000 r·min-1离心裂解卵母细胞10 min,弃上清,加入160 μL 细胞裂解液和40 μL 5×loading buffer,100 ℃水浴5~10 min 使蛋白变性,保存于-20 ℃备用。上样并进行SDS-PAGE 电泳。将蛋白质转至0.45 μm 硝酸纤维素 (nitrocellulose,NC) 膜上。采用去离子水清洗NC 膜,剪出内参蛋白条带和检测蛋白条带,将膜移至盛有封闭液的平皿中,室温下放置摇床上封闭60 min,TBST 缓冲液清洗3 次,每次10 min。将膜条移入含有SGK3 抗体稀释液(稀释倍数为1∶1 000)中4 ℃孵育过夜,次日室温下TBST 溶液清洗3 次,每次5 min。将膜条移入含有HRP 偶联的羊抗兔IgG 二抗的稀释封闭液中室温孵育2 h。将膜条置于按照Western blotting 试剂盒中的A、B 液按照1∶1 比例配制的混合液中,进行后续的化学发光显影成像。SGK3蛋白表达水平=SGK3 蛋白条带灰度值/β-actin 条带灰度值。
1.5 Western blotting 法检测SGK3 底物磷酸化情况收集GV、GVBD 和MⅠ不同时期卵母细胞各200 个,经胚胎裂解、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecy sulfate-polyacrylamide gel electrophoregram, SDS-PAGE)、转移置NC膜 上, 分 别 采 用 phospho-Cdc25B-pSer30 和nonphospho-Cdc25B-Ser30 抗体检测Cdc25B-Ser30的磷酸化状态和非磷酸化状态,采用ECL 法检测SGK 底物磷酸化状态。
1.6 细胞免疫荧光观察小鼠卵母细胞中SGK3 的亚细胞定位将培养得到GV、GVBD、MⅠ和M Ⅱ期的卵母细胞分别采用含1%牛血清白蛋白(bovine serum albumin,BSA) 的 磷 酸 盐 缓 冲 液(phosphate buffer saline,PBS) 洗 涤3 次,每次3 min。室温下4%多聚甲醛溶液固定30 min,磷酸盐吐温缓冲液(phosphate buffered saline with Tween 20,PBST)(即PBS 缓冲液中加入0.01%Tween20)洗涤3 次,每次5 min。在0.1% Triton X-100(溶解于PBS 缓冲液中配制而成) 中打孔10 min,PBST 洗液洗涤3 次,每次3 min,室温下在含5%BSA 的PBS 缓冲液中封闭40 min。转入SGK3 抗体中4 ℃孵育过夜(SGK3 抗体∶封闭液=1∶1 000稀释)。次日上午采用0.01 mol PBS 缓冲液洗涤3 次,每次5 min。然后加入四甲基罗丹明异硫 氰 酸 酯 (tetramethylrhodamine isothiocyana,TRITC)标记的IgG(稀释比为1∶500),避光室温孵育1 h。PBST 洗液洗涤3 次,每次5 min。Hoechst33258(终浓度为20 mg·L-1) 荧光染料染色30 min,使核酸着色,在激光共聚焦扫描显微镜下分别于530、488 和260 nm 激发波长处观察各期卵母细胞中SGK3 的亚细胞定位及核酸染色情况。
1.7 统计学分析采用GraphPad Prism 9.0 统计软件进行统计学分析。不同细胞周期小鼠卵母细胞中SGK3 mRNA 和蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 小鼠卵母细胞中SGK3 mRNA 表达水平在GV、GVBD、M Ⅰ和M Ⅱ期,卵母细胞中均有SGK3 mRNA 表达,表达水平分别为1.00±0.02、2.96±0.09、0.79±0.08 和6.94±0.09。与GV 期比较,GVBD 和M Ⅱ期卵母细胞中SGK3 mRNA表达水平升高(P<0.01);与GVBD 期 比 较,M Ⅰ期卵母细胞中SGK3 mRNA 表达水平降低(P<0.01),MⅡ期卵母细胞中SGK3 mRNA 表达水平升高(P<0.01);与MⅠ期比较,MⅡ期卵母细胞中SGK3 mRNA 表达水平升高(P<0.01)。
2.2 小鼠卵母细胞中SGK3 蛋白表达水平Western blotting 法检测结果显示:在小鼠各期卵母细胞中均有SGK3 蛋白表达,且表达趋势与其mRNA 表达趋势大致相同。与GV 期比较,GVBD和M Ⅱ期卵母细胞中SGK3 蛋白表达水平升高(P<0.01);与GVBD 期比较,MⅠ期卵母细胞中SGK3 蛋白表达水平降低 (P<0.01),MⅡ期卵母细胞中SGK3 蛋白表达水平升高 (P<0.01);与MⅠ期比较,MⅡ期卵母细胞中SGK3 蛋白表达水平升高(P<0.01)。见图1。
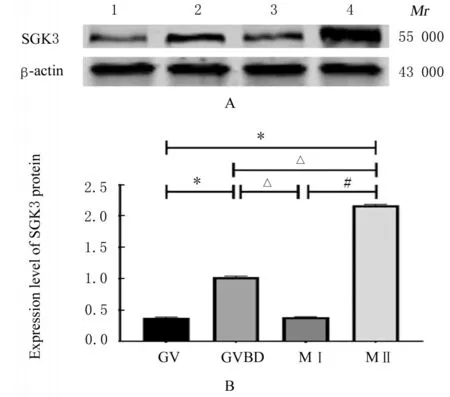
图1 小鼠各期卵母细胞中SGK3 蛋白表达电泳图(A)和直条图(B)Fig.1 Electrophoregram(A) and histogram(B) of expressions of SGK3 protein in oocytes of mice at different stages
2.3 SGK3 底物磷酸化状态Western blotting 法检测结果显示:在GV 期观测到非磷酸化Cdc25BSer30 条带,在GVBDHE MⅠ期可见明显的磷酸化Cdc25B-Ser30 条带。见图2。

图2 小鼠各期卵母细胞中磷酸化和非磷酸化Cdc25B-Ser30 表达电泳图Fig.2 Electrophoregram of expressions of phosphorylated and non-phosphorylated Cdc25BSer30 in oocytes of mice at different stages
2.4 在小鼠各期卵母细胞中SGK3 亚细胞定位情况免疫荧光法检测结果显示:SGK3 (红色荧光)在GV 期小鼠卵母细胞中定位于细胞核膜,在GVBD 期前进入细胞核,在GVBD 期定位于细胞核,MⅠ期分布于整个细胞,在MⅡ期从细胞浆进入细胞核。见图3。

图3 免疫荧光法检测小鼠各期卵母细胞中SGK3 蛋白亚细胞定位情况 (Bar=20 μm)Fig.3 Subcellular localization of SGK3 protein in oocytes of mice at different stages detected by immunofluorescence(Bar=20 μm)
3 讨 论
GV 期和MⅡ期是小鼠卵母细胞发育成熟过程中必须经历的2 个停滞期,在生殖周期中,部分卵母细胞在激素作用下恢复第一次减数分裂,其标志是GVBD 期,伴随着核质的成熟,卵母细胞发育到M Ⅱ期,排卵、进入输卵管,成为可受精的卵[10-11]。因此,如何超越GV 期阻滞,使卵母细胞恢复减数分裂,发生G2/M 期转变对卵母细胞发育成熟至关重要[12]。
研究[1]显示:当细胞暴露于血清或糖皮质激素,或者同时暴露于二者时,SGK mRNA 表达水平在30 min 内快速升高。目前通过对小鼠、海星和非洲爪蟾等真核生物的研究,证实了SGK3 是细胞磷酸化级联反应的中心节点,具有调控细胞周期、细胞增殖、细胞凋亡和离子通道等功能[13-15]。细胞周期中分子蛋白表达水平改变是一种重要的细胞调控方式,研究小鼠卵母细胞中SGK3 表达和定位有助于了解其在G2/M 过渡期中的作用。SGK3在小鼠卵母细胞早期发育过程中的表达和亚细胞定位目前国内外尚无相关报道。本实验从mRNA 和蛋白水平证实了小鼠卵母细胞中存在SGK3 蛋白激酶,即小鼠各期卵母细胞中SGK3 mRNA 均有表达,且表达水平不同,GV 期至GVBD 期SGK3 mRNA 表达水平升高,MⅠ期SGK3 mRNA 表达水平明显降低且低于GV 期,而M Ⅱ期SGK3 mRNA 表达水平骤然升高,并达到峰值,各期卵母细胞中SGK3 蛋白表达水平趋势与mRNA 表达水平趋势基本一致,SGK3 蛋白主要在卵母细胞的GVBD 期和M Ⅱ期表达。在GV 期可见非磷酸化Cdc25B-Ser30 条带,而在GVBD 期和MⅠ期可见明显磷酸化的Cdc25B-Ser30 条带。MⅠ期细胞的恢复是细胞发育、生长和增殖的重要节点,GVBD 期细胞中SGK3 蛋白表达水平升高表明其可能参与调控小鼠MⅠ期卵母细胞的恢复,进而实现G2/M 过渡期的转换。
在减数分裂过程中,SGK3 蛋白定位的动态变化与其功能密切相关,间接免疫荧光实验检测结果显示:SGK3 在小鼠卵母细胞的GV 期定位于细胞质,而在GVBD 期前入核,GVBD 期和MⅠ期定位于整个细胞,在MⅡ期由细胞浆进入细胞核。表明SGK3 可能是通过在细胞核浆穿梭而实现G2/M 过渡期的转换,猜测SGK3 可能参与了CyclinB-Cdc2激活。近年来研究[16-21]表明:SGK3 蛋白在多种肿瘤组织中表达水平较高,在骨肉瘤、肾细胞癌和鼻咽癌等肿瘤的发生发展中起重要作用,并且与肿瘤细胞的迁移和侵袭呈正相关关系,可作为多种肿瘤的潜在标志物和治疗靶点。未来研究的重点是确定PI3K-SGK3 信号通路是否参与了Cdc2 的激活。对SGK3 蛋白在小鼠卵母细胞分裂恢复中作用机制的研究,将为哺乳动物卵母细胞早期发育机制的研究提供依据。
