FOXP3 调控非小细胞肺癌A549 细胞对阿霉素敏感性的作用及其机制
2023-11-11盖晓东王鹤霏何程远王星翔
盖晓东, 赵 颖, 王鹤霏, 何程远, 王星翔, 历 春
(1.北华大学基础医学院免疫学教研室,吉林 吉林 132013;2.吉林大学第一医院肿瘤妇科,吉林 长春 130021)
肺癌是世界上发病率和死亡率最高的恶性肿瘤,其中非小细胞肺癌(non small-cell lung cancer,NSCLC)约占肺癌的85%[1-2]。临床上,化疗是治疗NSCLC 的重要手段之一,但肿瘤细胞对化疗药物产生的耐药性是影响疗效和患者预后的主要因素[3]。因此,降低肿瘤的耐药性和提高化疗效果是肿瘤治疗领域的研究热点。叉头蛋白3(forkhead box protein 3, FOXP3) 是叉头蛋白家族成员之一, 是 调 节 性 T 淋 巴 细 胞 (regulatory T lymphocytes,Tregs)的关键转录因子,通过发挥免疫抑制功能参与机体的免疫耐受和肿瘤逃逸[4]。研究[5-7]显示:FOXP3 在肺癌等多种肿瘤细胞中均有表达,其表达水平与肿瘤的侵袭、转移和患者的不良预后关系密切。本课题组前期研究[8-11]显示:FOXP3 高表达不仅促进NSCLC 细胞增殖、侵袭和转移,还可通过降低NSCLC 细胞对顺铂和5-氟尿嘧啶等化疗药物的敏感性促进肿瘤耐药,但其参与化疗耐药的调控机制尚未明确。
Notch1 信号通路是一个高度保守的信号转导通路,可调控细胞的增殖、分化和凋亡等功能。Hes1 是Notch1 信号通路下游的重要分子靶点,该通路的异常激活与肺癌等肿瘤细胞的增殖、侵袭和耐 药 关 系 密 切[12-13]。研 究[14]显 示:30% NSCLC患者出现Notch1 信号通路异常活化。本课题组前期研究[15]显示:Notch1 信号通路可促进NSCLC细胞上皮间质转化和增强顺铂的化疗抵抗作用。目前,Notch1/Hes1 信号通路与FOXP3 介导的耐药作用之间的关系尚不清楚。本研究以阿霉素(doxorubicin, Dox) 作为代表性化疗药,以γ-分泌酶抑制剂DAPT 作为Notch1/Hes1 信号通路抑制剂, 采 用 小 干 扰RNA (small interfering RNA,siRNA) 方法沉默人NSCLC A549 细胞中FOXP3表达,观察FOXP3 对Dox 敏感性的变化及其通过Notch1/Hes1 信号通路参与Dox 耐药的机制,为提高NSCLC 患者的化疗效果提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器人NSCLC A549 细胞由北华大学分子医学重点实验室保存。DMEM培养基购自上海中乔新舟生物公司,胎牛血清购自浙江天杭生物公司,FOXP3 siRNA 序列及阴性对照序列由广州锐博生物公司合成,LipofectamineTM2000 试剂盒购自美国Thermo Fisher Scientific 公司,Dox 购自浙江海正药业,FOXP3 抗体购自湖南 艾方 生 物 公 司, P- 糖 蛋 白(P-glucoprotein,P-gp) 和GAPDH 抗体购自武汉爱博泰克生物公司,Notch1 和Hes1 抗体、荧光二抗、CCK-8 试剂盒、放射性免疫沉淀测定(radio immunoprecipitation assay,RIPA)裂解液,二辛可宁酸(bicinchoninic acid,BCA)试剂盒及ECL 发光试剂盒均购自上海碧云天生物公司。Western blotting 电泳设备购自美国Bio-Rad 公司, 正置荧光显微镜购自日本Olympus 公司,全自动酶标仪购自美国Bio-Tek公司。
1.2 细胞培养将A549 细胞置于含10%胎牛血清的高糖DMEM 培养基(含1%青霉素和1%链霉素)中,置于5% CO2、37 ℃饱和湿度的孵箱中常规培养。
1.3 siRNA 转染和分组选取对数生长期细胞,以2.5×105个/孔的密度接种于6 孔细胞培养板,待细胞达到30%~50%融合时行siRNA 转染。转染步骤按照LipofectamineTM2000 说明书进行,分别于转染后6 h 更换为含血清的DMEM 培养基。实验分为空白对照组、si-NC 组(转染对照siRNA)和si-FOXP3 组(转 染FOXP3 siRNA)。si-NC 序列: 5'-UUCUCCGAACGUGUCACGUdTdT-3';si-FOXP3 序 列:5'-CAUGGACUACUUCAAGUUCdTdT-3'。
1.4 免疫荧光法检测各组A549 细胞中FOXP3 表达情况0.25% 胰酶消化转染48 h 的各组细胞,滴于6 孔细胞培养板中的盖玻片上进行爬片。次日,PBS 缓冲液洗涤细胞玻片,80%乙醇4 ℃孵育10 min;PBS 缓冲液洗涤3 次,加入细胞打孔液室温孵育20 min;加入 anti-FOXP3 一抗 4 ℃过夜;次日PBS 缓冲液洗涤3 次,加入FITC 荧光标记的二抗 37 ℃避光孵育 1 h;PBS 缓冲液洗涤3 次,DAPI 染核 5 min,封片后在荧光显微镜下拍摄并采集图像。以免疫荧光强度代表FOXP3 表达水平。
1.5 Western blotting 法 检 测各组A549 细胞中FOXP3、P-gp、Notch1 和Hes1 蛋白表达水平收集转染72 h 的各组细胞,加入细胞裂解液裂解细胞并提取细胞总蛋白,BCA 蛋白试剂盒定量检测蛋白,沸水浴中煮沸6 min 使蛋白变性。每孔加入30 μg蛋白,行10% SDS 聚丙烯酰胺凝胶电泳,采用湿转方式将蛋白移至PVDF 膜,5% BSA 室温下封闭1 h 后 分 别 滴 加 一 抗 FOXP3(1∶500)、P-gp(1∶1 000)、Notch1(1∶1 000)、Hes1(1∶1 000)和GAPDH (1∶1 000),4 ℃过 夜。TBST 溶 液 清洗3 次 后 室 温 孵 育 HRP 标 记 的 IgG 抗 体(1 ∶3 000)1 h,加入ECL 显色底物,采用凝胶成像系统拍照,实验重复3 次。采用Image J 软件分析各条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH 蛋白条带灰度值。
1.6 CCK-8 法检测各组A549细胞增殖活性
0.25%胰酶消化转染24 h 的各组细胞,以5×103个/孔的密度接种于96 孔细胞培养板中,每组设3 个复孔。次日于各组细胞中分别加入不同浓度(0.5~8.0 mg·L-1) Dox,培 养48 h 后 每 孔 加 入10 μL CCK-8 溶液,37 ℃ 孵育2 h。采用酶标分析仪在450 nm 波长处测量各孔吸光度(A)值,计算各组细胞增殖活性。细胞增殖活性= (给药组平均A 值/对照组平均A 值) ×100%。采用SPSS 17.0 统计软件中的Probit 回归模型计算Dox 对细胞的 半 数 抑 制 浓 度 (half maximal inhibitory concentration, IC50)值。
1.7 Western blotting 法检测DAPT 作用后各组A549 细 胞 中FOXP3、P-gp、Notch1 和Hes1 蛋 白 表达水平将对数生长期的A549 细胞,以每孔5×105个细胞的密度接种于6 孔细胞培养板中,每组设3 个复孔。次日各组细胞中分别加入0、10 和20 μmol·L-1DAPT, 作 为0、 10 和20 μmol·L-1DAPT 组,检测各组A549 细胞中FOXP3、P-gp、Notch1 和Hes1 蛋白表达水平。另取A549 细胞,分别加 入0 μ mol·L-1DAPT、1.0 mg·L-1Dox 和1.0 mg·L-1Dox 联 合10 μ mol·L-1DAPT,作 为0 μ mol·L-1DAPT 组、 1.0 mg·L-1Dox 组 和1.0 mg·L-1Dox 联合10 μmol·L-1DAPT 组。培养48 h,采用“1.5”中的方法检测各组A549 细胞中目的蛋白表达水平。
1.8 统计学分析采用SPSS 17.0 统计软件进行统计学分析。各组细胞增殖活性,细胞中FOXP3、Notch1、Hes1 和P-gp 蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 各组A549 细胞中FOXP3 蛋白表达水平免疫荧光法检测各组细胞中FOXP3 蛋白表达,结果显示FOXP3 标记的免疫荧光强度明显减弱,见图1。Western blotting 法检测结果显示:与空白对 照 组(0.62±0.05) 和si-NC 组(0.58±0.04)比较,si-FOXP3 组A549 细胞中FOXP3 蛋白表达水平(0.21±0.03)明显降低(P<0.01)。

图1 免疫荧光法检测各组A549 细胞中FOXP3 蛋白表达Fig.1 Expressions of FOXP3 in A549 cells in various groups detected by immunofluorescence method
2.2 各组A549 细胞增殖活性和IC50值CCK-8 法检测结果显示:在0.5~8.0 mg·L-1范围内,Dox呈浓度依赖性抑制各组A549 细胞增殖活性。在Dox≥1.0 mg·L-1时,与空白对照组和si-NC 组比较,si-FOXP3组细胞增殖活性明显降低(P<0.05或P<0.01);si-FOXP3 组IC50值(3.64 mg·L-1±0.44 mg·L-1)明显低于空白对照组(5.94 mg·L-1±0.50 mg·L-1) 和 si-NC 组 (5.69 mg·L-1±0.41 mg·L-1)(P<0.01)。见图2。

图2 CCK-8 法检测各组A549 细胞增殖活性和IC50值Fig.2 Proliferation activities of A549 cells and IC50 values in various groups detected by CCK-8 method
2.3 各 组A549 细胞中Notch1、Hes1 和FOXP3 蛋白表达水平Western blotting 法检测结果显示:与空白对照组和si-NC 组比较,si-FOXP3 组A549 细胞中Notch1、Hes1 和FOXP3 蛋白表达水平明显降低 (P< 0.01)。见图3。
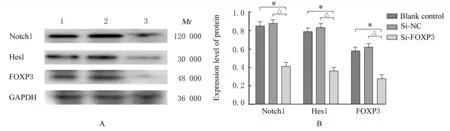
图3 Western blotting 法检测各组A549 细胞中Notch1、Hes1 和FOXP3 蛋白表达电泳图(A)和直条图(B)Fig.3 Electrophoregram(A) and histogram(B) of expressions of Notch1,Hes1,and FOXP3 proteins in A549 cells in various groups detected by Western blotting method
2.4 DAPT 处理后各组A549 细胞中Notch1、Hes1和FOXP3 蛋白表达水平与0 μmol·L-1DAPT 组比 较,10 和20 μmol·L-1DAPT 组A549 细 胞 中Notch1、Hes1 和FOXP3 蛋白表达水平明显降低(P<0.01),呈剂量依赖性。见图4。
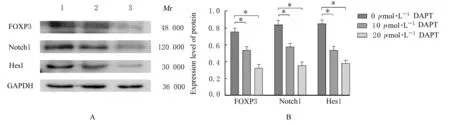
图4 Western blotting 法检测DAPT 处理后各组A549 细胞中Notch1、Hes1 和FOXP3 蛋白表达电泳图(A)和直条图(B)Fig.4 Electrophoregram(A) and histogram(B) of expressions of Notch1,Hes1,and FOXP3 proteins in A549 cells in various groups after treated with DAPT detected by Western blotting method
2.5 Dox 单独及联合DAPT 处理后各组A549 细胞中FOXP3、P-gp、Notch1 和Hes1 蛋白表达水平与
0 μmol·L-1DAPT 组 比 较,1.0 mg·L-1Dox 组A549 细 胞 中FOXP3、P-gp、Notch1 和Hes1 蛋 白表 达 水 平 明 显 升 高(P<0.01);与1.0 mg·L-1Dox 组 比 较,1.0 mg·L-1Dox 联 合10 μmol·L-1DAPT 组A549 细 胞 中FOXP3、P-gp、Notch1 和Hes1 蛋白表达水平明显降低(P<0.01)。见图5。
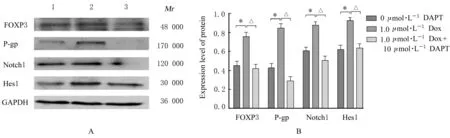
图5 Dox 单独和联合DAPT 作用后各组A549 细胞中FOXP3、P-gp、Notch1 和Hes1 蛋白表达电泳图(A)和直条图(B)Fig.5 Electrophoregram(A) and histogram(B) of expressions of FOXP3,P-gp,Notch1,and Hes1 proteins in A549 cells in various groups after treated with Dox alone or in combination with DAPT
3 讨 论
研究[4-11,16-18]显示:FOXP3 在Tregs 和肿瘤细胞中呈高表达,不仅参与肿瘤的侵袭和转移,还与化疗耐药关系密切。胃癌晚期患者接受新辅助化疗后,外周血和肿瘤组织中Tregs 数明显减少,患者生存期提高,表明肿瘤患者体内FOXP3+Tregs 数可影响化疗效果[16-17]。LIANG 等[18]研究显示:化疗药物替莫唑胺作用后,FOXP3 过表达的胶质母细胞瘤细胞IC50值升高,表明FOXP3 参与替莫唑胺的耐药作用。本课题组前期研究[9-10]显示:FOXP3 沉默的人NSCLC A549 细胞对顺铂和5-氟尿嘧啶的化疗敏感性增加,FOXP3 过表达小鼠Lewis 肺癌细胞对Dox 和丝裂霉素C 的化疗敏感性降低[11],上 述结果表明FOXP3 参与NSCLC 细胞对化疗药物的抵抗作用,但其作用机制尚不明确。因此,本研究选择Dox 作为代表性化疗药,采用siRNA 法沉默A549 细胞中FOXP3 基因,验证其对Dox 耐药性的影响并探讨其相关机制。本研究结果显示:不同浓度Dox 作用后, A549 细胞的活性和IC50值明显降低,表明FOXP3 表达下调可提高NSCLC 细胞对Dox 的敏感性,改善对Dox 的耐药作用。
肿瘤细胞中Notch1 信号通路的异常活化不仅参与肿瘤的侵袭和转移等恶性行为,还与化疗药物的 耐 药 作 用 密 切 相 关[12-13]。 研 究[19-20]显 示:Notch1 信号通路参与顺铂的耐药作用,抑制Notch1 信号通路可增强顺铂对卵巢癌细胞和三阴性乳腺癌细胞的敏感性,降低肿瘤细胞对顺铂的化疗抵抗。本课题组前期研究[15]显示:抑制Notch1信号通路后,肺腺癌细胞对顺铂的敏感性明显增加。此外,Notch1 信号通路还与Dox 的耐药性关系密切。抑制Notch1 信号通路能增强骨肉瘤细胞对Dox 的化疗敏感性,抑制Dox 对骨肉瘤干细胞的富集作用[21]。沉默Notch1 基因可降低肺癌细胞对Dox 的耐药性,其作用机制与PTEN 表达上调有关[22]。最新研究[23-24]显示:沉默T 细胞-急性淋巴白血病细胞中FOXP3 表达可下调Notch1 和Hes1 mRNA 表达,阻断黑色素瘤细胞Notch1 信号通路后FOXP3 表达降低。Hes1 是Notch1 信号通路下游的关键靶基因,因此本研究推测FOXP3 介导的Dox 耐药作用可能与Notch1/Hes1 信号通路有密切联系,A549 细胞中FOXP3 与Notch1/Hes1 信号通路之间具有双向调节作用。FOXP3 沉默后,Notch1 和Hes1 蛋白表达水平降低,提示FOXP3 蛋白表达水平可影响Notch1/Hes1 信号通路的活性。Notch1 信号通路抑制剂DAPT 作用后,FOXP3 蛋白表达水平降低,且呈剂量依赖性,且与Notch1和Hes1 下降的趋势相符,表明Notch1/Hes1 信号通路也可调控FOXP3 表达。
肿瘤细胞高表达P-gp,这是化疗耐药的主要机制之一,P-gp 是跨膜转运蛋白,作为一种能量依赖的外排泵,能将进入细胞中的化疗药物排出细胞外,从而降低化疗效果[25-26]。本课题组前期研究[10,15]显示:在NSCLC 细胞中,FOXP3 基因沉默和阻断Notch1 信号通路均可抑制P-gp 表达,由此推测FOXP3 诱导的Dox 耐药作用可能是通过Notch1/Hes1 信号通路调控P-gp 表达实现的。本研究结果显示:Dox 处理后,A549 细胞中FOXP3、P-gp、Notch1 和Hes1 蛋白表达水平均升高,而在联合DAPT 处理后,上述蛋白表达水平均降低,表明Dox 的耐药作用与FOXP3 和P-gp 高表达及Notch1/Hes1 信号通路的活化有密切关联,阻断Notch1/Hes1 信号通路可逆转Dox 诱导的FOXP3和P-gp 高表达。因此,Notch1/Hes1 信号通路可能通过调控P-gp 表达参与FOXP3 介导的Dox 耐药作用。
综上所述,FOXP3 基因沉默可提高NSCLC 细胞对Dox 的敏感性,其作用机制与抑制Notch1/Hes1 信号通路有关。本研究结果不仅为FOXP3 参与NSCLC 化疗耐药提供了新的理论, 也为NSCLC 的靶向治疗提供了潜在的分子靶点。
