5 种致泻大肠埃希氏菌不同浓度下的国标法检出率分析
2023-11-11胡春红陆其聪
胡春红,陆其聪
(四川省轻工业研究设计院有限公司,四川成都 610081)
致泻大肠埃希氏菌是一类重要的食源性病原体,是引起肠道疾病相关的食源性疾病的主要病原菌,可导致人或动物腹泻、腹痛甚至出血性腹泻[1-2]。常见的引起人类发病的致泻大肠埃希氏菌有5 种,包括肠道致病性大肠埃希氏菌、肠道侵袭性大肠埃希氏菌、产肠毒素大肠埃希氏菌、产志贺毒素大肠埃希氏菌(或称为肠出血性大肠埃希氏菌)与肠道聚集性大肠埃希氏菌[3-4]。致泻大肠埃希氏菌存在于人和动物的肠道中,人群普遍易感,会引起急性胃炎、急性菌痢、出血性肠炎等多种疾病,传播方式多种多样,包括饮用水、食物、日常生活用品、蚊蝇昆虫传播等[5]。
《食品安全国家标准 预包装食品中致病菌限量》(GB 29921—2021)[6]规定肉制品(仅适用于牛肉制品、即食生肉制品、发酵肉制品类)、即食果蔬制品(仅适用于去皮或预切的水果及上述类别混合食品)中,致泻大肠埃希氏菌不得检出。此类食品易受食品从业人员和食材本身的微生物污染,且一旦污染,微生物繁殖速度较快。在对食品从业人员和公共场所从业人员进行卫生检测时,致泻大肠埃希氏菌的检出率明显高于沙门氏菌和志贺氏菌[7]。近年来,致泻性大肠埃希氏菌在急性腹泻粪标本中的检出率有所增加[8-9]。致泻性大肠埃希氏菌引起的食品安全问题对人类健康和社会经济造成了严重的影响[10]。食品中致泻大肠埃希氏菌的检测是预防和控制由该菌引起的食源性疾病的关键[11]。近年来,大多学者致力于研究致泻大肠埃希氏菌的致病机制和分子生物技术,而对标准中样品前处理方法的研究较少,有文献中写明当进行阳性对照时,染菌量应控制在每25 g 样品中含10 ~100 CFU 活菌,但对选择此浓度的原因没有提及[12]。本次实验主要研究采用《食品安全国家标准 食品微生物学检验 致泻大肠埃希氏菌检验》(GB 4789.6—2016)(以下简称国标法)检测时染菌量的范围,以及在较低染菌量时是否能检出病原菌。
1 材料与方法
1.1 材料与试剂
标准菌株: 产肠毒素大肠埃希菌ETEC(CICC24190)、 肠道侵袭性大肠埃希菌EIEC(CICC24188)、 肠道致病性大肠埃希菌EPEC(CICC24189)、肠道集聚性大肠埃希菌EAEC(CICC24186)、 肠出血性大肠埃希菌EHEC(CICC24187),均购于中国工业微生物菌种保藏管理中心;脑心浸出液肉汤(Brain Heart Infusion,BHI)、营养肉汤、肠道增菌肉汤、麦康凯琼脂(MacConkey Agar,MAC)、 伊红美蓝琼脂(Eosin-Methylene Blue,EMB),均购于广东环凯微生物科技有限公司。
1.2 仪器与设备
恒温培养箱,上海一恒科学仪器有限公司;Bio-II-Advance4 生物安全柜,Telstar;微量移液枪(10 ~100 μL、100 ~1 000 μL),eppendorf。
1.3 实验方法
1.3.1 前增菌
将5 种致泻大肠埃希氏菌标准菌株分别接种于BHI,(36±1)℃培养18 h。用无菌磷酸盐缓冲液将5 种致泻大肠埃希氏菌的菌液浓度稀释至1 ~3 CFU·mL-1、10 ~30 CFU·mL-1、100 ~300 CFU·mL-1,视为样品原液。分别取上述3 种浓度的样品原液1 mL 加于250 mL 营养肉汤中,于(36±1) ℃培养6 h 后,取预增菌液接种于30 mL肠道增菌肉汤管中,接种体积为10 μL、50 μL、100 μL、500 μL、1 000 μL,每个体积接种10 管,于(42±1)℃培养18 h。
1.3.2 分离培养
将增菌液分别划线于EMB 和MAC 平板,于(36±1)℃培养24 h,观察并记录平板上的菌落生长情况。在MAC 琼脂平板上,分解乳糖的典型菌落为砖红色至桃红色,不分解乳糖的菌落为无色或淡粉色;在EMB 琼脂平板上,分解乳糖的典型菌落为中心紫黑色带或不带金属光泽,不分解乳糖的菌落为无色或淡粉色,有典型菌落生长即视为检出。因本次实验中只加入标准菌株,所用耗材、培养基均按规定要求灭菌处理,没有杂菌干扰,故不再进行后续生化鉴定和PCR 确证实验。实验重复1 次。
2 结果与分析
两次实验结果中5 种致泻大肠埃希氏菌接种量为10 ~30 CFU 和100 ~300 CFU 时,二次增菌的接种体积在10 μL、50 μL、100 μL、500 μL、1 000 μL 时均能检出。因此,当其接种量大于10 CFU 时,按国标法二次增菌取10 μL 的接种量均能检出。5 种致泻大肠埃希氏菌接种量为1 ~3 CFU 时,二次增菌时的接种体积只在500 μL、1 000 μL 时能全部检出,检出率为100%。5 种致泻大肠埃希氏菌接种量为1 ~3 CFU,接种体积为10 μL、50 μL、100 μL 的检出结果见表1,二次增菌时取10 μL 或50 μL 预增菌液至肠道增菌肉汤中,其平均检出率均不能达到100%;二次增菌接种体积增加到100 μL时,EAEC(CICC24186)、EHEC(CICC24187)、ETEC(CICC24190)的检出率能达到100%,而EIEC(CICC24188)、EPEC(CICC24189)的检出率仍不能达到100%。由此,当所检样品中致泻大肠埃希氏菌含量较低时,采用国标中规定的取10 μL预增菌液接种于肠道增菌肉汤中进行二次增菌,漏检可能性较大。
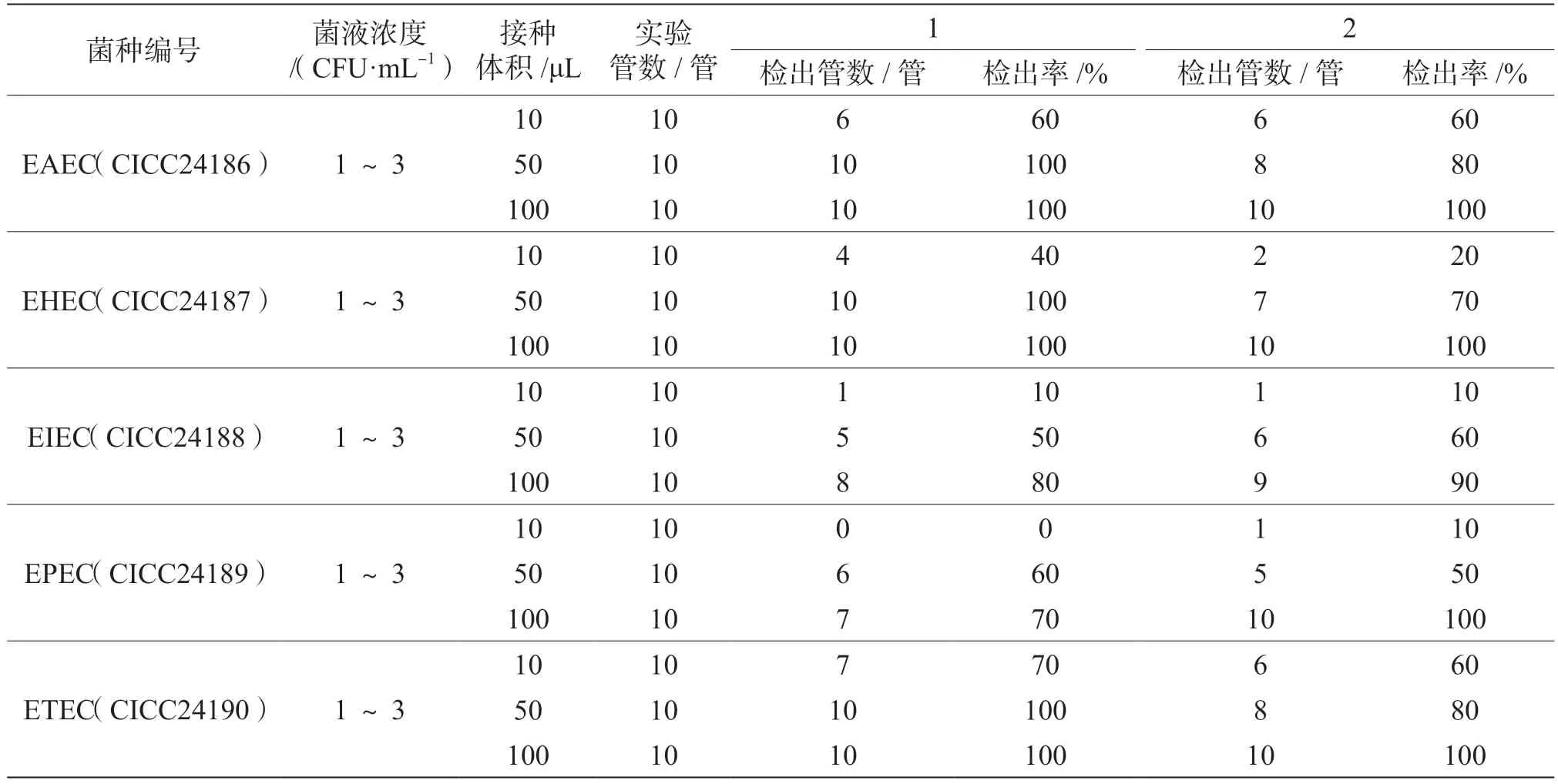
表1 5 种致泻大肠埃希氏菌不同接种体积下的检出率
3 结论与讨论
国标中预增菌培养基营养肉汤(用于一般细菌培养、转种、复壮、增菌等)无选择性,其预增菌时间6 h 较短,有利于目标菌的筛选,二次增菌培养基为肠道增菌肉汤(用于肠道菌的增菌培养,可以抑制非肠杆菌科细菌的生长),增菌时间18 h 较长,可以修复有损伤的目标菌,但也可能导致杂菌过多,不利于目标菌检出[13]。二次增菌取样量只取10 μL 也可能是基于为增加目标菌检出率的考虑,但当检测样品中致泻大肠埃希氏菌的含量比较低时,二次增菌取10 μL 的接种体积存在漏检可能。此次实验中只考虑了接种标准菌株时的检出率,而实际样品中可能包含若干种其他微生物,各种微生物在检测过程中都会繁衍增殖,其实际检出率受其他微生物影响可能会更低。因此,在实际检测工作中,在所检样品中微生物含量较低时,可考虑增加二次增菌的接种量,减少漏检可能。在实际检测工作中,由于样品中多种微生物的干扰,还需要进行后续生化鉴定和PCR 确证实验才能判定。
