抗番茄早疫病放线菌的筛选与防效研究
2023-11-09邵嘉朱袁歆瑜廖鑫琳蒋冬花
邵嘉朱, 郭 鑫, 袁歆瑜, 宋 振, 廖鑫琳, 蒋冬花
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
番茄早疫病是由茄链格孢菌(Alternariasolani,As)引起的一种真菌性病害,在番茄整个生长周期中均可发病,主要侵染叶片、茎和果实.该病在流行年份可致使番茄减产高达50%[1],此病菌对马铃薯、辣椒、茄子等多种作物均具有侵染性[2].目前,番茄早疫病的防治主要依靠选育抗病品种、加强栽培管理和化学防治等手段,其中化学农药的广泛使用极易诱发植株产生抗药性、危害环境.
生物防治以其选择性高、绿色、安全无毒等优点,日益受到国内外环境保护研究者的重视[3].利用有益生防菌防治植物病害已有相关报道.例如,高振峰[4]从不同来源植物内生细菌中筛选得到1株对番茄灰霉病菌(Botrytiscinerea)有良好田间防效的贝莱斯芽孢杆菌(Bacillusvelezensis)SY-1,其对番茄灰霉防效可达80.33%;刘冬等[5]分离得到解淀粉芽孢杆菌(Bacillusamyloliquefaciens)JDF3,可有效抑制大豆疫霉(Phytophthorasoiae)的生长和孢子囊的产生,盆栽结果表明,其对大豆疫霉的防治率为70.7%;Amaresan等[6]从番茄叶组织中分离得到抗植物病原真菌的BETS11菌株,对西瓜枯萎病菌(Fusariumoxysporumf. sp.niveum)、黄瓜枯萎病菌(Fusariumoxysporumf. sp.cucumerinum)、西瓜炭疽病菌(Colletotrichumlagenerium)均具有良好的防治效果.
放线菌是产生农用抗生素的重要微生物资源,实际生产所用的抗生素约70%是由各种链霉菌产生,因此其在植物病害生物防治中具有广阔的应用前景.Li等[7]发现,链霉菌LA-5的代谢产物可有效抑制番茄灰霉病菌(Botrytiscinerea)分生孢子的产生及菌丝的生长;Djebaili等[8]发现,一株白黄链霉菌(Streptomycesalbidoflavus)对丁香假单胞菌(Pseudomonassyringae)有较强的体外抗菌活性,还可有效抑制尖孢镰刀菌(Fusariumoxysporum)菌丝的生长;周天惠等[9]发明公开了一种可可链霉菌(Streptomycescacaoi)生防菌剂产品,该链霉菌对苹果炭疽叶枯病(Glomerellacingulata)、苹果斑点落叶病(Alternariaalternataf. sp.mali)、番茄早疫病(A.solani)均具有较好的防治效果.
番茄早疫病造成番茄产量与品质的下降,因生物防治法具有成本低廉、绿色环保可持续等显著特点,现被广泛应用于农业防治等相关领域中.本研究从不同生境土壤中筛选出形态各异的放线菌,采用共培养法初筛与菌丝生长抑制法复筛,得到具有拮抗番茄早疫病菌的放线菌,并对其进行种属鉴定、发酵液稳定性、抗菌谱分析及防效实验,以期为番茄早疫病害的生物防治提供理论依据,进而推动微生物农药制剂的开发.
1 材料与方法
1.1 材 料
1.1.1 菌株来源
放线菌菌株:采自植被覆盖率好、腐殖质丰富的番茄、香樟、龙爪槐等根际土壤,经多次分离、纯化后获得.植物病原细菌:大豆细菌性斑点菌(Pseudomonassyringaepv.glycinea,NEAU1)、水稻细菌性条斑病菌(Xanthomonasoryzaepv.oryzicola,RS105)、大豆细菌性斑疹病菌(Xanthomonasaxonopodispv.glycines,NJAU4)、番茄细菌性叶斑病菌(Pseudomonassyringaepv.tomato,DC3000)、野油菜黄单胞病菌(Xanthomonascampestrispv.campestris,ZJNb5)、烟草青枯病菌(Ralstoniasolanacearum,Ms43)、烟草野火病菌(Pseudomonassyringaepv.tabaci,Ms57)、水稻白叶枯病菌(Xanthomonasoryzaepv.oryzae,ZJNb6)8种植物病原细菌,由浙江师范大学微生物资源开发利用实验室提供,保存于-80 ℃冰箱.植物病原真菌:苦瓜枯萎病菌(Fusariumoxysporumf. sp.momordicae,Ms12)、杨树枯萎病菌(Fusariumsolani,Ms26)、西瓜炭疽病菌(Colletotrichumlagenerium,Ms39)、番茄早疫病菌(As,Ms65)、小麦全蚀病菌(Gaeumannomycesgraminis,Ms61)、假禾谷镰刀病菌(Fusariumpseudograminearum,Ms66)6种植物病原真菌,由浙江师范大学微生物资源开发利用实验室提供,供真菌抗菌谱测定.其中:As用于放线菌筛选、稳定性及防效实验.
1.1.2 供试番茄品种
选用对番茄早疫病易感的3个番茄品种(粉红嘉丽、金珠、亚非1号),用于As防效研究.
1.1.3 培养基
高氏1号培养基:用于放线菌菌株分离纯化,购置于青岛高科技工业园海博生物技术有限公司.牛肉膏蛋白胨培养基:用于植物病原细菌的培养,购置于北京索莱宝科技有限公司.马铃薯葡萄糖琼脂培养基:用于植物病原真菌的培养,购置于青岛高科技工业园海博生物技术有限公司.
1.2 方 法
1.2.1 放线菌的分离纯化和保藏
从土壤中分离具有典型放线菌菌落特征的单菌落,经3次划线纯化后得纯菌株,保藏备用,具体分离纯化方法参考文献[10].
1.2.2 拮抗As放线菌的筛选
共培养法初筛:取放线菌菌饼接种于PDA培养基中央,四周等距接种As菌饼,28 ℃培养,直至对照培养基(中央放置高氏1号培养基菌饼)菌丝长满培养皿,测量抑菌圈大小,初步筛选有拮抗作用的放线菌菌株.
发酵滤液制备:接种目标放线菌菌饼于高氏1号液体培养基中,摇床(28 ℃,160 r/min)发酵培养7 d,取适量发酵液于离心管中,10 000 r/min离心5 min,随后将上清液滤过0.22 μm滤膜,即得无菌发酵滤液.
用菌丝生长抑制法[11]测量菌落大小,比较菌落生长差异并计算菌丝抑制率[12],挑选具有较强拮抗作用的目标放线菌用于后续实验.
1.2.3 拮抗As放线菌的筛选
形态特征观察[13]: 通过插片法与扫描电镜观察放线菌基内菌丝、气生菌丝、孢子丝等形态特征.生理生化实验[14]:具体方法参照《放线菌快速鉴定与系统分类》[15]进行.16S rDNA序列测序分析:将目标菌株平板送至上海生物工程股份有限公司测序,得到的16S rDNA序列用BLAST比对进行分析,采用MEGA-X软件中Neighbor-Joining法构建系统发育树[16],结合生理生化和形态学特征确定目标菌株种属.
1.2.4 目标菌株抗菌谱测定
对植物病原细菌的抑菌作用:采用牛津杯法测定菌株Sa-6发酵液对8种植物病原细菌的抑制作用,每组实验各设置3次重复.具体实验方法可参考文献[17].对植物病原真菌的抑菌作用:采用菌丝生长抑制法[11]测定菌株Sa-6发酵液对6种植物病原真菌的抑制作用,每组实验各设置3次重复.
1.2.5 目标菌株发酵液抑菌活性物质稳定性研究
将目标菌株发酵液分别置于紫外灯和普通日光灯下照射相应时长后;在所设温度下处理2 h后放至室温;在所设酸碱度下处理2 h后调回原始pH(pH7.4).按照菌丝生长抑制法测定不同条件处理下的发酵液抑菌活性,每组实验重复3次.
1.2.6 目标菌株粗浸膏的最低抑制浓度测定
将菌株Sa-6滤液与等体积的乙酸乙酯混合萃取,直至上层乙酸乙酯层无色.将得到的乙酸乙酯层合并,在旋转蒸发仪上50 ℃蒸发浓缩,即得菌株Sa-6发酵液的乙酸乙酯粗浸膏.取As菌饼接种于含不同粗浸膏质量浓度的PDA培养基中央,以不加粗浸膏的PDA培养基作为空白对照,28 ℃培养5 d,测量菌落直径,实验重复3次,记录As不生长的粗浸膏质量浓度,即为粗浸膏最低抑制浓度.
1.2.7 目标菌株发酵液拮抗As的防效研究
番茄幼苗培育[18]:取经过酒精表面消毒处理后的粉红嘉丽、金珠、亚非1号3个品种的番茄种子各15粒放于培养皿中,加 5 mL无菌水,26 ℃黑暗培养至种子露白后播种到盆钵土壤中,置于光照培养箱培养40 d.
As病菌接种和处理:取番茄植株的2片真叶,用注射器在叶片下表面制造伤口,用封口膜将菌饼固定于伤口处,每片叶片接种1个菌饼,保湿24 h.将盆栽放置于26 ℃光照培养箱,7 d后将薄膜和菌饼取下统计发病情况.
实验设置对照组(CK)和处理组(T),每处理 10个生物学重复:空白对照(CK1);只接种琼脂块;接菌对照(CK2):只接As菌饼;处理1(T1):在叶片上先喷洒发酵滤液10倍稀释液至液体从叶片滴落,喷洒6次,每次间隔0.5 h,6 h后接种As菌饼叶片伤口上;处理2(T2):处理方法同T1,但先接种As菌饼后喷洒发酵滤液10倍稀释液;处理3(T3):将发酵滤液10倍稀释液浇到土壤至湿润,并在叶片上先喷洒发酵滤液10倍稀释液至液体从叶片滴落,喷洒3次,每次间隔1 h,6 h后接种As菌饼至叶片伤口上.
待病情发展趋于稳定后,统计发病情况.以叶片为单位调查病情,番茄早疫病病情分0~4 级,标准如下[19]:0级:全株叶片无病斑;1级:病斑面积占叶片总面积的1/4以下;2级:病斑面积占叶片总面积的1/4~1/2;3级:病斑面积占叶片总面积的<1/2~3/4,近一半小叶枯死;4级:病斑面积占叶片总面积的3/4以上,一半以上小叶枯死.根据以上病情分级标准,计算病情指数和相对防效[20].
2 结果与分析
2.1 拮抗As放线菌菌株的筛选
经分离纯化共获138株放线菌纯菌株,代表性放线菌纯菌株在高氏1号培养基培养7 d的菌落(见图1).

A:空白对照;B:菌株Sa-6菌饼 图2 菌株Sa-6对As的抑菌圈
图1 高氏1号培养基上培养7 d的放线菌菌落
采用共培养法和菌丝生长抑制法对分离所得的放线菌进行初筛和复筛,最终筛选获得1株拮抗As作用较强的放线菌,编号为Sa-6,其抑菌圈直径为(46.0±1.5) mm(见图2).
2.2 菌株Sa-6鉴定
2.2.1 菌株Sa-6形态特征
菌株Sa-6在高氏1号培养基上生长迅速;菌落表面突起,颜色多为白色,菌丝与培养基连接不紧密,易于挑起;显微镜观察其基内菌丝和气生菌丝纤细,气生菌丝呈现白色且多分枝,基内菌丝呈现黄绿色相互交缠紧密,孢子丝呈螺旋状(见图3).
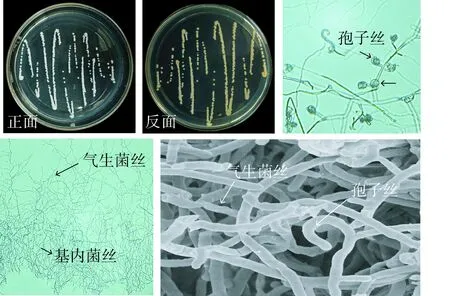
图3 菌株Sa-6的菌落形态和显微结构
2.2.2 菌株Sa-6生理生化特性
菌株Sa-6呈革兰氏阳性,能水解淀粉、纤维素、脂肪、明胶、尿素,产生过氧化氢酶,不产生H2S、黑色素,V-P实验与M-R实验结果呈阴性(见表1和图4).

表1 菌株Sa-6生理生化实验结果

a:淀粉水解圈;b:纤维素水解圈;c:过氧化氢酶分解过氧化氢;d:脂肪酶分解脂肪;e:脲酶分解尿素
菌株Sa-6可以有效利用多种氮源、碳源.其中:对蛋白胨、硝酸钾和多种氨基酸的利用效果较好;鼠李糖、麦芽糖、棉子糖则是菌株Sa-6高效利用的碳源(见表2).

表2 菌株Sa-6碳源、氮源利用实验结果
2.2.3 16S rDNA序列分析结果
Sa-6的16S rDNA序列长度为1 461 bp,与微黄白链霉菌(Streptomycesalbiflaviniger)的进化距离最近(见图5),相似度达99.78%.

图5 菌株Sa-6进化树
结合菌株Sa-6的菌落形态、显微结构、链霉菌属(Streptomyces)分种检索表及16S rDNA序列分析,鉴定其为微黄白链霉菌(Streptomycesalbiflaviniger).
2.3 菌株Sa-6抗菌谱分析
菌株Sa-6发酵液的抗菌谱广,对6种植物病原真菌均具有明显的拮抗作用,其中对杨树枯萎病菌(F.solani)和小麦全蚀病菌(G.graminis)抑制作用较好,菌丝抑制率分别为87.6%,98.3%,对假禾谷镰刀菌(F.pseudograminearum)抑制作用次之,菌丝抑制率分别为75.8%,对苦瓜枯萎病菌(F.oxysporumf. sp.momordicae)和西瓜炭疽病菌(C.orbiculare)抑制作用较差,但菌丝抑制率仍能达到55%以上(见表3和图6).
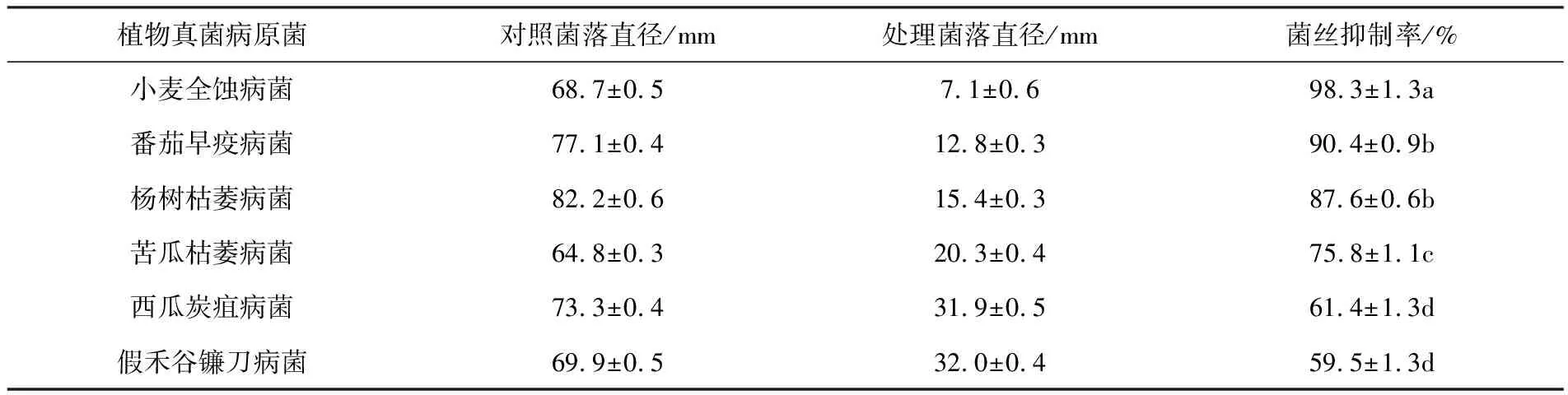
表3 菌株Sa-6发酵液对6种植物病原真菌的抑菌效果

A1~F1:CK,不加入发酵液处理;A2~F2:加菌株Sa-6发酵液处理
抗植物病原细菌谱测定结果表明:菌株Sa-6发酵液对8种植物病原细菌均具有明显的拮抗作用,其中对大豆细菌性斑疹病菌(X.axonopodispv.glycines)抑制效果显著,抑菌圈直径可达(53.8±1.5) mm,其次为水稻细菌性条斑病菌(X.oryzaepv.oryzicola)、大豆细菌性斑点病菌(P.syringaepv.glycinea)、烟草青枯病菌(R.solanacearum),抑菌圈直径分别为(51.0±2.2),(45.4±2.8),(40.5±1.5) mm(见表4).
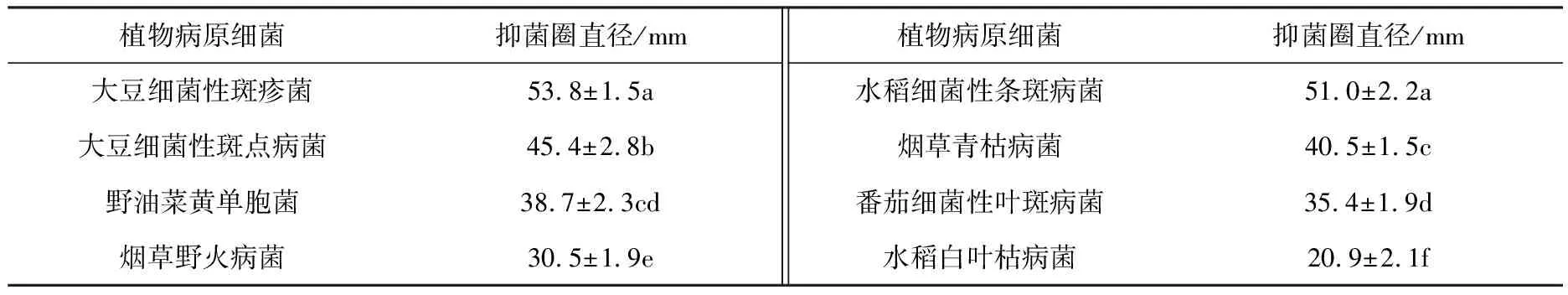
表4 菌株Sa-6发酵液对8种植物病原细菌的抑菌效果
2.4 菌株Sa-6发酵液抑菌活性物质稳定性
以番茄早疫病原真菌为对象,测试菌株Sa-6发酵液抑制活性物质的稳定性发现,对照组(CK)抑菌圈直径(33.53±0.45) mm,处理组50~60 ℃抑菌圈直径与对照组无显著性差异,表明菌株Sa-6发酵液抑菌活性物质在60 ℃以下可保持较好活性,当温度超过60 ℃时,活性明显下降;在日光灯下发酵液稳定性基本保持不变,紫外光下稳定性随照射时间增加而缓慢下降,表明菌株Sa-6发酵液种所含的抗菌成分可能对紫外光较敏感,紫外光长时间照射抑菌活性物质易失活;菌株Sa-6发酵液在pH偏中性(pH6~8)时,抑菌活性物质较稳定且抑菌效果好,在酸性、碱性条件下,抑菌活性逐渐减弱,在强酸(pH3)条件下抑菌圈直径仅为(21.70±0.36) mm,较对照组(pH7.4)减弱35.28%,在强碱(pH11)条件下抑菌圈直径仅为(21.13±1.23) mm,较对照组减弱36.98%(见图7).

图7 菌株Sa-6发酵液在不同温度、光照、pH处理下的稳定性
2.5 目标菌株粗浸膏的最低抑制浓度
通过菌丝生长速率抑制法测定菌株Sa-6发酵液的乙酸乙酯粗浸膏对As的拮抗能力,结果表明:As在含有1,2,4,8,16,32,64 μg/mL的粗浸膏培养基上能够生长,其中在对照组As菌落直径可达74 mm,As菌落直径随粗浸膏质量浓度的增加而逐渐减小,当粗浸膏质量浓度为8 μg/mL时,菌丝抑制率可达50%以上,当质量浓度为128 μg/mL时,番茄早疫病菌菌落大小与初始菌饼大小基本无明显差异,表明在此质量浓度下菌丝不生长,因此,推测菌株Sa-6发酵液粗浸膏对As的最低抑制浓度为128 μg/mL(见图8).

图8 粗浸膏对番茄早疫病菌菌丝的抑制作用
2.6 菌株Sa-6发酵液对番茄早疫病的防效
菌株Sa-6发酵滤液10倍稀释液处理可显著降低番茄早疫病的病情指数.通过将发酵滤液10倍稀释液浇至土壤湿润,每间隔1 h喷洒发酵滤液10倍稀释液于番茄叶片上,共喷洒3次,6 h后接种As菌饼至番茄叶片伤口处,观察发现该处理组对番茄早疫病具有较好的防治效果,并且针对粉红嘉丽、金珠、亚非1号3个番茄品种相对防效均达到90%以上,因此研究证明,将发酵滤液10倍稀释液同时浇至土壤中和喷洒至叶片表面,防效最佳.结果还显示,在病菌接种前喷洒发酵滤液10倍稀释液比接种后再喷洒效果更好,表明预防效果优于治疗效果(见表5和图9).

表5 菌株Sa-6发酵液对番茄早疫病的防效实验

图9 菌株Sa-6发酵液对番茄早疫病的防效实验
3 讨 论
生防菌通过不同的作用方式保护植物免受病害的威胁,潘晓梅[21]从原始森林土壤中分离得到1株对番茄灰霉有拮抗作用的细菌XF,抑制率为66.3%,该菌株发酵液可有效提高番茄植株的生物量、根系活力及叶片总叶绿素含量.张思雨[22]筛选分离得到4株对十字花科蔬菜根肿病有显著抑制效果的芽孢杆菌,其中ZF480,ZF129,ZF72菌株可使根肿菌体休眠孢子活力丧失并致死,进而抑制根肿病的发生.张艳军等[23]从土壤中筛选得到一株拮抗烟草赤星病菌的ZJNU菌株(Streptomyceslunalinharesii),该菌株同时对杨树溃疡病菌、水稻白叶枯病菌、番茄早疫病菌和黄瓜枯萎病菌等均有较强的拮抗作用.利用有益微生物或其代谢产物抑制植物病原菌的生长具有选择性强、防治效果好、对人体无毒害、成本低廉等特点,具有广阔的发展前景.
链霉菌在根部到地上部分植物组织定殖方面发挥着重要作用,链霉菌可通过多种方式如产生铁载体和多种酶(淀粉酶、几丁质酶、纤维素酶等)将复杂的营养物质转化为简单的矿物质形式,改善土壤肥力促进植物生长[24].Ningthoujam等[25]从洛克塔克湖中分离得到1株对稻瘟病菌有拮抗作用的链霉菌(Streptomycesvinaceusdrappus),该链霉菌对弯孢叶斑病菌(Curvularialunata)、尖孢镰刀菌(Fusariumoxysporum)均具有明显的拮抗活性,对稻瘟病菌菌丝生长抑制率为53.5%.Rehan等[26]研究发现链霉菌HM10,HM10对尖孢镰刀菌(Fusariumoxysporum)、胶孢炭疽病菌(Colletotrichumgloeosporioides)、番茄早疫病菌(Alternariasolani)等10种土生真菌具有广谱抗性,菌株HM10能够产生高效铁载体和IAA及增溶磷酸盐能力等,对植物促生起着重要作用,有望为微生物生物制剂资源开发提供有力依据.国内外有关微黄白链霉菌(Streptomycesalbiflaviniger)的报道主要集中于代谢产物活性与结构鉴定.郭凯等[27]对分离自云南大学校园的攀枝花苏铁根际土壤的链霉菌Streptomycesalbiflaviniger菌株YN-10-2的化学成分进行结构和活性的研究,分离纯化出6种纳皮拉霉素(napyradiomycin)家族化合物,其中3种化合物对金黄色葡萄球菌有抑菌活性.张云等[28]发现海洋放线菌StreptomycesalbiflavinigerSCSIO ZJ28 的发酵产物具有较好的抗菌活性和卤虫致死活性,并从中分离鉴定出一类糖基化大环内酯类抗生素(elaiophylin).
目前,国内外针对番茄早疫病菌生防研究主要集中于芽孢杆菌类,芽孢杆菌可通过营养及空间位点的竞争,调节根区微生物群落结构,以增强植物抗性.Hao等[29]从红树林土壤中分离得到1株榴红链霉菌(Streptomycespuniceus)L75,L75发酵液的乙酸乙酯粗提物具有广谱抗真菌活性;离体防效表明,该菌株对番茄早疫病害的防效可达90%.Verma等[30]从籼稻表面无菌根组织中分离得到3株内生放线菌,1株为链霉菌;研究发现其孢子悬浮液可有效抑制茄链格孢菌(Alternariasolani)的生长,并对番茄植株有显著的促生作用.国内外关于微黄白链霉菌(Streptomycesalbiflaviniger)应用于番茄早疫病的生物防治尚未见报道.本研究从樟树根际土壤中筛选得到一株对番茄早疫病菌有明显拮抗作用的菌株Sa-6,其发酵液对番茄早疫病菌的抑菌圈可达(46.0±1.5) mm,通过形态特征和显微观察、生理生化、16S rDNA测序分析,将其鉴定为微黄白链霉菌(Streptomycesalbiflaviniger);菌株Sa-6发酵液能够在偏中性条件下保持较好的稳定性,强酸、强碱、高温等极端环境会造成抑菌活性物质失活,其能够抑制多种植物病原真菌与细菌,尤其对小麦全蚀病菌的菌丝抑制率可达98.3%,表明菌株Sa-6具有较强的广谱抗性;盆栽实验显示其对粉红佳丽等3个番茄品种的相对防效可达90%以上,该菌株有望进一步开发成番茄早疫病菌的生防制剂.研究进一步发现,菌株Sa-6发酵液能够在一定程度上促进植物的生长,将在后续研究中继续探讨其防效促生的有效成分,进一步对其进行分子结构和性质探究,并明晰其作用机理,为菌株Sa-6应用于番茄早疫病的生物防治奠定理论基础.
